沉水植物苦草根系功能性状对基质类型和种植密度的响应及其与个体表现关系*
陈俊格,陈 矿,王和云**,易春龙,高 健,文冬华,张润龙
(1:湖北工业大学土木建筑与环境学院,河湖智慧健康感知与生态修复教育部重点实验室,河湖生态修复及藻类利用湖北重点实验室,武汉 430068) (2:中工武大设计集团有限公司,武汉 430223)
沉水植物作为初级生产者,在很多地区成为湖泊生态质量的指示类群[1],且其对于维持浅水湖泊生态系统的“清水稳态”有重要的作用[2]。随着水体富营养化等因素的影响,世界范围内的沉水植物出现大面积退化[3]。沉水植被重建是浅水湖泊水生态重建的关键过程。当前水生态工程中沉水植被的重建主要依靠成株种植或者种子萌发。沉水植物的生长受水下光照[4]和基质条件[5]的制约,且基质是沉水植物生根、繁殖并能够稳定生长的基本条件,同时也是沉水植物养分的直接来源之一[6]。在自然环境中,植物无法像动物一样自由移动,因而在整个生命周期内持续不断遭受种内或种间对共有环境资源的竞争[7],这种限制与种群密度密切相关。研究表明基质类型对沉水植物的根系形态有显著的影响[8],如基质类型的不同会导致总根表面积和总根尖数的差异[9],同时,密度对细根形态具有显著负效应,随着种植密度的增加,细根长度、表面积和体积呈现下降趋势[10]。
功能性状指在个体水平上可测量的任何形态、生理或物候特征[11-12],能反映物种与其栖息地条件的关系,进而揭示植物与环境的相互作用[13]。近年来,随着对植物功能性状研究的深入,学者们发现许多生态学问题都能够从植物功能性状角度得到较好的回答[14-15]。功能性状的应用在水生态系统中尤其重要,原因在于人为污染、栖息地退化(土地利用变化)以及外来物种导致的生物多样性减少和功能同质化在水生态系统中更为突出[16-19]。大量研究表明,植物的根系在生态系统的结构和功能、物种之间的竞争关系以及植物对环境变化的响应方面都发挥着重要的作用[20-21]。如根系的固着能力与根直径相关[22],比根长和根平均直径能体现根系对营养资源的吸收和运输能力[23]。根系结构的改变有助于植物通过吸收水分和沉积物中的养分生存下来[24],除了根生物量和生根数外[25-26],根的其他性状同样是深入理解大型水生植物功能的关键因素[27-28],需要进一步研究。
迄今为止,沉水植物的形态、生理和生活史特征已被普遍了解,并且可能与生态、生物地球化学和物理过程的影响有关[13,29-30]。基于植物性状(trait-based)的生态学的基本定义是功能性状会影响个体表现(例如生存、生长和繁殖),进而决定个体的适合度、种群增长和群落聚集[15,31-32]。生物量分配、营养吸收、个体定植等都属于个体生长表现。植物的根系功能性状的差异能反映个体对生长环境改变和营养、空间资源竞争的响应。目前,基于性状的方法被越来越多地应用于理解环境梯度对生态系统功能影响的机制(如稳定性)[33-37]。越来越多的证据表明,植物可以表现出相当大的种内性状变异[38-42]。在先前的研究中,个体水平的性状也已被用来参数化植物的性状和表现的关系[43-44]。符辉等的研究结果也曾指出,从物种层面转移到个体层面可能有助于处理湖泊治理时存在的水生植物保护问题[45]。然而个体水平的性状与具体的表现之间的关系可能随着环境梯度发生改变,这种关系随着时间、基质或密度的变化会发生轻微变化(弱性状×环境交互作用)甚至逆转(强性状×环境交互作用)[46]。尽管种群动态对生态系统的稳定性有潜在影响,环境因素如何影响个体种群的时间稳定性在很大程度上仍未被探索[47-50]。
沉水植物通常表现出较高的性状可塑性和种内性状变异[40]。细根作为植物吸收营养物质的主要器官,对植物的生长和资源的利用有显著的影响[51]。一般来说,直径小于2 mm的根系被称为细根[52],沉水植物的大部分根系都属于细根。部分沉水植物种类根系不发达(如微齿眼子菜PotamogetonmaackianusA. Benn),甚至完全没有根系(如金鱼藻CeratophyllumdemersumL.),但对另一些沉水植物来说,发达的根系对于其定植和营养吸收都非常重要。对于部分具有根状茎的物种,根状茎是这些物种种群扩散的重要途径(如苦草Vallisnerianatans)。与陆生植物类似,根生水生植物也需要通过根的锚定作用和底泥黏着作用来固定植株,这在种群构建初期至关重要,没有足够的定植能力,植株往往会被大面积连根拔起,最终影响生长、分布、繁殖、甚至存活[53]。沉水植物的根在基质中生长尽管能通过茎叶吸收营养,但根不仅是负责锚定在基质上的被动器官,同时在植物个体生长表现上起着决定性作用[54]。
苦草属于莲座生长型沉水植物,根系发达,通过根状茎和间隔子进行分蘖,行无性繁殖进行种群扩展,是水体沉水植被修复的先锋种类。沉水植物模块化种植具有灵活可移动的优点,有助于沉水植物的生长,有利于退化水体的快速恢复[55]。将苦草苗和草垫作为模块,其能适应复杂的应用场景,最为突出的是能适应不同的基质类型(如底泥、黄泥、沙子或者硬质基底-无基质)和不同的植被覆盖度要求(种植密度)。本研究以矮化苦草为研究对象,通过苦草苗+草垫复合体[56]与不同自然基质结合,研究不同基质和种植密度条件下苦草新生根系功能性状的差异及其随时间的变化。同时,通过线性模型探讨个体水平的生长表现(生物量分配、营养吸收、个体定植)与具体的根系功能性状之间的关系对环境变化的响应,为特定环境下沉水植物根系功能性状指标的选择提供理论依据。
1 材料和方法
1.1 实验场地与材料
实验场地位于湖北省武汉市湖北工业大学环境与水利学院二号楼外光照良好的温室大棚,地理位置为30°29′12″N,114°18′16″E,年平均相对湿度为73%,实验期间平均气温为27.5℃。
研究材料苦草苗采自湖北秀湖植物园有限公司云梦基地,采回后的苦草苗置于无遮荫、自然光照的露天水池里用自来水预培养一周。从预培养后的苦草苗中选取长势良好的株高为10 cm左右的苦草种苗,将其匍匐茎剔除,共准备1000株挑选好的苦草种苗备用。底泥采自武汉市巡司河,沙子使用建筑用沙,黄泥采自鄂州市梁子湖区,使用的塑料盒规格为640 mm×430 mm×260 mm。实验用的草垫为将废纺、椰壳、木屑等材料经过无害化处理,通过特殊工艺合成具有生态功能的基材,厚度为5 cm,采购自上海沐瑛生态科技有限公司。苦草苗+草垫复合体已经获批实用新型专利(专利号ZL202221973626.7)。
1.2 实验设计
实验设计包括4种基质处理,将其进行分组编号,分别为草垫(K)、草垫+沙子(S)、草垫+黄泥(H)和草垫+底泥(D)(K组总氮(TN)=0.001 mg/g、总磷(TP)=0.0006 mg/g,S组TN=0.2 mg/g、TP=0.16 mg/g,H组TN=0.74 mg/g、TP=0.35 mg/g,D组TN=1.85 mg/g、TP=0.47 mg/g)。在水生态修复工程中,苦草的推荐种植密度为50~80株/m2,而模块化种植的目的是快速形成种群或群落,使用更大的种植密度有利于快速形成模块,因此每种基质处理设计两个初始种植密度,低密度为100株/m2(每盒24株),高密度为200株/m2(每盒48株)。本实验共包括8个处理,如图1,具体为K100、K200、S100、S200、H100、H200、D100、D200,每个处理3个重复。在实验开始前,将沙子、黄泥和底泥风干去除大块杂质后平铺在塑料盒底,厚度为5 cm。将挑选好的苦草种苗按照设计的密度形成苦草苗+草垫复合体,种植于不同的基质上,并添加自来水(TN=0.6 mg/L、TP=0.08 mg/L)至26 cm,实验期间上覆水TN=(0.98±0.32) mg/L、TP=(0.57±0.18) mg/L。实验时间为2021年4月1日-8月8日,预培养一周,苦草培养时间为120 d,培养期间分别于5月8日、6月8日、7月6日和实验结束进行4次破坏性取样,对应采样时间分别用第1、2、3、4次来表示。在实验期间定期清理浮渣并进行补水。
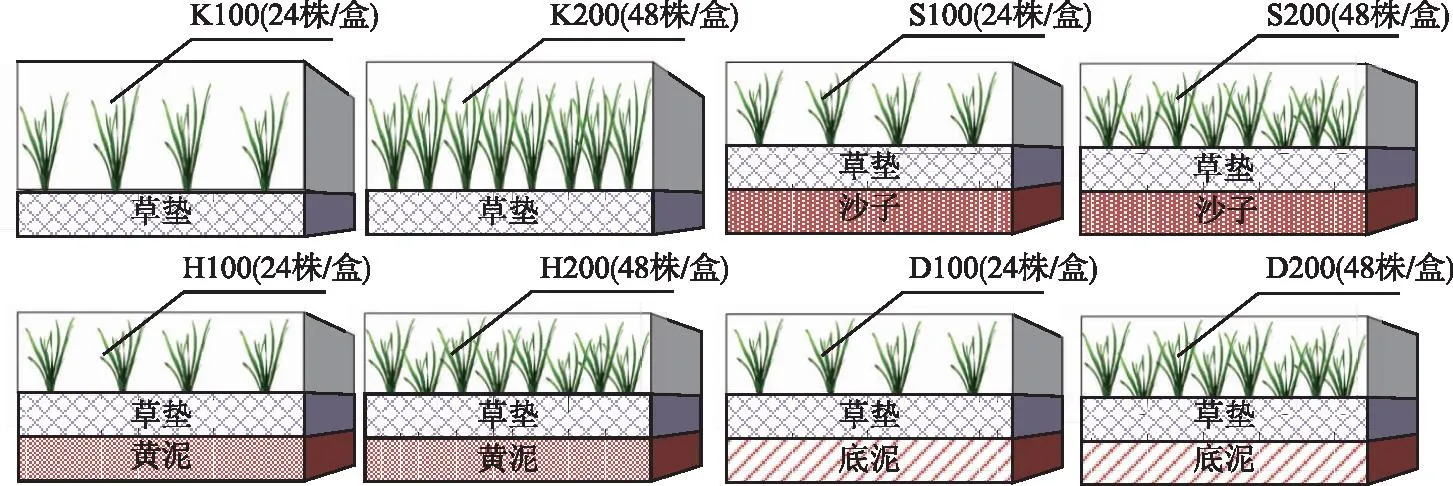
图1 实验分组设计Fig.1 Experimental group design
1.3 苦草功能性状的测定
破坏性取样时,首先从每个塑料盒随机选取一株苦草用弹簧秤测量苦草的根系锚定力,之后再随机选取一株苦草将周围基质扒开后缓缓取出,保证根系完好无损。取样完毕立即进行处理:首先用流水缓缓冲洗掉底泥,去除匍匐茎及分株仅保留原始的植株,之后将其剖分成叶片、短缩茎以及根系3个部分,用吸水纸擦干表面水分后测量单株苦草的叶片数、叶长、叶宽等形态指标。根系清洗干净之后,用PMT-RTP-A3根系平板扫描系统对根系扫描,扫描时将根系放入透明根盘,安放好矫正条,摆放时尽量避免根系互相重叠缠绕。利用RootAnalysis根系研究分析软件测定细根表面积、体积、根长。将分好的3个部分分别放入烘箱中,以105℃烘0.5 h杀青。之后将苦草地上部分(叶片和短缩茎)在65℃下烘干至恒重,将地下部分(根系)在75℃下烘干至恒重,分别测量其干重。
株高为植株基部到叶片顶端的最大高度[57],根系锚定力为将植株根部从基质中拉扯出来所需的最小拉力[58],相关性状的计算方法为:根冠比为苦草根生物量和其他部分(叶片+短缩茎)生物量的比值,比根长SRL(m/g)为根的总长/干重,根组织密度RTD为根的干重/体积,根比表面积SRA为根的表面积/干重。
1.4 统计分析
利用SPSS 26中双因素重复测量方差分析方法对苦草在第2~4次采样的根系功能性状指标及拉力、根冠比等指标进行差异性统计分析,以比较苦草个体在不同基质和密度条件下其生物量分配、根系营养吸收能力和根系固着能力随时间的变化,方差分析结果显著(P<0.05)时,使用最小显著差异法(LSD)进行多重比较。采用Origin 2018作图。为进一步厘清植物个体生长表现与根系功能性状之间的关系及随环境梯度的变化,采用R 4.2.0对个体生长表现(以根冠比、比根长和根系锚定力表征)进行多元线性回归分析,将性状(Trait)、时间(Time)、密度梯度(Density)和基质条件(Substrate,用总磷的含量表征)作为主效应,同时结合性状和时间、密度以及基质的交互作用,整体公式为:Z~α+β1Trait+β2Time+β3Density+β4Substrate+β5Trait:Time+β6Trait:Density+β7Trait:Substrate,该模型包括4个主效应以及3个交互作用,其中Z代表个体表现,β1~β7是线性模型的系数。如果某一个性状×环境的交互作用显著,同时性状-个体生长表现关系的斜率(拟合模型的一阶偏导数,即β值)不随着环境梯度发生符号上的转变,我们则判断该交互作用为“弱”,反之则判断为“强”。
2 结果
2.1 不同采样时间苦草根冠和根组织密度对基质和密度变化的响应
由表1可知,时间、基质以及密度的变化对根冠比均有显著影响(P<0.05),同时,时间和基质对叶宽、根比表面积、根组织密度、根直径、根表面积以及根体积的影响均显著(P<0.05)。利用个体水平性状对苦草的根冠比进行分析时,可以发现叶宽、根比表面积、根组织密度、根直径、根表面积以及根体积分别对根冠比建立线性模型时作为主效应显著(P<0.05),这说明在本实验条件下,苦草的根冠比与叶宽、根比表面积、根组织密度、根直径、根表面积以及根体积存在一定的线性关系。这部分线性模型调整后的R2均在0.348~0.500之间,其中根冠比基于根组织密度的模型调整后的R2最大,为0.500(表2)。在15个根冠比模型中,检测到9个显著的性状×时间交互作用以及8个显著的性状×基质交互作用,但没有发现性状×密度的交互作用(表2)。9个显著的性状×时间交互作用以及8个显著的性状×基质交互作用均为强交互作用。例如,在根冠比基于根组织密度的模型中,性状×时间以及性状×基质的交互作用均显著,同时根冠比与根组织密度关系的斜率(拟合模型的一阶偏导数)在引入时间和基质的变量之后发生了符号上的转变,说明性状与时间和基质之间均存在强交互作用。同时,在所有存在显著交互作用的根冠比模型中,随着时间的推移或基质条件的变化苦草根冠比与测量指标的关系均发生变号(表2)。

表1 基于重复测量的双因素方差分析时间、基质、密度及其交互作用对苦草性状的影响Tab.1 F value and significance of the effects of time, substrate, density and their interactions on trait of V. natans based on two-way ANOVA with repeated measures

表2 利用个体水平性状建立各性状的苦草根冠比(RSR)模型及其标准化系数和模型拟合统计Tab.2 The standardized coefficients and the model fit statistics for each trait-based model of V. natans root-shoot ratio (RSR) using individual-level traits
不同采样时间基质和密度的重复测量方差分析结果表明:随着采样时间改变,根冠比和根组织密度均发生显著变化(P<0.05),基质条件的改变对根冠比以及根组织密度的影响均十分显著。时间和基质对根冠比产生极显著的交互影响,而根组织密度受各种因素交互作用的影响均极显著(P<0.001)(表1)。第2次采样时,根冠比最高点出现在S100组,最低点出现在D100组。第3和4次采样根冠比最低点均出现在D200组,最高点分别出现在H100和S100组。第2次采样时,K组根组织密度显著高于其他组,第3和4次采样苦草根组织密度最高值均出现在S200组(图2)。
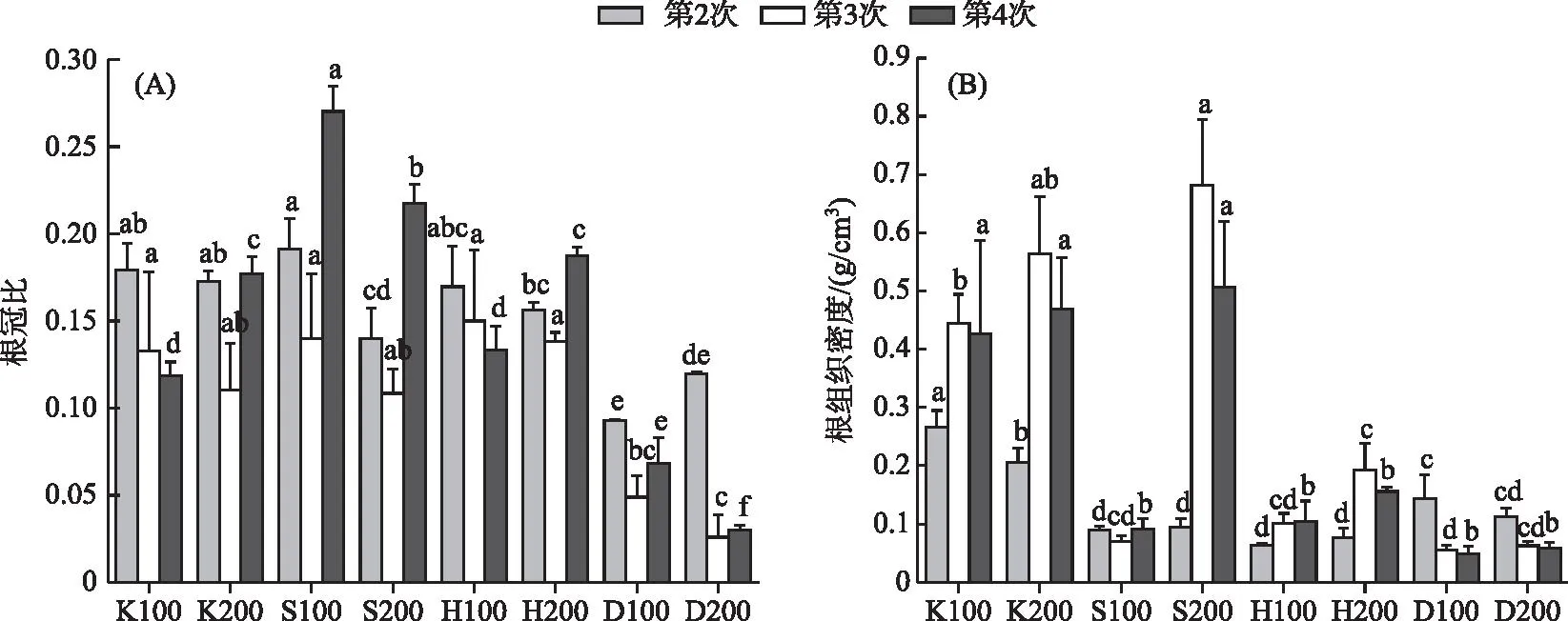
图2 不同基质、密度条件下苦草根冠比(A)和根组织密度(B)随采样时间的变化 (不同字母代表在同一次采样中差异显著,下同)Fig.2 Variation of root/shoot ratio (A) and RTD (B) of V. natans with sampling time under different substrate and density conditions
2.2 不同采样时间苦草比根长、根直径和生根数对基质和密度变化的响应
在对苦草的比根长进行分析时,叶宽、根冠比、根比表面积、生根数、总根长、根表面积和根体积分别对比根长具有独立的主效应,这说明在本实验条件下,苦草的比根长与叶宽、根冠比、根比表面积、生根数、总根长、根表面积和根体积存在一定的线性关系(P<0.05)。这部分线性模型调整后的R2均在0.300~0.646之间,其中比根长基于生根数的模型调整后的R2最大,为0.646(表3)。由表1可知,时间、基质和密度的变化对比根长均有显著影响(P<0.05)。在15个比根长模型中,检测到11个显著的性状×时间交互作用、5个显著的性状×密度交互作用以及6个显著的性状×基质交互作用。11个显著的性状×时间交互作用以及5个显著的性状×密度交互作用均为强交互作用,6个显著的性状×基质交互作用中,3个为强交互作用,3个为弱交互作用。
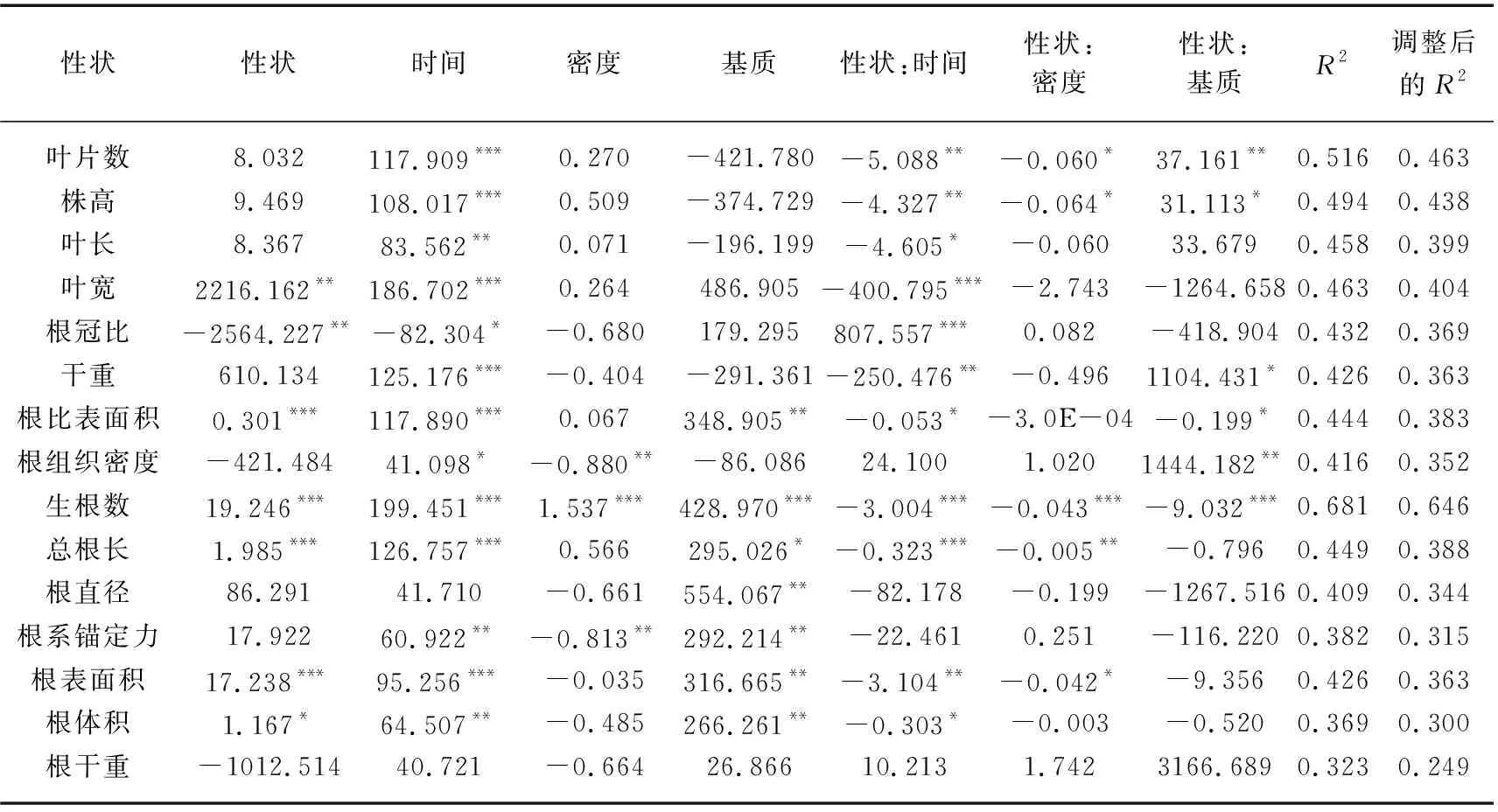
表3 利用个体水平性状建立各性状的苦草比根长(SRL)模型及其标准化系数和模型拟合统计Tab.3 The standardized coefficients and the model fit statistics for each trait-based model of V. natans SRL using individual-level traits
由图3可以看出,第2次采样时D100组比根长显著高于其他组,其余各组之间差异不明显。第3和4次采样时,比根长最高点均出现在S100组。在第2次采样时K组根直径明显低于其他3组(P<0.05),其他3组之间差异不显著(P>0.05),第3和4次采样时D组根直径显著高于其他3组(P<0.05),同时S和H组高密度条件下根直径小于低密度条件,且差异显著(P<0.05)。3次采样生根数的最高值均出现在D组,且第3次采样D组低密度条件下生根数较大(P<0.05)。重复测量方差分析的结果表明比根长、根直径以及生根数随基质的变化均会发生明显变化(P<0.05),但比根长受密度条件变化的影响显著(P<0.05),根直径和生根数受种植密度影响不显著(P>0.05)。时间和基质、密度的交互作用以及时间、基质和密度三者的交互作用对比根长影响显著,所有交互作用对根直径的影响均不显著(表1)。

图3 不同基质、密度条件下苦草比根长(A)、 根直径(B)和生根数(C)随采样时间的变化Fig.3 Variation of SRL (A), root diameter (B) and rooting number (C) of V. natans with sampling time under different substrate and density conditions
2.3 不同采样时间苦草根系锚定力和根比表面积对基质和密度变化的响应
对苦草个体水平根系锚定力进行分析时,叶片数、叶宽、根比表面积、根直径、根表面积和根体积分别对根系锚定力建立线性模型时作为主效应显著,即在本实验条件下,苦草的根系锚定力与叶片数、叶宽、根比表面积、根直径、根表面积和根体积均存在一定的线性关系(P<0.05),上述线性模型调整后的R2均在0.637~0.723之间,其中根系锚定力基于根比表面积的模型调整后的R2最大,为0.723(表4)。由表1可知,时间、基质以及密度的变化对根系锚定力均有显著影响(P<0.05),同时,时间和基质对叶片数、叶宽、根比表面积、根直径、根表面积和根体积的影响均显著(P<0.05)。在15个比根长模型中,检测到12个显著的性状×时间交互作用以及7个显著的性状×基质交互作用,但没有检测到性状×密度的交互作用(表4)。12个显著的性状×时间交互作用以及7个显著的性状×基质交互作用均为强交互作用。在根系锚定力基于根比表面积的模型中,性状和时间以及性状和基质之间均有显著的交互作用(P<0.05),同时根系锚定力与根比表面积的关系斜率在引入时间和基质的变量后均发生了符号上的转变,说明性状与时间和基质之间均为强交互作用。同时,存在显著交互作用的根系锚定力模型中,随着时间的推移或基质条件的变化苦草根系锚定力与测量指标的关系均发生变号(表4)。
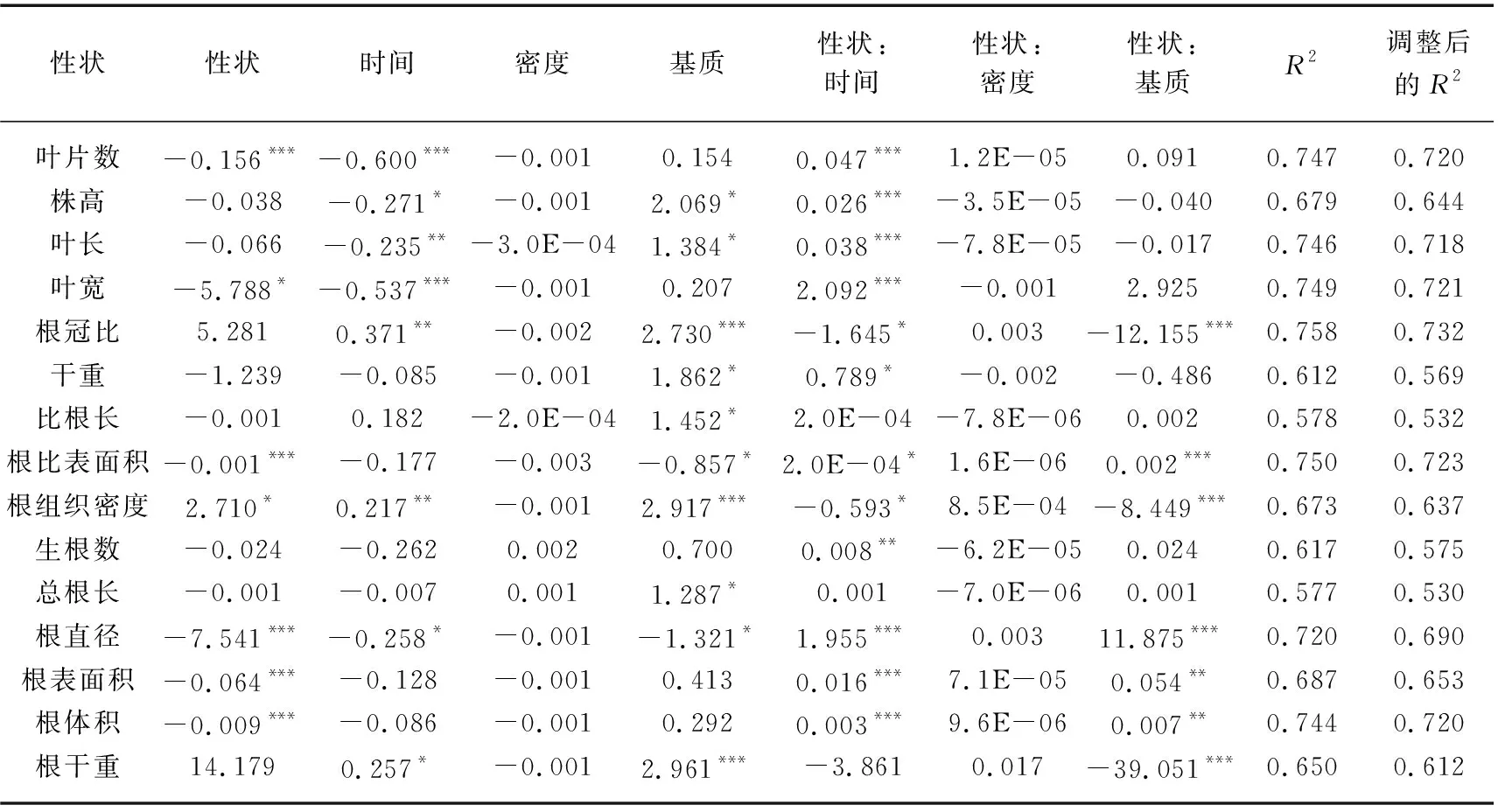
表4 利用个体水平性状建立各性状的苦草根系锚定力及其标准化系数和模型拟合统计Tab.4 The standardized coefficients and the model fit statistics for each trait-based model of V. natans root anchorage force using individual-level traits
在磷水平较高的D100和D200组,3次采样苦草的根系锚定力逐步增大,且第4次采样时D100组根系锚定力大于D200组(P<0.05)。S200和K200组苦草根系锚定力在3次采样时先增大后减小,H200组苦草根系锚定力在3次采样时逐渐减小(图4a)。在相同的采样时间,同一基质条件下低密度组根比表面积始终大于高密度组,且这3次采样根比表面积最高值均出现在D100组(图4b)。重复测量方差分析表明根比表面积受时间、基质和密度及其各种交互作用的影响均显著(P<0.05)。根系锚定力受时间和基质变化的影响均显著(P<0.05),且只受时间和基质交互作用的影响(P<0.05)。
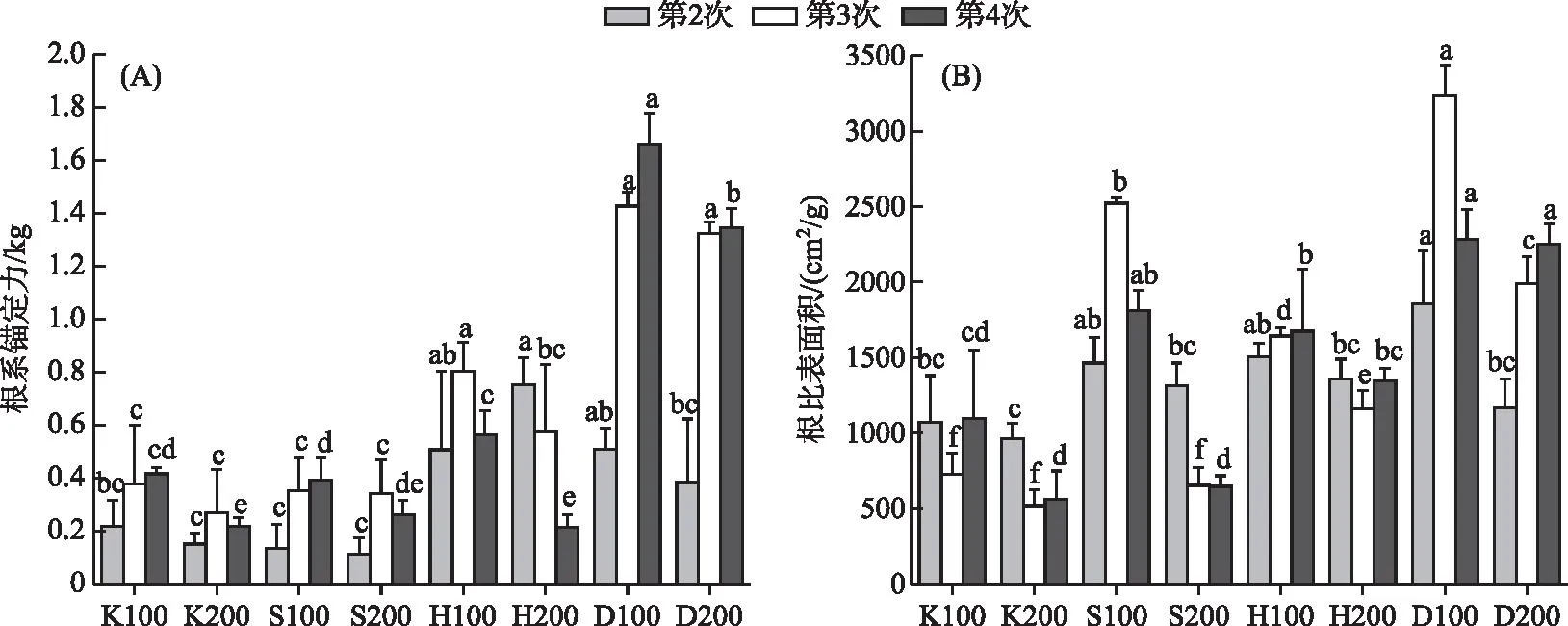
图4 不同基质、密度条件下苦草根系锚定力(A)和根比表面积(B)随采样时间的变化的影响Fig.4 Variation of root anchorage force (A) and SRA (B) of V. natans with sampling time under different substrate and density conditions
3 讨论
3.1 基于个体水平性状建立的苦草根冠比、比根长以及根系锚定力线性模型
表型可塑性是种内性状变异的来源之一,使物种的个体能够在一定程度上调整它们的性状以更好地适应当地环境[59],Valladares等认为[60],为了更准确地预测物种在气候变化下的分布变化,需要考虑表型可塑性、局部适应以及性状和环境之间的交互作用。在之前的研究中,已有研究人员将沉水植物的地理分布与环境数据联系起来构建预测模型[61]。此次研究中用个体水平的性状来预测植物个体生长表现,同时引入3种性状与环境的交互作用探究环境梯度对植物性状与个体生长表现的影响,结果表明,个体水平性状与生长表现的关系沿着环境梯度的变化可能出现3种情况:不会改变(无性状×环境交互作用)、稍有变化(弱性状×环境交互作用)以及出现反转(强性状×环境交互作用)。
在根冠比线性模型中有6个指标对根冠比建立模型时作为主效应显著,其中根冠比基于根组织密度的模型调整后的R2最大,即解释率最高,该模型中性状与时间和基质均为强交互作用,且时间和基质的变化对根组织密度和根冠比均有显著影响(P<0.05)(表1、2),这说明时间和基质的变化最有可能会通过影响根组织密度在一定程度上影响根冠比。在根系锚定力线性模型中同样有6个指标对根系锚定力建立模型时作为主效应显著,其中根系锚定力基于根比表面积的模型解释率最高,该模型中性状与时间和基质均为强交互作用,且时间和基质的变化对根比表面积和根系锚定力均有显著影响(P<0.05)(表1、4),这说明时间和基质的变化最有可能通过影响根比表面积一定程度影响根系锚定力。在苦草比根长线性拟合模型中,有7个指标有显著的主效应,且性状与时间均为强交互作用,性状和基质的交互作用有强有弱,比根长基于生根数的模型解释率最高(表3),说明时间的变化最有可能通过影响生根数在一定程度上影响比根长。
3.2 时间、基质和密度变化对苦草生物量分配的影响
生物量是研究生态系统生产力、物质循环和能量流动的基础[62]。生物量在各器官间的分配反映了不同的生态策略[63],是植物对环境长期适应的结果[64],对个体生长、物种共存、植被恢复具有重要作用。植株为了更好地吸收有限资源会改变地上、地下的生物量分配[65]。这种分配的改变会导致根冠比的变化。当养分有限时,植物通常会调整生物量分配以最大限度地减少资源不平衡,沉积物中可利用的养分不足时可能需要植物增加分配给根部的生物量以有效获取养分[66-67]。本研究中,在磷水平充足的D组根冠比显著低于其他组(图2),说明在低磷胁迫时,苦草会分配更多的生物量给地下部分。
线性拟合模型的结果表明,叶宽、根比表面积、根组织密度、根直径、根表面积以及根体积分别对根冠比建立线性模型时作为主效应显著,且根冠比基于根组织密度的模型调整后的R2最大(表2),这说明上述指标在个体水平上能一定程度预测根冠比对环境变化的响应,且根组织密度的预测效果最好。但是无法从柱状图上简单将根组织密度和根冠比联系起来,这是因为性状和个体生长表现的关系会受到各种环境因素的影响。在不考虑时间变量的前提下,苦草根组织密度与根冠比呈负相关(线性模型对于性状的一阶偏导数为负值),这符合Roumet等提出的根经济谱理论:即资源有限的环境下,植物可能倾向于分配更多的生物量到根部(较高的根冠比),并表现出较低的根组织密度,以提高对养分和水分的获取能力[68]。然而在引入时间或者基质变量之后,苦草根组织密度与根冠比有朝着正相关变化的趋势(线性模型对于性状和时间以及基质交互作用的一阶偏导数均变为正值)(表2)。这可能是因为在种群建立的初期或者磷水平不足时,苦草对根系的投资可能更倾向于发育细长的新根,这意味着在这个时期根冠比会增大而根组织密度会减小,随着种群建立的逐步完成或者磷水平的提升,苦草对根系的投资慢慢倾向于更致密的结构,从而出现向正相关变化的趋势。这与Lynch的研究结果相似:在磷水平提高的情况下,植物可能会倾向于发展更致密的根系结构,以更有效地吸收和利用养分[69]。本研究表明种群构建所处阶段以及基质营养水平影响了根组织密度与根冠比的关系,因此,根组织密度对于根冠比的预测受到种群构建所处阶段和基质营养水平的影响。本研究结果与前人关于苦草对不同营养水平、基质类型的响应的研究结论相符[70]。
3.3 时间、基质和密度变化对苦草吸收和运输营养的影响
表型可塑性是植物获取资源的重要适应机制[71]。苦草根系功能性状的变化有利于其从低养分或贫瘠沉积物中获取养分[72]。具有长而细的根的植物比具有短而粗的根的植物能更有效地获取养分[73-74]。根直径和比根长受基质变化的影响显著说明基质条件会对苦草根系的吸收和运输能力造成影响。本研究中,第3次和第4次采样时营养条件充足的D组根直径大于其他各组(P<0.05)(图3a),说明磷水平充足的时候苦草的根直径会更大,能一定程度促进根系对营养物质的吸收和运输能力,与此同时,比根长在S、H以及K组均有随采样时间上升的趋势(图3b),这说明在磷水平不足时苦草会长更细更长的新根去吸收营养物质。同时比根长受密度的影响显著,且表现为随密度的增加而下降,这说明过高的种植密度会影响苦草根系的吸收和运输能力。
根系对营养的吸收和运输能力能通过比根长和根直径体现,由于根直径不受各种交互作用的影响(P<0.05)(表1)且比根长的复合程度较高,因此本研究选用比根长作为因变量进行线性拟合。结果表明,叶宽、根冠比、根比表面积、生根数、总根长、根表面积以及根体积分别对比根长建立线性模型时作为主效应显著,且比根长基于生根数的模型调整后的R2最大(表2),这说明上述指标在个体水平上能一定程度预测比根长对环境变化的响应,且生根数的预测效果最好。此外,Ostonen等的研究表明比根长可以评估植物对资源限制的响应[75]。比根长受营养条件的影响[76],较高的比根长有利于从营养条件不足的沉积物中获取养分[77]。同时Hussner等的研究表明植物的生根数同样受到养分含量的影响[78]。由表3可知,在不考虑时间变量的条件下,苦草生根数与比根长呈正相关(线性模型对于性状的一阶偏导数为正值),Poorter等的研究指出在一些情况下,生根数的增加与比根长的提高有正相关性,这有助于植物在不同环境条件下的生长[79]。在引入时间的交互作用之后这种正相关有减弱甚至逆转的趋势(线性模型对于性状和时间交互作用的一阶偏导数均变为负值)。这可能是由于在种群构建的初期,苦草个体为提升根系的吸收和运输能力会投资更多的资源在比根长上,这种投资体现为长更多的细根。同时在比根长基于生根数的模型中,基质和密度与性状之间均存在强交互作用(表3),表明基质营养以及种植密度的变化都会影响生根数与比根长的关系,因此,生根数对于比根长的预测受到基质营养水平、时间变化以及种植密度的影响。
苦草的比根长受到环境变化以及各种交互作用的综合影响,种植密度在其中起到了关键作用,种植密度过大会影响根系的伸展[80],从而影响根系对营养物质的吸收,在种植沉水植物时,为了保证根系的吸收能力,种植密度是必须考虑的关键因素。
3.4 时间、基质和密度变化对苦草根系固着能力的影响
不同的根系形态特征除了会影响植物对养分的吸收能力外,对其固着能力也会产生重要影响[81]。在第2次采样时,营养条件较为充足的D和H组显著高于其他两组,甚至在H组的根系锚定力大于磷水平更高的D组,这可能是黄泥的黏性更强导致的。但是第3和4次采样时D组的根系锚定力最大,H组次之,S和K组差别不大(图4a),这说明单株苦草的定植能力主要受到基质磷水平的影响。同时高密度条件下根系锚定力小于低密度条件(P<0.05),这说明过高的种植密度不利于单株苦草的定植。
叶片数、叶宽、根比表面积、根直径、根表面积以及根体积分别对根系锚定力建立线性模型时作为主效应显著,且根系锚定力基于根比表面积的模型调整后的R2最大(表4),这说明上述指标在个体水平上能在一定程度上预测根系锚定力对环境变化的响应,且根比表面积的预测效果最好。在不考虑时间或者基质变量的前提下,苦草根比表面积与根系锚定力呈负相关(线性模型对于性状的一阶偏导数为负值),且在引入时间或者基质变量之后苦草根比表面积与根系锚定力有朝着正相关变化的趋势(线性模型对于性状和时间以及基质交互作用的一阶偏导数均变为正值)。这可能是由于随着苦草种群的重建或者基质磷水平的增加,苦草个体会更倾向于增加根比表面积从而增强固着能力。Danjon等的研究同样表明根比表面积较大的植物根系对土壤的固定能力较强[82]。同时,表4中所有显著的性状×时间交互作用和性状×基质交互作用均为强交互作用,这说明在种群构建的不同时期以及营养条件不同的情况下,苦草自身性状之间的相互关系可能完全不同,这进一步说明通过根比表面积预测植物个体根系锚定力对变化环境的响应时,不仅要清楚环境变化,同时需要了解种群构建所处的阶段。苦草的固着能力主要受基质条件的影响。除了基质中营养物质的含量,基质的粒径、黏度等物理特性同样会影响苦草的固着能力。在种群构建的不同时期,苦草各项指标之间的关系可能完全不同,在预测植物对不断变化的环境条件的响应时,除了需要考虑基质的种类和种植密度,种群所处的阶段也是必须考虑的因素之一。
4 结论
1) 基质和密度发生改变时,根系功能性状能一定程度预测个体生长表现,如根组织密度可用于预测苦草的生物量分配,生根数可用于预测根系营养吸收和运输,根比表面积可用于预测根系固着能力。
2) 根冠比、比根长、根系锚定力这3个根系功能性状指标响应环境变化不具有时间稳定性(有显著主效应的指标性状与时间均为强交互作用),即基质和密度在不同时期对苦草根系功能性状的影响方向会发生改变。
3) 当使用根系功能性状预测植物个体表现时,需要考虑种群重建所处的时期。

