宫内心脏介入治疗胎儿危重型先天性心脏病5 例报告
蔡蕾裔 赵莉晴 王 磊 焦先婷 张拥军 武育蓉 朱 泓 夏红萍 孙 锟 陈 笋
上海交通大学医学院附属新华医院 1.儿心脏中心,2.宫内儿科疾病诊治中心,3.新生儿科(上海 200092)
先天性心脏病(简称先心病)是我国儿童出生缺陷的首位疾病,也是婴幼儿死亡、儿童致残的首要病因[1]。随着产前诊断技术的发展,胎儿时期先心病的检出率明显提高,国内一项多中心研究显示胎儿严重先心病检出率可达90%[2]。虽然绝大部分先心病能在出生后得到有效治疗,但部分复杂型先心病会在胚胎发育早期形成基础病变,随着妊娠过程病变程度逐步加重,并不可逆地严重影响左、右心室功能。
胎儿宫内心脏介入(fetal cardiac intervention,FCI)是指选择在胚胎心脏及血管尚未出现不可逆病变的妊娠中期,对先心病胎儿进行治疗,以避免胎儿宫内死亡,为生后建立双心室循环建立条件,改善患胎的预后[3-4]。这些先心病包括重度主动脉瓣狭窄(critical aortic stenosis,CAS)、室间隔完整型肺动脉闭锁(pulmonary atresia with intact ventricular septum,PA/IVS)、左心发育不良综合征合并限制性卵圆孔等[5]。由于FCI 手术难度极高、病例选择困难及伦理问题,目前国际上多为单中心的病例报告。由于技术的难度与先进性,国内起步较晚,仍缺乏相关的经验与中长期预后的报道。本研究回顾本中心近年来胎儿心脏介入病例,旨在判断该技术在国内中心施行的安全性和有效性。
1 对象与方法
1.1 研究对象
纳入2018年8月至2022年5月在上海交通大学医学院附属新华医院宫内诊治中心行FCI的所有胎儿。目前国际上尚无公认的入选标准,基本原则大致包括以下两点:①后续可能进一步进展的病例;②干预后有希望实现双心室循环的病例。纳入标准:①明确诊断为胎儿CAS。左心室长径Z值>-2;左心室短径Z值>0;主动脉瓣环Z值>-3.5;二尖瓣瓣环Z值>-2,根据超声估测的主动脉跨瓣压差≥20 mmHg[6-7]。②明确诊断为PA/IVS。胎儿肺动脉瓣极重度狭窄或膜性闭锁,动脉导管逆向灌注肺动脉;三尖瓣瓣环Z值为-4~-2,三尖瓣/二尖瓣瓣环比值<0.6;四腔切面测得右心室/左心室长径比值<0.6;舒张期三尖瓣前向血流时间/心动周期时间比值<31.5%;连续观察右心室发育停滞超过3周[8-9]。排除标准包括:①胎儿合并其他心脏畸形或心外畸形;②合并染色体基因异常;③双胎或多胎妊娠;④不符合任一入选标准相关指标。
所有孕妇在术前均被告知手术相关情况及可能存在的风险,并签署知情同意书。本研究获得上海交通大学医学院附属新华医院伦理委员会批准通过(No.XHEC-C-2017-028-3)。
1.2 方法
1.2.1 胎儿超声心动图检查 所有病例通过胎儿超声心动图检查明确诊断。胎儿超声心动图检查采用GE VOLUSON E 10 彩色多普勒超声仪(GE Healthcare Ultrasound,Zipf,AUSTRIA),超声探头C 1-5。所有孕妇在FCI 术前、后均接受≥1 次详细胎儿超声心动图检查。胎儿超声心动图检查由经验丰富的主任医师完成,检查内容及诊断标准符合胎儿超声心动图国际指南[10-11]。
1.2.2 FCI手术过程 孕妇采取平卧位,术前超声评估胎儿方位,需待脊柱位于后方,超声评估预计穿刺针易于平行左心室或右心室流出道方向时,在超声引导下穿刺脐血管,回抽见血后注入芬太尼、阿托品及肌松剂,撤针,超声确定胎儿胎动明显减少。确定经皮胎儿心室穿刺点后,超声持续监测引导下予以带鞘穿刺针进入胎儿左、右心室(对于肺动脉闭锁,穿刺针需直接穿过肺动脉瓣,进入肺动脉),拔出枕芯后见搏动性血流,立即置入预置导丝冠脉扩张球囊,超声引导下将导丝送入升主动脉/肺动脉,微调球囊置于主动脉瓣/肺动脉瓣处,8磅压力进行2~4次球囊扩张,监测胎心率,扩张完成后撤出穿刺针及扩张球囊系统。图1、2 分别为胎儿主动脉瓣球囊扩张术及肺动脉瓣球囊扩张术中超声监测图像。手术过程中需超声监测胎儿心率,若胎心率减慢超过3 分钟以上,可应用22 G 穿刺针经过脐带或肌肉注射阿托品或肾上腺素。如发现有中-大量心包积液,可采用22G穿刺针进行心包穿刺,抽出心包积液。FCI 手术成功评判标准:导丝顺利通过主动脉瓣或肺动脉瓣并完成球囊扩张,术后超声显示通过瓣膜的血流增加,不合并严重的胎儿及孕妇并发症。

图1 胎儿主动脉瓣球囊扩张术
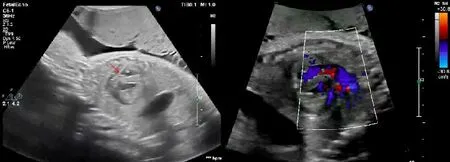
图2 胎儿肺动脉瓣球囊扩张术
1.3 统计学分析
采用SPSS 22.0 统计软件进行数据分析。正态分布的计量资料以均数±标准差表示,非正态分布的计量资料以中位数(范围)表示,计数资料以例(%)表示。
2 结果
2.1 基本信息
共7 例胎儿入选,包括5 例PA/IVS,2 例CAS;其中2 例PA/IVS 因胎儿胎位不适合未执行手术,手术执行率71.4%(5/7)。5 例完成FCI 手术的孕妇平均年龄(33.0±2.6)岁,初次诊断孕周24+5(22+5~28+4)周,2 例为试管婴儿,3 例为自然受孕(表1)。
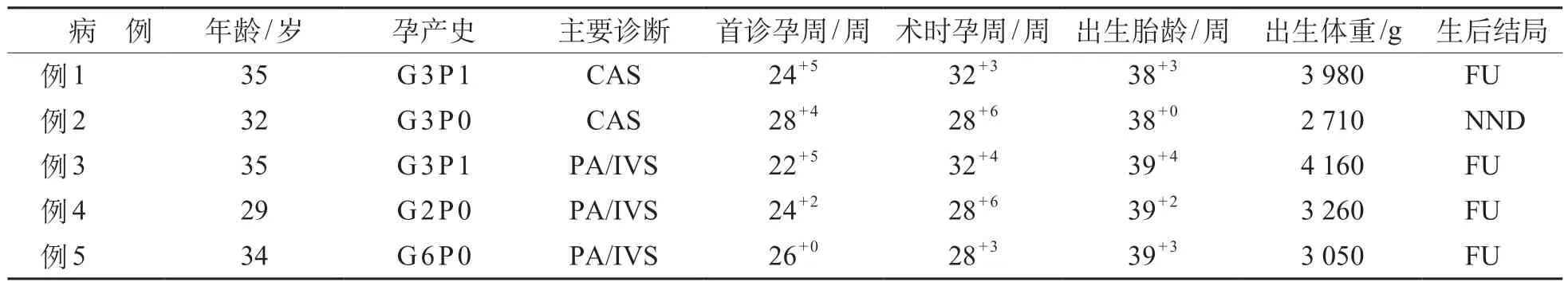
表1 FCI胎儿孕妇基本信息及生后情况
2.2 围手术期情况
5例孕妇均成功完成了FCI,治疗中位孕周29+2(28+6~32+4)周。所有胎儿在介入后跨瓣血流得到了增加,技术成功率100%(5/5)。术后即刻患胎均观察到暂时性的心包积液,3 例为少量,2 例为中等量并进行了心包穿刺抽取。术后胎儿超声心动图随访中心包积液均好转,4 例无明显心包积液,1 例少量心包积液。
2.3 手术前后胎儿超声心动图指标改变
共2 例CAS 患胎完成胎儿主动脉瓣球囊扩张术。例1 术前主动脉瓣过瓣流速4.7 m/s,压差88 mmHg,合并心包积液,二尖瓣轻度反流。术后复查主动脉瓣过瓣流速降至3.6 m/s,压差53 mmHg,二尖瓣反流改善。例2 胎儿就诊时已出现左心室壁收缩活动减弱,心内膜回声增强,心房左向右分流,主动脉瓣过瓣血流束宽1.2 mm,二尖瓣中度反流。术后主动脉瓣过瓣血流增宽至2.5mm,心房水平双向分流,二尖瓣轻度反流。
3 例PA/IVS 胎儿均成功进行肺动脉瓣穿刺,获得前向血流。3 例胎儿术前三尖瓣瓣环平均Z值-0.93,术后平均Z值-0.65;肺动脉瓣瓣环平均Z值-1.67,术后平均Z值-0.82。术前右心室与左心室长径平均比值0.70,术后平均比值0.88;术前横径平均比值为0.75,术后平均比值0.75。PA/IVS胎儿FCI术后胎儿超声心动图提示右心室发育指标均获得一定程度的改善。
2.4 随访情况
5 例胎儿均足月出生,中位出生胎龄3 9+2(38~39+4)周,平均出生体重(3 610±270)g。所有胎儿生后均进行了手术或介入治疗,其中2 例CAS行外科主动脉瓣成形术,3例PA/IVS 患儿行经皮导管肺动脉瓣球囊扩张介入术。其中1 例CAS(例2)在9 日龄行主动脉瓣成形术,在15 日龄因心功能不全和肾功能不全家属考虑放弃治疗自动出院。其余4例均在随访中,预后良好。
3 讨论
FCI最早于1991年由Maxwell等人首次报道[12],通过胎儿主动脉瓣球囊成形术治疗主动脉瓣狭窄。经过30 余年的发展,FCI 技术在发达国家逐渐发展成熟,而在国内起步较晚。本研究回顾性分析本中心进行的所有FCI病例,并随访至出生后早期。研究通过手术成功率,孕妇及胎儿的围产期并发症,证明了该技术在国内宫内诊治中心独立施行的安全性及有效性。
对于胎儿主动脉瓣狭窄,波士顿儿童医院患儿的入选标准主要为主动脉瓣狭窄合并左心发育不良[7]。本中心完成的2 例胎儿主动脉瓣球囊成形术的手术指征并不是左心发育不良,而是胎儿严重的心力衰竭,尽管目前尚无针对主动脉瓣狭窄合并心力衰竭进行FCI的标准,有研究发现FCI可及时缓解主动脉瓣狭窄胎儿的水肿情况[13],表明可以进一步扩大FCI的适应证。此外,本中心新生儿期死亡的病例在胎儿期表现为左心室收缩活动减少,心内膜回声增强,这些超声指标有研究提示是患儿预后不良的预测因素[14]。另1 例CAS 患儿则预后良好,生后顺利完成了主动脉瓣成形术,手术效果良好,仍在随访中。
相关文献认为重度肺动脉瓣狭窄胎儿出生后几乎都能进行双心室治疗[9],因此无需进行宫内干预,这和我们的经验一致。对于PA/IVS的胎儿进行宫内干预的指征仍没有公认的标准。波士顿儿童医院的入选标准[8,15]包括右心室小但结构完整、三尖瓣瓣环Z值<-2,但是对于三尖瓣瓣环Z值<-3的患儿双心室修补率很低。根据以上原则选择病例有一定可行性。本研究PA/IVS病例选择并不局限于三尖瓣瓣环Z值大小,而注重肺动脉闭锁及右心室发育停滞等情况,根据本中心的经验,尽早开放闭锁的肺动脉有利于PA/IVS患儿长期的右心室发育[16],因此对于PA/IVS病例的FCI指征仍需进一步研究明确。
波士顿儿童医院报道的单中心胎儿主动脉瓣球囊成形术成功率由2004年的70%上升至94%,胎儿流产比例从9.8%下降至6%,并且59%的活产婴儿可以完成双心室修补[6]。在2020 年一项PA/IVS 宫内治疗的研究中,58例胎儿中41例(70.7%)获得技术成功[7]。本研究中除了2 例胎儿因始终无法获得合适的胎位未进行FCI手术,5例FCI手术胎儿均获得手术成功(100%),未合并严重的胎儿及孕妇的严重并发症,无1 例胎儿早产。FCI技术的目标是提高宫内及新生儿期生存率,改善疾病的预后,提高生后双心室循环率[17],本研究FCI手术后超声心动图指标及心室发育指标均获得一定程度的改善,证明了FCI技术的安全性及有效性。
综上,通过回顾性分析本中心近年来进行FCI的5例病例的临床资料,发现FCI是一项安全、有效的技术。目前病例数仍有限,需更多的病例及长期随访进一步验证FCI技术对于危重型先心病的长期预后影响。

