来源于人工合成小麦群体的种子活力分析
李 阳,郭晓江,唐华苹,雷越堃,张连全1,,刘登才1,,王际睿1,,魏育明1,,郑有良1,,蒲至恩*
(1.西南作物基因资源发掘与利用国家重点实验室,成都 611130;2.四川农业大学农学院,成都 611130;3.四川农业大学小麦研究所,成都 611130;4.成都市鹃农智慧农业科技发展有限公司,成都 611730)
种子是农业生产中最基本的生产资料,种子活力是评价种子品质的一项重要指标。高活力种子可以提高作物的出苗率、出苗速度和幼苗健壮度,影响田间成苗率、生长状况和最终产量,增强种子的耐储性、不良播种条件的耐性和病虫草害的抵抗能力,为作物的稳产高产打下良好的基础[1]。种子活力是多基因控制的数量性状[2-4],同时受种子结构、收获期、贮藏期及环境[5-7]等因素的影响。随着种子的逐渐成熟,种子活力逐渐升高,真正成熟时达到顶峰,随之进入逐渐衰老的不可逆过程,这一过程产生的综合效应被称为老化(aging)[8]。在老化的过程中,种子活力逐渐下降,从而影响田间幼苗形态建成,最终影响产量。
前人针对作物种子活力和种子贮藏过程中的种子生理进行了大量研究,发现种子在储藏过程中内部会发生一系列的复杂的生理变化[9-11],包括蛋白质合成系统受到损害,蛋白质分子产生降解等。研究种子活力与蛋白质的关系对于利用蛋白质标记检测种子活力、监测种子发育具有重要意义[12]。孔治有等[13]研究了人工加速老化对小麦种子可溶性蛋白含量存在影响;胥鹏宇等[14]揭示了不同老化条件下水稻种子的部分胚蛋白的表达与种子的快速老化相关;孔令琪[15]研究表明不同含水量的燕麦种子老化后蛋白含量下调;刘美惠[16]采用蛋白质组学和分子生物学方法探究古代莲子老化的分子机理,但对于种子活力下降过程中具体蛋白质变化还有待深入,同时对种子活力的遗传研究还需要进一步深入研究。
种子活力具有明显的基因型差异[17],我们前期研究发现人工合成小麦的种子活力表现优异。人工合成小麦是小麦遗传改良和增加环境适应性的有效基因资源[18],研究表明,人工合成小麦在产量相关的重要性状上具有更丰富的多样性、具有耐生物/非生物胁迫等特性[19-22]。为了将来自四倍体小麦(T.turgidum)与节节麦(Ae.tauschii)的有利基因能够在六倍体遗传背景下正常表达,一些来源于节节麦的D 族优异基因通过人工合成小麦被导入到普通小麦,增加普通小麦的环境适应性。但有关人工合成小麦种子活力这一与小麦产量息息相关的性状的遗传研究相对较少。
我国稻麦轮作面积常年在467 万hm2以上,主要分布于长江流域,包括四川、江苏和安徽等省,水稻收获后耕层土壤紧实,透气性差,出苗环境较差,而高活力种子具有出苗整齐度高、幼苗生长潜势好、植株抗逆能力强的特点,有利于幼苗形态建成,是保证小麦高产的第一步。结合我们前期对人工合成小麦活力的研究结果,为了进一步明晰种子活力较高的机理,以人工合成小麦为亲本构建重组自交系(RIL)群体进行种子活力相关性状定位。
本试验对人工合成小麦RIL群体收获后新收获种子、人工加速老化、自然老化1年和5年的种子发芽率、发芽势进行测定,利用Wheat 660K SNP 芯片标记构建的遗传连锁图谱,分析影响种子活力的QTL 位点和候选基因,同时对RIL 群体小麦老化种子的活力变化与贮藏蛋白醇溶蛋白和麦谷蛋白亚基组成及其含量变化关系进行验证,探究老化后高低活力品系间贮藏蛋白变化的差异。
1 材料和方法
1.1 试验材料
试验以132 份“SHW-L1×川麦32”RIL 群体(F9)为材料,其中SHW-L1(AABBDD,2n=42是利用节节麦AS60 (Ae.tauschiissp.tauschii,DD,2n=14)与圆锥小麦AS2255 (T.turgidumssp.turgidum,AABB,2n=28)杂交后,F1(ABD)经秋水仙碱染色体加倍处理所得[23],将RIL群体(F9)于2017年、2021年和2022年种植于四川农业大学崇州现代农业研发基地,材料收获晾干后保存于干燥低温密闭的种子桶内。
1.2 试验方法
1.2.1 人工加速老化试验
参照国际种子检验规程高温高湿(40 ℃,99%RH)法[24]进行老化试验,老化结束后,取出种子在室温下风干至原始水分状态。
1.2.2 发芽试验
对新收获种子和3 种不同老化处理(自然老化1年、5年和人工加速老化)的种子按照国际种子检验规程进行发芽试验[24],发芽试验结束后,第4天统计发芽势(GP),第7天统计发芽率(GR),分别计算种子的发芽率、发芽势。
发芽势/%=4天内发芽种子粒数/50×100
发芽率/%=7天内发芽种子粒数/50×100
1.2.3 遗传图谱
利用已构建好的RIL 群体的遗传图谱,共计7 218个Wheat660K标记,图谱平均密度为0.148 cM[23],进行QTL位点分析。
1.2.4 谷、醇溶蛋白提取
选取老化前后发芽率变化差异显著的极端材料进行谷蛋白、醇溶蛋白分析。参照张玲丽等[25]的方法对高分子量麦谷蛋白提取,利用聚丙烯酰胺凝胶电泳(SDS-PAGE)方法测定。参考B.A.Marchylo[26]和Yan Y.[27]描述的方法提取醇溶蛋白,使用RP-HPLC 试验方法对其进行分析。
1.2.5 数据统计和QTL定位
数据统计分析使用Microsoft Excel 2019和SPSS软件。利用软件QTL IciMapping 4.2(Chinese Academy of Agricultural Sciences,Beijing,China)采用完备区间作图法(Inclusive Composite Interval Mapping,ICIM) 对发芽率进行QTL 检测,测得小麦RIL 发芽率的加性QTL 和上位性QTL。LOD 值为1 000 次排列测验的临界值,用LOD>2.50作为QTL阈值。
1.2.6 候选基因筛选
将检测到的主效QTL 置信区间对应的中国春基因组(Chinese Spring IWGSC v1.0)区间已知基因调出,进行候选基因的筛选。
2 结果与分析
2.1 群体发芽势和发芽率
对新收获、人工加速老化、自然老化1年和5年的种子发芽率进行表型分析(表1),除自然老化1年的材料外,RIL群体亲本SHW-L1的发芽势和发芽率均显著高于川麦32。人工老化后和储存5年群体的变异系数高于当年收获和储藏1年的种子;人工老化后种子发芽率与储存5年种子的发芽率相当。不同自交系人工加速老化后的种子间表现出巨大的差异,发芽率极差达到84%(图1),部分自交系种子全部失去活力(如RIL42),部分自交系仍有旺盛的生命力(如RIL102),可以在群体中选择到高活力植株。

图1 材料RIL42、RIL102老化后发芽表现Figure 1 The Germination performance of RIL42 and RIL102 after artificial aging
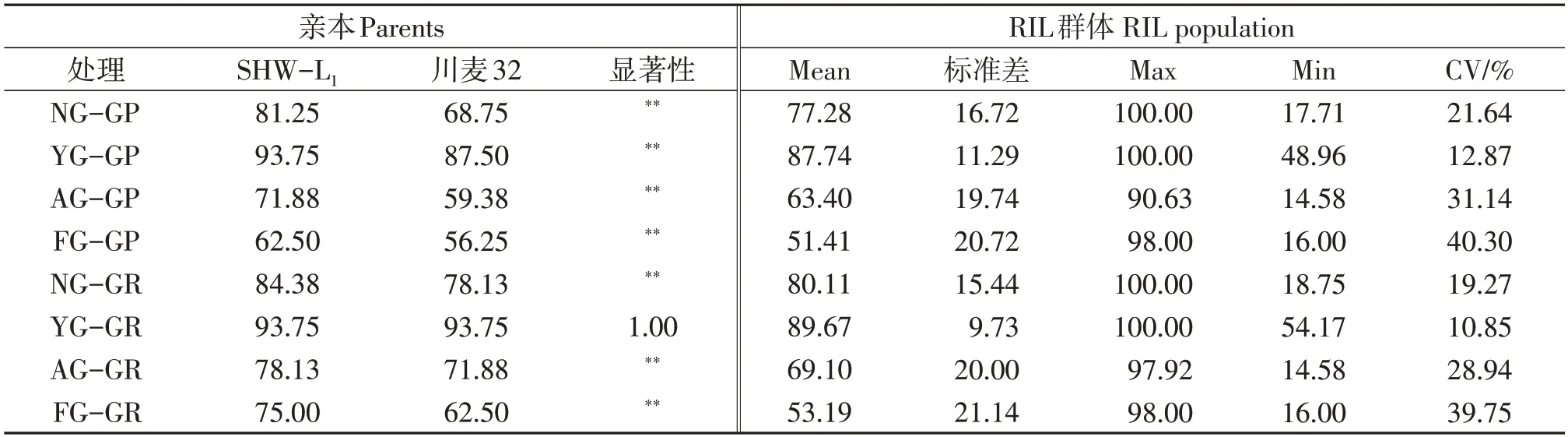
表1 小麦亲本及 RIL群体的发芽势、发芽率表型分析Table 1 Phenotypic analysis for artificial aging and germination rate of the parents and RIL population
新收获、人工加速老化、自然老化1年和5年的种子进行发芽势和发芽率的统计分析(图2)。结果表明,自然老化1年的种子与新收获种子的发芽势和发芽率偏度统计均小于-1(表2),呈偏态分布,93%的材料发芽率达到90%以上。人工老化与自然老化5年的种子发芽势和发芽率显著降低,偏度统计趋近于0,接近正态分布。说明尽管收获时的发芽品质一致,但种子发芽率随着贮藏时间和环境的变化而变化,由于基因型的差异,导致后续不同自交系种子活力表现差异。
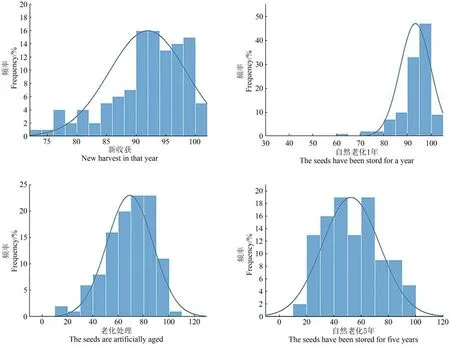
图2 保存1年、5年、新收获和人工老化种子发芽势和发芽率的平均值表现Figure 2 The average performance of the germination potential and germination rate of newly harvested and artificially aged seeds stored for 1 year and 5 years
对不同老化程度种子的发芽率和发芽势进行方差分析(表3),种子的发芽势和发芽率差异都达到极显著水平。无论是发芽势和发芽率群体基因型间均在0.01%水平表现显著差异,证实了种子自然衰老和加速老化的速率与基因型是密切相关的。
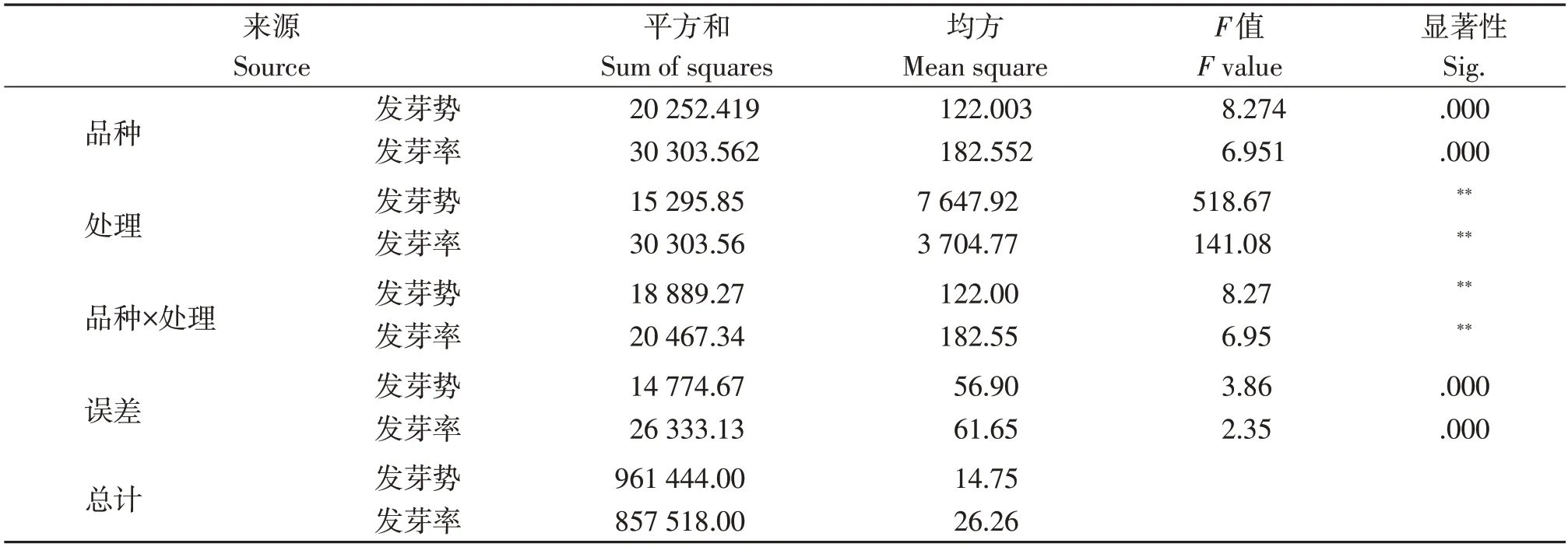
表3 发芽势和发芽率的方差分析结果Table3 Variance analysis of seed artificial aging and germination rate
2.2 连锁图谱及QTL定位结果
根据构建的图谱,利用完备区间作图法对当年新收获的种子与3 种不同老化处理的种子发芽势、发芽率进行QTL分析,在新收获的种子发芽试验上未检测到QTL,老化处理下共检测到4 个发芽势QTL,分布在3B 和7D 染色体上,6 个发芽率QTL 分布在1B、2D、3A、3B 和7D 染色体上,单一 QTL 可解释表型变异的2.07%~7.84% (表4)。
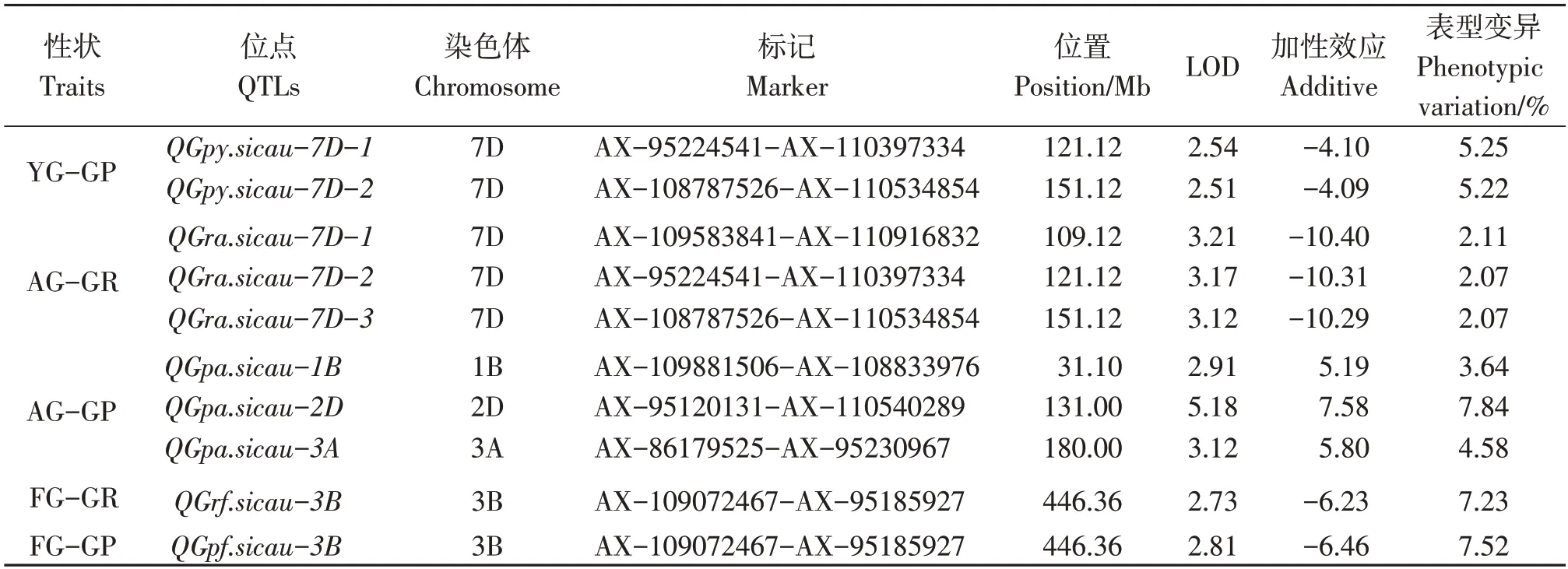
表4 重组自交系种子发芽势、发芽率的QTL分析Table 4 Summary of QTLs for artificial aging and germination rate
2.2.1 自然老化1年种子QTL定位
在7D 染色体上定位到2 个影响自然老化1年种子发芽的QTL。QGpy.sicau-7D-1、QGpy.sicau-7D-2分别位于标记 AX-95224541-AX-110397334、AX-108787526-AX-110534854 区间。表型贡献率最高的为7D 染色体上QGpy.sicau-7D-1座位,可解释表型变异5.25%,具有提高发芽率的效应,增效等位基因来自SHW-L1(表4)。
2.2.2 自然老化5年种子QTL定位
在3B染色体上定位到1个影响自然老化5年种子发芽的QTL,QGrf.sicau-3B、QGpf.sicau-3B为同一座位,位于标记AX-109072467-AX-95185927 区间。表型贡献率为7.23%~7.53%,具有提高发芽率的效应,增效等位基因来自SHW-L1(表4)。不同自然老化处理的材料未定位到一致的QTL,说明在种子贮藏过程中QTL是动态变化的。
2.2.3 人工加速老化种子QTL定位
在1B、2D、3A和7D染色体上定位到6个影响加速老化种子发芽势的QTL。QGra.sicau-7D-1、QGra.sicau-7D-2、QGra.sicau-7D-3、QGra.sicau-1B、QGra.sicau-2D、QGra.sicau-3A,分别位于标记AX-109583841-AX-110916832、 AX-95224541-AX-110397334、AX-108787526-AX-110534854、AX-109881506-AX-108833976、 AX-95120131-AX-110540289、AX-86179525-AX-95230967区间,表型贡献率最高的为2D 染色体上的QGPa.sicau-2D座位,可解释表型变异7.84%,具有降低发芽率的效应,增效等位基因来自川麦32(表4)。
人工老化与自然老化1年条件定位到一致的QTL 位点,位于7D(QGpy.sicau-7D-1和QGra.sicau-7D-1、QGpy.sicau-7D-2和QGra.sicau-7D-3)染色体,为人工老化与自然老化共同QTL。
2.2.4 候选基因筛选
对贡献率最高的QTLs 进行生物信息学分析,将QTL置信区间与中国春基因组序列比对,从自然老化5年定位区间筛选出102 个注释基因,人工老化定位区间筛选出122 个注释基因,自然老化1年与人工老化共定位区间筛选出189个注释基因。同源比对后,自然老化5年条件下发现9个候选基因,人工老化条件下发现5 个候选基因,自然老化1年与人工老化共同发现13个候选基因(表5)。
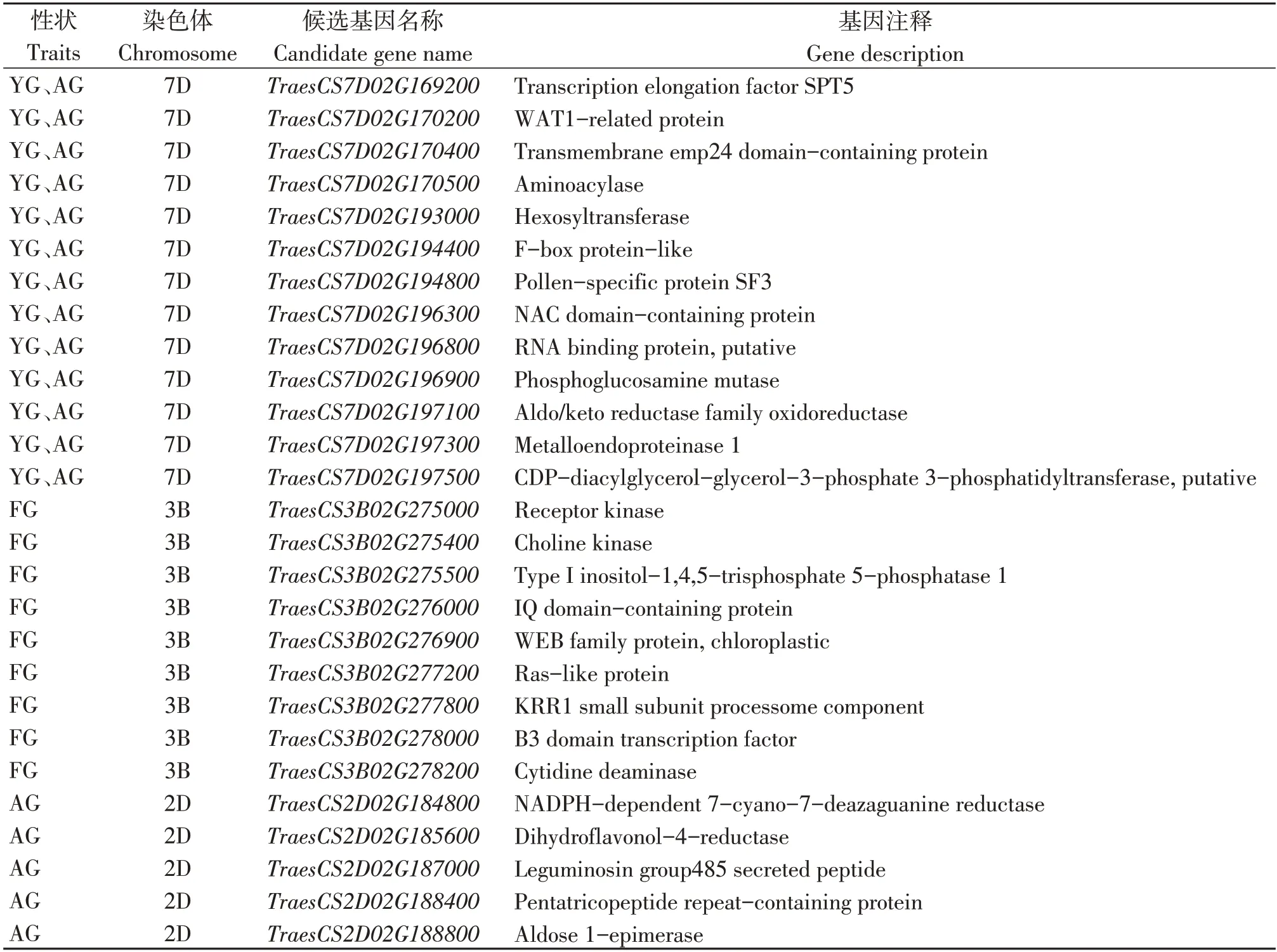
表5 各条件下主效QTL区间候选基因Table 5 Candidate genes of major QTL interval under various conditions
人工老化条件下的候选基因TraesCS2D02G184 800为NADPH 依赖性7-氰基-7-脱氮鸟嘌呤还原酶,TraesCS2D02G185600为二氢黄酮醇-4-还原酶,2 个基因均与NADP 相关,催化酶的活性并响应逆境胁迫,均在根部高表达(图3)。自然老化条件下的候选基因TraesCS3B02G278000为B3 结构域转录因子、TraesCS3B02G277200为Ras 类蛋白,均在胚中特异表达,主要调控植物的生长发育以及响应多种逆境胁迫;TraesCS3B02G278200为胞苷脱氨酶,在籽粒中特异表达,其对DNA复制和损伤修复过程至关重要。自然老化与人工老化共定位基因TraesCS7D 02G194400为F-box 蛋白,在籽粒中特异表达,其在延缓植物衰老、响应逆境胁迫中具有重要作用;TraesCS7D02G197500为CDP-二酰基甘油--甘油-3-磷酸3-磷脂酰转移酶,在根中特异表达,其在植物生长、发育和逆境胁迫反应方面有着重要的作用;TraesCS7D02G169200为转录延伸因子SPT5,在胚乳中特异表达,主要是植物体内转录和组蛋白甲基化的调控因子。
2.3 对老化后发芽势和发芽率显著降低的材料进行麦谷蛋白和醇溶蛋白分析
根据老化前后种子发芽率的变化,选取了差异最大的8 份材料(RIL49、RIL64、RIL76、RIL78、RIL80、RIL102、RIL160、RIL177),进行了麦谷蛋白(图4)和醇溶蛋白分析(表6),其中RIL49、RIL80、RIL102 为高活力材料(老化后平均发芽率:89.06%),RIL64、RIL76、RIL78、RIL160、RIL177(老化后平均发芽率:29.77%)为低活力材料。从谷蛋白的结果来看,材料RIL76、RIL78、RIL80 的大分子量谱带在老化状态下出现了降解,小分子谱带消失的现象。供试材料谷蛋白的含量也有所下降,其蛋白条带的亮度和粗度都较当年收获和储藏一年的材料低。
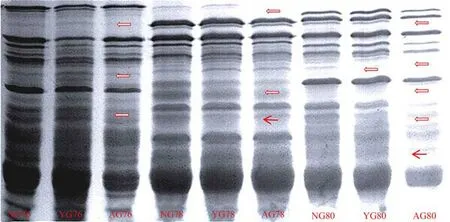
图4 不同处理小麦种子HWM-麦谷蛋白SDS-PAGE电泳图谱Figure 4 SDS-PAGE electrophoresis pattern of wheat seeds under different treatments
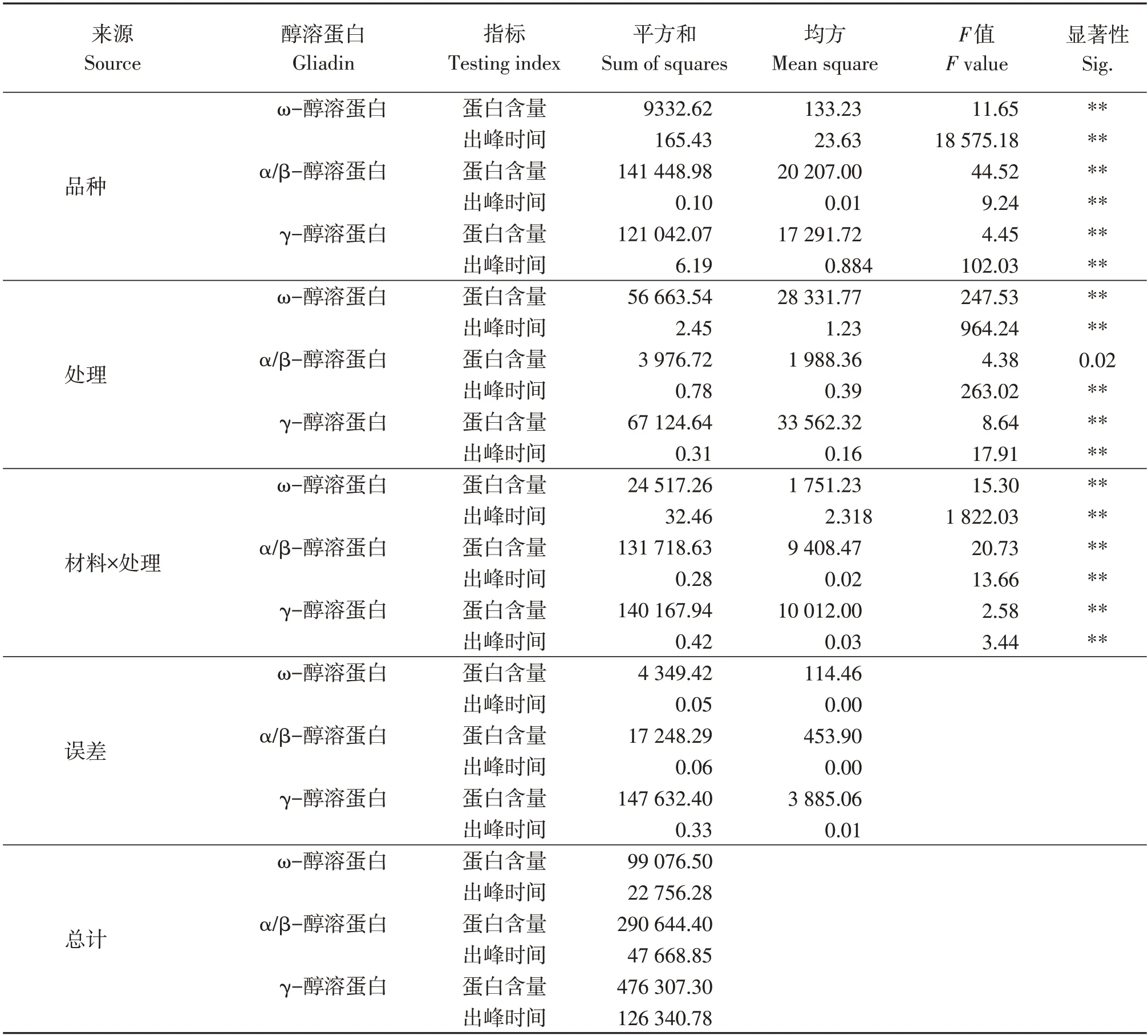
表6 不同处理下不同小麦品种醇溶蛋白含量与出峰时间方差分析Table 6 Analysis of variance between gliadin content and peak time in different wheat varieties under different treatments
在不同品种间和不同处理间醇溶蛋白的出峰时间与醇溶蛋白含量均呈显著差异(表6),但低活力材料(如RIL76)人工老化后ω-醇溶蛋白和α/β-醇溶蛋白含量差异不显著,出峰时间差异不显著,而高活力材料(如RIL102)ω-醇溶蛋白和α/β-醇溶蛋白含量减少,γ-醇溶蛋白增多,出峰时间变早。可以看出不同材料的醇溶蛋白变化不尽相同,高活力的醇溶蛋白降解更快(RIL49、RIL102),低活力的降解慢(RIL76、RIL78)。
3 讨论
3.1 种子发芽相关QTL的检测
种子可以在干燥状态下保存较长时间[28],但随时间的推移,种子的生活力会慢慢消失,主要是由于染色体畸变[29]、自由基产生[30]、脂肪酶活性高[31]等诸多原因引起的。在水稻、拟南芥、白菜、番茄、大麦及高粱[32-39]等作物中,对发芽率的QTL定位多有报道。但小麦的报道相对较少。关望辉[40]创建导入系(IL)群体对小麦种子活力相关性状进行了QTL定位,定位到7个加性QTLs分别位于1D、4D染色体。
本研究共检测到控制小麦发芽的QTL 位点10个,分别位于1B、2D、3A、3B、7D 染色体上,贡献率在2.07%~7.84%,不同老化处理下的主效QTLs分别位于7D(QGpy.sicau-7D-1)、3B(QGrf.sicau-3B)、2D(QGpa.sicau-2D)染色体,其中QGrf.sicau-3B和QGpa.sicau-2D在前人[42]报道中均有相近位点,推测可能为同一位点,另一方面,本研究中自然老化1年与人工老化条件下定位到一致的QTL位点,位于7D染色体,未见前人报道,推测可能为新发现的位点,后续将对其进行精细定位。在不同自然老化处理下并未定位到一致QTL 位点,表明不同年份间的QTL 是动态变化的,与前人[43]研究结果一致,这也与种子衰老过程中不同阶段发生的生理生化变化不同相吻合。
3.2 候选基因的筛选
种子衰老过程会经历一系列复杂的生理变化,人们希望通过挖掘种子活力相关基因并解析其遗传调控机制,对选育高活力的作物品种具有重要意义。在水稻、玉米、拟南芥[44-46]种子活力的相关基因报道中基因注释主要与糖基的消耗、转移、GTP 结合、跨膜蛋白、金属离子结合等相关。M.Hayashi[47]对YK1转基因水稻植株进行代谢和生化分析,发现二氢黄酮醇还原酶(DFR)与下游NADP(H)酶基因协同作用,使水稻对氧化和细菌病害引起的细胞死亡的耐受力升高。Yang T.等[48]对玉米B3 结构域转录因子Zmabi19进行研究,结果显示Zmabi19基因影响玉米醇溶蛋白、淀粉和脂质的积累、胚乳的营养库活性、淀粉和蔗糖代谢。T.Tsutsui 等[49]在拟南芥中ARA6(RAS 家族相关基因)突变体中发现,ARA6通过影响Qua-Quine Starch (QQS)基因维持淀粉和糖的稳态。Xue M.D.等[50]研究发现在高温环境下拟南芥中NO80-C 和转录延伸因子在H2AZ 去除中的协同作用,诱导植株热形态形成,提高植物对高温适应性。结合候选基因在其他作物中表现出的非生物逆境抗性,本研究未来将继续对筛选到的候选基因进行深入研究。
本研究中对自然老化和人工老化条件下的QTLs 区间的注释基因进行同源比对,共发现27 个候选基因,基因功能主要集中于能量代谢过程、催化活性通路、GTP 结合、信号转导过程和植物的抗逆响应等。研究表明不论是自然老化还是人工老化,种子都呈现出一致的生理生化变化,即种子细胞完全死亡之前,会依次发生膜系统受损,酶活性下降,高能量化合物合成速度下降,蛋白质及RNA合成速率下降,萌发及生长缓慢,抗逆境能力下降等反应[51],候选基因筛选结果也与此过程一致。
3.3 老化后种子的蛋白变化
在萌发过程中,蛋白质储存液泡中合成的蛋白酶的水解活性引发了储存蛋白质的分解,从而获得氨基酸,因此贮藏蛋白对种子的萌发和早期生长有重要作用[52-54]。张自阳等[55]表示种子活力的丧失与蛋白的消失和新增加的蛋白质有关,种子活力在基因水平的差异也是通过蛋白质体现出来的,因此研究种子活力与蛋白质的关系对种子活力的研究也有重要意义。
本研究通过对人工加速老化前后发芽率差异显著的材料进行麦谷蛋白和醇溶蛋白分析可以看出,其醇溶蛋白和麦谷蛋白含量下降。谷蛋白大分子条带降解显著,部分小分子区含量增加,但高活力种子与低活力种子差异不明显。高活力材料的醇溶蛋白降解更快,低活力材料则降解慢,醇溶蛋白在γ 区蛋白含量升高,与前人[56]研究结果一致。可能因为种子老化过程中发生了一系列的生理化学反应,可诱导合成新的酶蛋白,使其蛋白质的种类、数量发生改变[12],种子中的贮藏蛋白下降,甚至出现新的蛋白质。刘美慧[16]在对莲子抗老化机制的蛋白组学研究,鉴定出的蛋白质进行功能分析发现表达蛋白质主要集中在氧化应激反应、大分子生物合成、遗传信息表达和碳水化合物代谢等方面。结合候选基因功能主要集中在能量代谢过程、催化活性通路、信号转导过程和植物的抗逆方面,预测消失和出现的新蛋白应该与候选基因相关。
4 结论
从构建的人工合成小麦SHW-L1×川麦32RIL群体中检测出10 个发芽相关QTLs,不同老化处理的主效QTL(QGpy.sicau-7D-1、QGrf.sicau-3B、QGpa.sicau-2D)分别定位于7D、3B、2D 染色体,不同的自然老化年份间QTL为动态变化的,人工老化与自然老化共定位到位于7D 染色体位点,是新发现的种子发芽相关QTL,其中提高种子活力的增效位点来源于人工合成小麦。候选基因筛选主要参与种子发育、萌发及响应逆境的信号转导途径,后续将对候选基因进行相关功能验证并深入挖掘;人工加速老化与自然老化1年条件下,发现染色体一致的QTL位点7D(QGpy.sicau-7D-1和QGra.sicau-7D-1、QGpy.sicau-7D-2和QGra.sicau-7D-3),后续将对此进行精细定位及相关分析,为进一步人工合成小麦提高种子活力提供了依据。

