微反应器内对甲砜基甲苯硝化反应动力学研究
杨兰雪,邱 滔
常州大学石油化工学院,江苏 常州 213164
芳香族硝基化合物广泛应用于农药、医药、染料、香料、炸药等领域[1],其中2-硝基-4-甲砜基甲苯是合成除草剂甲基磺草酮的重要原料,由对甲砜基甲苯经混酸硝化反应合成[2]。然而硝化反应为快速的强放热过程,易形成局部“热点”,有发生爆炸的危险[3],因此,为防止热失控、保证反应安全进行,对硝化反应动力学进行研究是很有必要的。
近年来,芳香族化合物如甲苯[4-5]、硝基甲苯[6-7]、氯苯[8]、苯甲醛[9]等的硝化反应动力学已有相关研究报道,但关于对甲砜基甲苯硝化反应动力学研究甚少。传统釜式反应器内对此动力学参数测定的数据往往不准确,主要原因如下:(1)硝化反应迅速,反应淬灭及取样时间不可忽视;(2)反应高放热,温度分布不均匀,难以维持恒温;(3)反应是液-液非均相反应,存在传质阻力[6,10-12]。硝化反应常被认为发生在水相中,水相由浓HNO3、浓H2SO4和水组成[13],当对甲砜基甲苯进行硝化反应时,对甲砜基甲苯通过有机相扩散到水相,并与浓HNO3和浓H2SO4反应产生的硝酰阳离子结合发生硝化反应,但扩散过程始终存在传质阻力。因此,为了获得准确的动力学数据,需要毫秒级淬灭硝化反应的方法,以及具有优良传质传热性能的装置。
微反应器具有体积小、混合迅速、传质传热效率高等特点,可实现对反应温度的精准控制,搭建连续微流系统可实现对反应时间的精准控制[14],同时,构建均相体系可消除相间传质阻力的影响[15],从而实现对硝化反应动力学数据的精确测定。本工作设计了一种包含微混合器、毛细管微反应器、毫秒级在线淬火模块的连续流微反应系统进行均相硝化反应。首先,借助高效液相色谱构建2-硝基-4甲砜基甲苯的定量方法。其次,将对甲砜基甲苯溶解在过量的硫酸中以形成均相溶液,消除传质阻力的影响。最后,在微反应器内测定混合性能、物质的量比、时间、温度对硝化反应的影响,采集不同条件下对甲砜基甲苯转化率数据进行拟合计算,建立表观动力学模型。
1 实验部分
1.1 反应溶液的配制
溶液A:取5.600 g(0.032 9 mol)对甲砜基甲苯溶解于100 mL 的质量分数为88%的浓H2SO4中,搅拌过夜约12 h,形成均相溶液备用。
溶液B:根据对甲砜基甲苯和硝酸的物质的量比,将一定量发烟硝酸溶解于100 mL 的质量分数为88%的浓H2SO4中,充分搅拌形成均相溶液备用。
1.2 实验流程
用于测定硝化反应动力学参数的连续流微反应系统如图1 所示,使用注射泵1 和注射泵2(TYD01-01 型,保定雷弗流体科技有限公司)将溶液A 和溶液B 以相同的体积流量输送至预热管(聚四氟乙烯,内径为0.5 mm, 外径为1.6 mm)内预热至预设温度。接着,两股流体流入微通道混合器(I)(Y 型微通道,聚四氟乙烯,内径为2.5 mm)内进行充分混合。混合溶液经过延时管1(聚四氟乙烯,内径为0.5 mm,外径为1.6 mm)进行持续反应,通过调节延时管1 的长短来精确控制整个反应停留时间。将延时管1 的出口连接到微通道混合器(Ⅱ)(Y 型微通道,聚四氟乙烯,内径为2.5 mm)的入口处,同时外接计量水泵[NKCP-C-S04B 型号,卡川尔流体科技(上海)有限公司]将水输送至微通道混合器内对硝化反应进行实时淬灭,以保证实验结果的准确性。然后混合溶液经过延时管2(聚四氟乙烯,内径为0.5 mm,外径为1.6 mm)流入样品瓶中。整个预处理、反应、淬火模块均浸入低温恒温槽(DHC-1005-B 型号,杭州齐威仪器有限公司)内以获得均匀温度。

图1 硝化反应动力学测定装置Fig.1 Experimental setup for determining kinetic parameters of the nitration reaction
1.3 样品分析
反应淬灭后,由于对甲砜基甲苯(or)和2-硝基-4-甲砜基甲苯(nb)均能较好地溶解于乙腈中,故收集8 滴样品于5 mL 样品瓶中,加入乙腈进行充分稀释。样品混合均匀后,采用配制C18 色谱柱的液相色谱仪(型号为L-3000,Rigol 公司)检测2-硝基-4-甲砜基甲苯,柱温箱温度为30 ℃,波长为223 nm,流动相乙腈和水的体积比为45:55,流量为1 mL/min。
对甲砜基甲苯的转化率(xor)由公式(1)计算:
式中:Cor是对甲砜基甲苯的浓度,mol/L;Cnb是2-硝基-4-甲砜基甲苯的浓度,mol/L。
反应停留时间由公式(2)计算:
式中:t是反应停留时间,s;V是毛细管微反应器的体积,mL;QA和QB分别是对甲砜基甲苯均相溶液和混酸溶液的体积流量,mL/min。
1.4 对甲砜基甲苯在硫酸中的溶解度测定
为测定对甲砜基甲苯在硫酸中的溶解度,将过量的对甲砜基甲苯加入0.5 mL 特定浓度H2SO4中,并将混合物密封在10 mL 反应管中,水浴控温,磁力搅拌约12 h,静置12 h。用移液管收集液相于2 mL离心管内,再用带有过滤头的针管吸取0.2 mL 样品溶解在50 mL 容量瓶中,用乙腈稀释后进行液相色谱仪(HPLC)分析。
对甲砜基甲苯在H2SO4中的摩尔分数溶解度(Xs)由方程(3)计算:
式中:nor,nhs和nH2O分别是对甲砜基甲苯,H2SO4和H2O 的物质的量。
1.5 标准曲线的建立
1.5.1 对甲砜基甲苯标准曲线的建立
用精度为0.000 1 g 的分析天平称取0.016 0 g 对甲砜基甲苯标准品于50 mL 容量瓶中,加乙腈进行稀释。从50 mL 容量瓶中分别移取0.2,1.2,2.2,3.2,4.2,5.2 mL 溶液于10 mL 容量瓶中,稀释至刻度线,定容摇匀。利用高效液相色谱测定不同浓度样品中对甲砜基甲苯的峰面积,结果如图2 所示。从图2 中可知,在浓度为3.759×10-5~9.775×10-4mol/L 时,对甲砜基甲苯的峰面积与物质的量浓度呈良好的线性关系,用最小二乘法求得线性回归方程[公式(4)],此为硝化反应物定量研究的标准曲线方程。
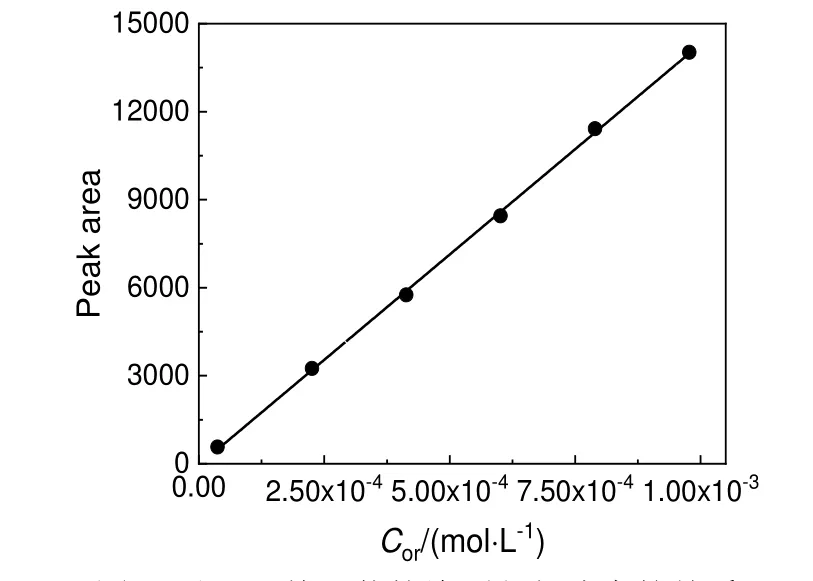
图2 对甲砜基甲苯的峰面积与浓度的关系Fig.2 The peak area of p-methylsulfonyl toluene and concentration linear relationship
1.5.2 2-硝基-4-甲砜基甲苯标准曲线的建立
2-硝基-4-甲砜基甲苯标准曲线建立方法同上,结果如图3 所示。从图中可知2-硝基-4-甲砜基甲苯浓度为2.974×10-5~7.731×10-4mol/L 时,峰面积与浓度呈良好的线性关系。用最小二乘法求得线性回归方程[公式(5)],此为硝化反应产物定量研究的标准曲线方程。
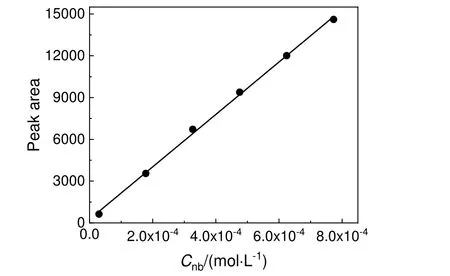
图3 2-硝基-4 甲砜基甲苯的峰面积与浓度的关系Fig.3 The peak area of 2-nitro-4-methylsulfonyl toluene and concentration linear relationship
2 实验结果与讨论
2.1 对甲砜基甲苯在硫酸中的溶解度
对甲砜基甲苯在H2SO4溶液中的溶解度是保证硝化反应在均相条件下进行的重要参数。在温度为15~25 ℃下探究了对甲砜基甲苯在H2SO4中溶解度随H2SO4浓度(质量分数,Ws)的变化情况,结果如图4 所示。研究表明,对甲砜基甲苯在H2SO4溶液中的溶解度随H2SO4浓度的升高而升高,随温度的升高而下降。实测温度为25 ℃时,对甲砜基甲苯在88%的H2SO4溶液中的溶解度是0.3861(0.323g/1 g)。因此,在本实验温度范围内,对甲砜基甲苯在给定温度下均可以完全溶解在88%的H2SO4溶液中,形成均相溶液。溶解度实验证明对甲砜基甲苯在混酸中进行均相硝化反应在预期实验条件下是可行的。

图4 不同温度下Xs 随Ws 的变化Fig.4 Changes of Xs with Ws at different temperatures
2.2 连续流微反应系统的混合性能
尽管在微反应器内进行对甲砜基甲苯均相硝化反应消除了相间传质阻力的影响,但溶液的充分混合对反应也至关重要。动力学研究中,溶液混合不均匀也会阻碍反应速率,因此充分混合对于准确测定动力学数据是必要的。为使反应物在微反应系统中达到最佳混合效果,研究了微反应器内径和反应流速对对甲砜基甲苯转化率的影响。
参照公式(2),反应停留时间由体积流量和毛细管微反应器的体积决定。反应温度为20 ℃,反应溶液体积流量为1 mL/min,停留时间为8 s 时,不同微反应管内径(D)对硝化反应转化率的影响如图5 所示。结果表明,在相同反应条件下,随着微反应管内径的增大,对甲砜基甲苯的转化率降低。相同进样流量下,微反应管内径越小,截面积越小,流体流速越大。因此,在内径较小的微反应器中进行反应混合效果最好。进一步减小微反应管内径至0.3 mm 时,受压力影响,溶液输送较为困难。因此,后续采用内径为0.5 mm 的微反应管进行下一步研究。
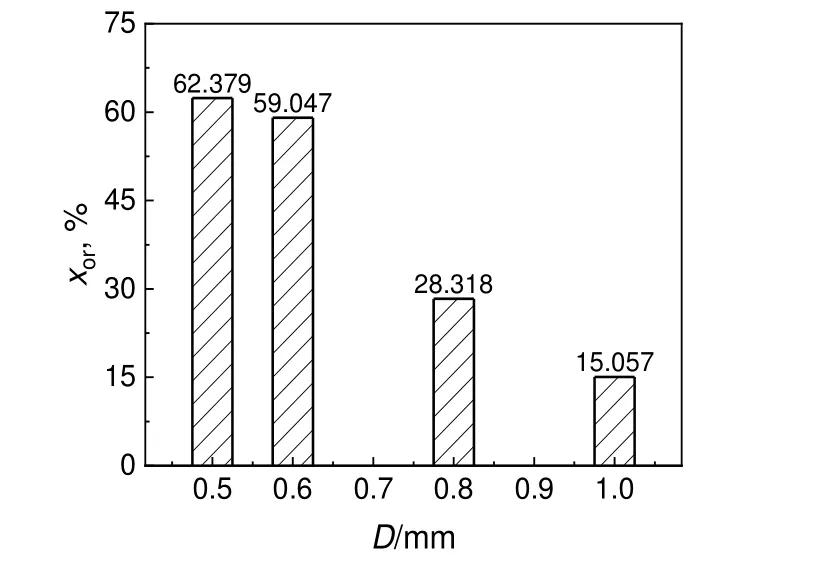
图5 不同管内径对转化率的影响Fig.5 Effect of different pipe diameters on conversion
为了在选定的微反应管中实现最佳混合效果,在反应温度为10 ℃,固定反应管长为61.1 cm,管内径为0.5 mm 时,考察不同反应溶液的体积流量对硝化反应转化率的影响如图6 所示。结果表明,当体积流量小于1 mL/min 时,随着体积流量的增加,两种反应液在微反应器中混合变得更加剧烈,传质效果提高,反应更加迅速,从而使得对甲砜基甲苯转化率提高。当体积流量大于1 mL/min 时,达到理想体积流量的范围,消除了均相混合效应对反应的影响,传质发生在相间,所以对甲砜基甲苯转化率基本不变。因此,所有后续的动力学实验均在体积流量为1.2 mL/min 下进行研究。

图6 不同体积流量对转化率的影响Fig.6 Effect of different volume flow rate on conversion
2.3 物质的量比的影响
在温度为25 ℃、停留时间为3 s、反应溶液体积流量为1.2 mL/min 的条件下,研究了HNO3与对甲砜基甲苯的物质的量比对硝化反应转化率的影响。结果如图7 所示。结果表明,随着HNO3和对甲砜基甲苯物质的量比增大,对甲砜基甲苯的转化率明显提高。后续的动力学实验均在物质的量比为1.3条件下进行。硝化反应中起作用的主要是硝酸碱式电离产生的NO+2
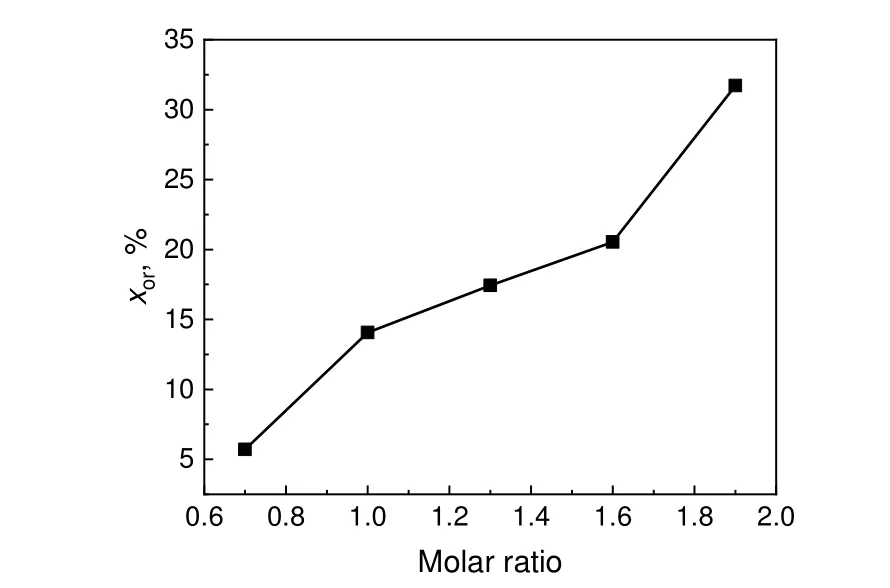
图7 HNO3 与对甲砜基甲苯物质的量比对转化率的影响Fig.7 Effect of molar ratio of HNO3 to p-methylsulfonyl toluene on conversion
[16],但是硝化反应产生的水会逐渐稀释硝酸从而抑制 NO+2的产生。高浓度的硫酸具有强吸水作用和较大酸度,能够促进 NO+2的产生,故将少量硝酸溶于大量硫酸中进行硝化。
2.4 微反应动力学参数的测定
研究表明芳香族化合物混酸硝化反应遵循二级反应动力学[17],假设对甲砜基甲苯硝化反应是二级反应,对于芳烃和硝酸都是一级反应。对甲砜基甲苯硝化反应方程式见式(6):
则对甲砜基甲苯硝化反应速率(r)方程可描述为方程(7):
式中:k是基于HNO3的二级反应速率常数,L/(mol·s);Cns是HNO3的浓度,mol/L。
反应速率方程(7)可根据对甲砜基甲苯初始浓度和转化率进行转换得方程式(8):

对甲砜基甲苯转化率是表征反应进程和衡量反应速率的重要参数。研究了转化率与温度和停留时间的关系如图8 所示。图8 结果表明,在对甲砜基甲苯转化不完全的情况下,转化率随停留时间的增加而增加。在相同停留时间内,转化率随温度升高而增加,高温能显著加快化学反应速率。


图8 温度和停留时间对反应转化率的影响Fig.8 Effect of temperature and reaction time on conversion
温度与反应速率常数的关系符合阿伦尼乌斯方程:
式中:A为指前因子;Ea为活化能,J/mol;R为普适气体常数,其值为8.314 J/(mol·k)。

表1 不同温度下的反应速率常数Table 1 Reaction rate constants at diffferent temperatures
根据阿伦尼乌斯方程,以lnk对1/T作图,拟合数据得到线性方程式,结果见图10。由其斜率和截距求得,硝化总反应的活化能为50.65 kJ/mol,指前因子为7.16×1012L/(mol·s)。
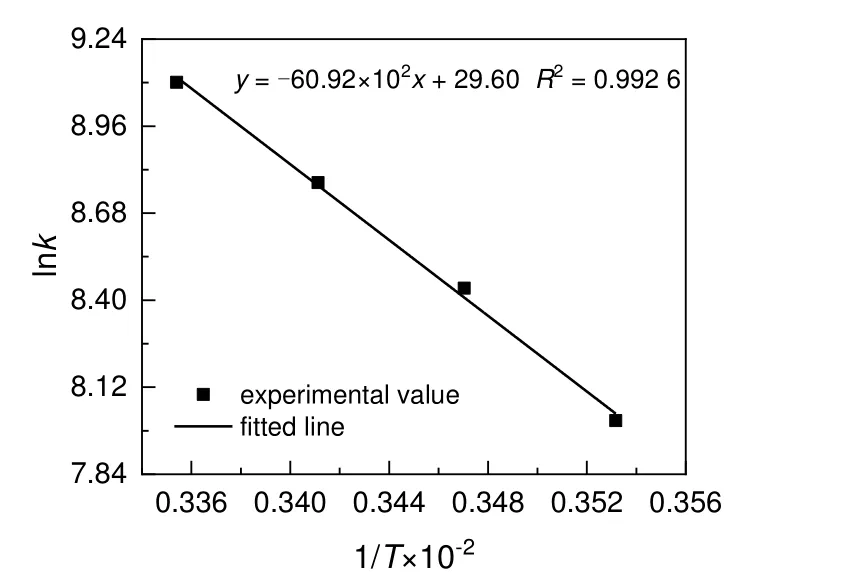
图10 Arrhenius 方程线性拟合结果Fig.10 Fitting plot of Arrhenius equation
2.5 模型检验
反应温度为10 ℃,反应液进样流量为1.2 mL/min 条件下,通过改变停留时间预测对甲砜基甲苯的转化率,以此对反应动力学模型进行验证。实验结果如图11 所示,实验数据与计算数据拟合良好。说明在实验条件范围内反应动力学模型具有良好的适用性。

图11 不同停留时间下对甲砜基甲苯的实测值与预测值比较Fig.11 Comparison of experimental value and predicted value of p-methylsulfonyl toluene under different rescidence time
3 结 论
研究了一种包含微混合器、毛细管微反应器及在线淬火模块的连续流微反应系统,用于对甲砜基甲苯均相硝化反应动力学参数的测定。
a)通过研究微反应管内径和溶液体积流量对微反应系统混合性能的影响,确定最适工艺参数:反应管内径为0.5 mm,反应溶液体积流量为1.2 mL/min。
b)利用高效液相色谱建立硝化反应产物的定量方法,研究了质量分数为88%的H2SO4时,在温度为10~25 ℃、停留时间为1~5 s 条件下的对甲砜基甲苯硝化反应动力学参数。结果表明,该反应是二级反应,指前因子为7.16×1012L/(mol·s),活化能为50.65 kJ/mol。并通过实验验证实测值与拟合计算值吻合良好,证明了该模型的有效性。
该模型的建立有助于深入了解对甲砜基甲苯硝化反应的全过程,为后续对反应操作条件进行优化提供了参考,同时为实际生产中反应器结构设计和安全操作提供了理论依据。

