微波消解-原子吸收法测定土壤中的铬
曾庆招
(广东省矿产应用研究所(自然资源部放射性与稀有稀散矿产重点实验室),广东 韶关 512026)
0 引言
随着现代工业的快速发展,铬离子被广泛应用于日常生活中。铬离子分为Cr(Ⅲ)和Cr(Ⅵ)。其中,Cr(Ⅲ)离子是人体所需重要的微量营养素[1],可以协助胰岛素平衡血糖浓度,而Cr(Ⅵ),作为铬(Cr)的另一种稳定形式,却是一种严重的污染物,具有致癌作用,被广泛应用于金属电镀、采矿、化肥、农药生产、制革、电池、造纸等制造业中。近年来,由于大量企业滥排乱放造成了严重的铬(Cr)污染问题,严重破坏了生态系统。
目前Cr(Ⅵ)离子的检测方法主要有离子色谱法、原子吸收光谱法、原子发射光谱法、分光光度法、电感耦合等离子体质谱法、X 射线荧光法(XRF)等[2-4]。其中,波消解-原子吸收法具有灵敏度高、操作简单、稳定性好特点,被广泛应用于土壤中Cr(Ⅵ)离子的检测[5]。雷琼等[6]研究了微波消解、湿法消解以及干法灰化前处理方法在通过原子吸收光谱测定铬元素精准度的研究,发现微波消解的加标回收率在96%~101%之间,比干法灰化高出5%,比湿法消解高出4%,可以看出,微波消解的测试精准度更高。卞彩霞等[7]利用微波消解-原子吸收分光光度法测定了茶园土壤中的铜、铬,优化研究表明,当测试波长为325 nm,狭缝宽度为0.7 mm,φ(乙炔)∶φ(空气)=2.5∶7.5 时,铜、铬的测试稳定性最好,精确度最高。尽管微波消解测试结果更加准确,但测试设备价格高昂也限制了微波消解的应用与推广。目前微波消解不仅应用于铬元素的检测,还应用于其他重金属元素的检测,例如铅、铜、锌、锰、镍、镉[8]等重金属,已经成为了一种可靠的、灵敏性好、精确度高重金属检测方法。
本文采用微波消解作为前处理方法,选用远离工厂等重大污染源的小麦种植区域土壤作为检测对象,采用盐酸、硝酸、氢氟酸、高氯酸、双氧水作为消解剂,研究了不同条件下的消解情况,确定了最佳消解体系,同时验证了其准确度。
1 实验部分
1.1 仪器与试剂(表1、表2)
表1 实验仪器

表2 实验药品
Cr,100 μg/mL,国家化学试剂质检中心,GB/T602-2002;
质控样:国家标准物质土壤标准参考样GBW07424(CSS-10);
所用玻璃量具均用王水浸泡24 h,使用前使用大量超纯水冲洗后自然风干。
1.2 样品采集与预处理
本实验所选用土壤样品为小麦种植区域土壤且该种植区远离工厂等重大污染源。将采集的土壤样品避光放置下自然风干,然后去除肉眼可见的砂石、动物骨头、植物根茎、塑料等杂质,之后用玛瑙研钵细细碾碎,直至能透过100 目(150 mm)筛子,均匀混合后备用。
1.3 样品的消解
用电子天平准确称量国家标准物质土壤标准参考样和经上述加工过的土壤样各0.3 g 左右,平行称量6 次,置于密封高压消解罐中。用0.1 mL 超纯水润湿,然后加入9 mL 硝酸、3 mL 盐酸,接着加入6 mL过氧化氢、3 mL 氢氟酸。待样品被酸液充分浸润后,盖紧罐盖,并将消解罐安装好。放入微波反应器中,于5 min 内升至120 ℃,保持5 min;再升温15 min 至210 ℃,保持80 min。
微波消解仪设置功率为1 500 W,消解完毕后,先等待其冷却至室温,再将消解罐取出。为了避免HF对原子吸收分光光度计的腐蚀,需要先进行赶酸,将消解罐置于80 ℃的电热消解仪上,当消解液蒸发近干,或呈黏稠状,或呈湿盐状,此时赶酸完毕。之后用0.5%硝酸溶液洗涤消解内管及盖数次,将消解液转移至50 mL 容量瓶,并制备2 个空白溶液。
1.4 标准溶液的配置
采用移液管准确移取1 mL 的Cr 标准溶液至100 mL 容量瓶,0.5%硝酸溶液定容,配制成质量浓度为1.0 μg/mL 标准储备液。再分别准确称取一定体积的储备液,采用0.5%硝酸溶液逐级稀释成不同浓度范围的标准溶液。质量浓度分别为0、20.0、50.0、100、200、500 ng/mL。样品测定时根据实际情况采用0.5%硝酸进行稀释。
1.5 样品检测
检测条件如表3。

表3 火焰原子吸收分光光度计工作条件
2 结果与讨论
2.1 不同条件下的消解情况对比
土壤通常由各种无机盐以及有机质组成,成分比较复杂,因此针对土壤中重金属含量的检测需要特别的前处理方式,而酸消解就是一种比较常见的处理方式。针对土壤复杂的组成,合适的酸体系十分重要,其决定着检测结果的准确性。土壤中含有大量的硅酸盐,其中可能包裹着大量的金属元素及其他不知名成分,而要破坏硅酸盐的结构需要氢氟酸,氢氟酸对硅酸盐及二氧化硅有极强的腐蚀性,这是其他酸所不具备的特性。而对于土壤中的金属元素及有机质则需要强氧化性的酸来降解。硝酸和高氯酸都具有极强的氧化性,能够将土壤中的有机组成氧化成二氧化碳和水。同时硝酸和盐酸通过特定的配比还可以组成王水或逆王水,进一步增强其消解金属元素能力。过氧化氢的加入能够加速硝酸分解金属的速度,稀硝酸的反应产物是一氧化氮,过氧化氢能把一氧化氮氧化为二氧化氮,二氧化氮溶于水再次成为硝酸,因此在酸体系中过氧化氢也有着重要作用。基于以上讨论,本文设计了表4 不同的消解体系。

表4 不同体系下的各种酸及过氧化氢体积比
不同体系的消解前处理均按照1.3 中的实验方法进行处理,样品平行测定6 次,Cr 含量检测结果及相对标准偏差(RSD)见表5。
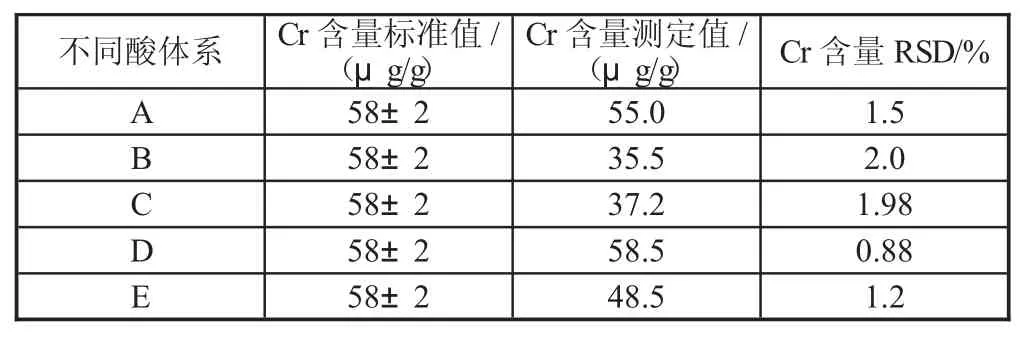
表5 不同酸体系下的消解
消解完成后,发现D 体系硝酸-盐酸-过氧化氢-氢氟酸(体积比3∶1∶2∶1)的消解液无肉眼可见的沉淀与悬浮物,清澈且透明,结合实验结果,D 体系的测定值与标准值十分接近,基本可以断定D 体系中土壤基本消解完全。而A 体系中有微量的悬浮物,B 体系、C 体系与E 体系的消解液中则含有微量的沉淀,这与检测结果是相符的,其测定值与标准值之间仍有一定的差距。A 体系与D 体系的结果最为接近,其中共同的组成,氢氟酸破坏硅酸盐的晶格结构,使得其中的金属元素得以进入到消解液中,过氧化氢则氧化硝酸反应过程中的一氧化氮,生成二氧化氮,二氧化氮则再次溶解形成硝酸。区别在于D 添加了适量的盐酸,与王水比例相同,大大增强了消解能力。综上所述,硝酸-盐酸-过氧化氢-氢氟酸(体积比3∶1∶2∶1)为最佳消解配比。
2.2 标准曲线的绘制
按照1.3 实验方法进行标准样品的前处理表1设置仪器参数,将所配置的不同浓度的Cr 溶液进行检测,得到图1 线性方程y=0.096 8x+0.000 8(x 为溶液中Cr 的质量浓度,ng/mL;y 为吸光度强度),线性相关系数为0.999 8,线性范围20~500 ng/mL,检出限1 ng/mL。
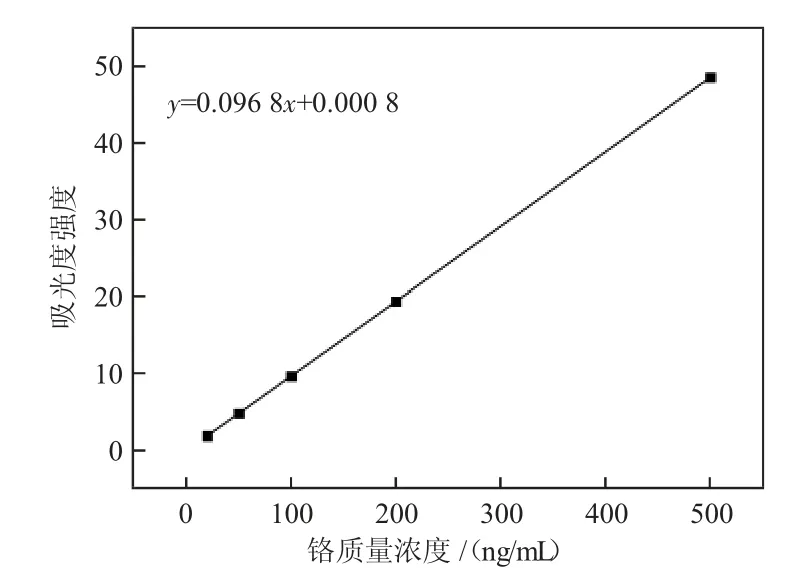
图1 线性方程
2.3 准确度验证
评价方法准确度的方法:
1)选取已知Cr 含量的标准土壤样品,通过1.3的前处理,将测定值与标准值进行比对,测定值与标准值几乎一致,表明该方法具有较高的准确度。结果见表5 D 体系。
2)通过添加已知浓度的Cr 元素待测液到土壤样品中,然后通过1.3 实验前处理,进行检测,测定加标回收率,回收率在98%~103%(表6),说明方法的准确度高,测定结果准确可靠。
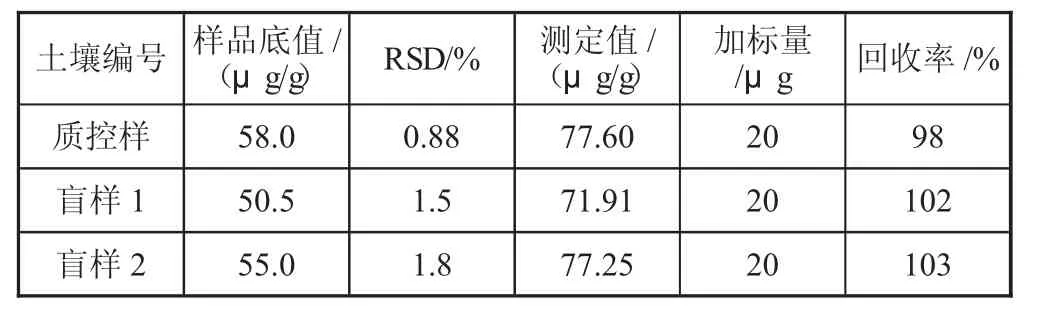
表6 土壤样品加标回收率检验(n=6)
3 结论
本文通过多种消解酸体系的实验,确定HNO3-HCl-H2O2-HF(体积比3∶1∶2∶1)为测定土壤中Cr 较为理想的消解酸体系,硝酸与盐酸形成的王水比例以及过氧化氢的引入使得其对有机物消解更为充分,HF 酸的加入能破坏硅酸盐晶格,使得内部的金属元素充分暴露出来。结合微波消解,更具有省时、分解完全、重现性好的优点。
按照本文方法微波消解-原子吸收法测定土壤中Cr,得到线性方程y=0.096 8x+0.000 8,线性相关系数为0.999 8,线性范围20~500 ng/mL,检出限1 ng/mL。RSD 小于1%,加标回收率98%~103%之间。

