安眠酮胶体金免疫快速检测试纸条的研制
刘国华,蒋永青,陈 彤*,黄 婷,许 芳
(1.深圳市质量安全检验检测研究院,广东 深圳 518000;2.广东省市场监督管理局食用农产品监管重点实验室,广东 深圳 518000;3.深圳市绿诗源生物技术有限公司,广东 深圳 518120)
安眠酮(methaqualone,MTQ) 又名甲苯喹啉酮,化学式为C16H14N2O,在临床上常用作催眠药、镇定药,主要用于动物过度兴奋或惊厥,可使其机体平静,人若过量服用安眠酮则会出现安眠酮中毒现象,表现为意识模糊不清、注意力不集中、恶心、头晕、无力、烦躁不安甚至短时间内精神失常等[1]。在医学上,服用小剂量的安眠酮会使服用者进入极端神经质和兴奋状态,长期服用则会产生依赖性或成瘾性[2]。1978 年以来随着安眠酮使用量的逐渐增加,安眠酮成为滥用药品之一。1971 年《精神药物公约》将安眠酮列入其中,并已有17 个国家禁止使用和出口安眠酮,我国于1987 年禁止了安眠酮的生产和流通。
同时,安眠酮还具有促进畜禽生长、诱导畜禽入睡和提高产量的作用,随着我国畜牧业的壮大,一些养殖场(户)因利益的驱动,在饲喂畜禽时肆意补充,造成动物源性食品的兽药残留量超标,影响人类的身体健康[3-4]。2007 年,中华人民共和国农业农村部公告第824 号文件明确规定,国家管制的精神药品,如安眠酮,在动物源性食品中残留为零。根据《食品动物中禁止使用的药品及其他化合物清单》(中华人民共和国农业农村部公告第250 号)文件规定,安眠酮为禁止使用的药物,在动物性食品中不得检出。
目前,我国尚未规定安眠酮在动物源性食品中的残留限量和检测方法标准,国际社会对安眠酮残留检测也尚未有相应的检测标准。安眠酮的检测方法主要有高效液相色谱(high performance liquid chromatography,HPLC)[5]、气相色谱-质谱联用法(gas chromatography-mass spectrometry,GC-MS)[6]和液相色谱-串联质谱联用法(liquid chromatography-tandem mass spectrometry,LC-MS/MS)[7]等。但在检测过程中,这些方法存在样本前处理复杂、所需仪器设备昂贵、操作繁琐、效率较低、成本较高等缺陷,且无法快速检测出动物源性食品中安眠酮的残留量。因此,亟须建立一种快速、灵敏、准确的安眠酮残留量检测方法,对猪肉等动物源性食品中安眠酮的残留量进行检测和筛查,为我国畜禽产品中安眠酮残留量检测方法的国家标准制定提供理论依据与技术支持。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
试验所用3 只雄性新西兰大白兔购自广东省医学实验动物中心。
1.1.2 主要试剂
氯金酸、牛血清白蛋白均购自山东省青岛市李沧区中恒展创生物技术中心公司,碳酸钾购自国药集团化学试剂有限公司,弗氏完全佐剂购自西格玛奥德里奇(上海)贸易有限公司,二甲基甲酰胺、碳化二亚胺、N-羟基琥珀酰亚胺、柠檬酸三钠复溶液均购自上海麦克林生化科技股份有限公司。
1.1.3 主要仪器设备
BSA4202S 电子天平购自赛多利斯科学仪器有限公司,XYZ 三维划膜喷金仪、ZQ2000 切条机由上海金标生物科技有限公司生产,HD-9623A 电热恒温鼓风干燥箱购自上海精宏实验设备有限公司,TWCL-T1000 加热磁力搅拌器由巩义市予华仪器有限责任公司生产,H2-16KR 高速冷冻离心机购自湖南可成仪器设备有限公司。
1.2 方法
1.2.1 安眠酮半抗原的制备及鉴定
以邻乙酰氨基苯甲酸和3-甲基-4-氨基苯甲酸甲酯为化学原料,通过一系列缩合反应和水解反应实验,最终获得安眠酮半抗原,并对其进行质谱鉴定。
1.2.2 安眠酮抗原的制备
10.0 mg 安眠酮半抗原溶解于1 mL 二甲基甲酰胺(dimethylformamide,DMF) 中作为反应液Ⅰ;30 mg 碳化二亚胺(carbo diimide,EDC) 和20 mg N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS) 用0.5 mL DMF 充分溶解后加入反应液Ⅰ中,室温下搅拌24 h,作为反应液Ⅱ;60 mL 牛血清白蛋白(bovine serum albumin,BSA) 充分溶解在6.0 mL pH 为8.0 的磷酸盐缓冲液(phosphate buffer saline,PBS)中,将反应液Ⅱ逐滴缓慢滴加到BSA 溶液中,并于室温下搅拌24 h,作为反应液Ⅲ;用0.01 mol/L PBS 在4 ℃时透析3 d,以除去未反应的小分子物质,获得包被抗原,于—20 ℃保存备用。
1.2.3 安眠酮多克隆抗体的制备及鉴定
用合成的抗原免疫试验动物,制备多克隆抗体。选择雄性新西兰大白兔3 只,体重2 kg左右,编号分别为1 号、2 号、3 号,采用颈背部皮下多点注射法免疫。免疫程序如下:将相同体积的免疫抗原与弗氏完全佐剂混合进行乳化,初次免疫剂量为0.5 mg/只。初次免疫后第21天和第42天进行加强免疫,剂量为0.4 mg/只,乳化方法相同。以后每隔21 d 加强免疫一次,共免疫8 次。从第3 次加强免疫开始,每次免疫7 d 后对动物采血并进行血清效价测定和特异性检测,安眠酮阳性浓度设定为10 µg/kg和30 µg/kg。
1.2.4 胶体金的制备
采用柠檬酸三钠还原法制备胶体金。取500 mL 超纯水置于1 L 圆底烧瓶中,放入3.0 cm 转子,上接冷凝管置于磁力加热搅拌器上加热煮沸,煮沸后继续加热3 min。准确吸取2.4 mL 1% AuCl3溶液加入圆底烧瓶中,继续加热至煮沸,煮沸持续5 min,再吸取9.1 mL 1%柠檬酸三钠溶液,迅速加入圆底烧瓶中,继续煮沸,同时观察瓶中的颜色变化;当颜色呈稳定的酒红色后,继续煮沸10 min,取出圆底烧瓶置于操作台上,冷却至室温,补水至原体积,4 ℃冰箱保存备用。
1.2.5 胶体金最适标记pH
取4 根无菌的1.5 mL 试管,每管加入1 mL 胶体金溶液,分别加入2、3、4、5 µL K2CO3(0.2 mol/L) 调整各管溶液pH。反应10 min 后,每管加入10 µg/mL 的安眠酮多克隆抗体,混匀静置15 min 后观察胶体金颜色。每管加入100 µL BSA(10%)溶液混匀封闭1 h,4 ℃ 8 000 r/min 离心10 min,200 µL 复溶液重悬,使用试纸条检测,确定最适标记pH。
1.2.6 胶体金最佳蛋白标记量
取3 个无菌的1.5 mL 试管,每管加入1 mL胶体金溶液,加入4 µL 0.2 mol/L K2CO3溶液混匀,再分别加入3.52、7.40 和10.92 µg/mL的安眠酮多克隆抗体,混匀静置20 min,向每管中加入100 µL BSA(10%)溶液,混匀后封闭1 h,4 ℃ 8 000 r/min 离心10 min,200 µL 复溶液重悬,使用试纸条检测,确定最佳蛋白标记量。
1.2.7 胶体金标记抗体制备
取100 mL 胶体金溶液置于250 mL 烧杯中,将烧杯放于磁力搅拌器上,放入转子,向其中加入400 µL 0.2 mol/L K2CO3溶液,用保鲜膜封口,200 r/min 搅拌10 min。用超纯水稀释抗体使其蛋白浓度为7.4 µg/mL,向调整好pH 的胶体金溶液中逐滴加入稀释好的抗体溶液,待溶液搅匀20~30 s 后吸取胶体金溶液,加入到稀释抗体的离心管中,洗净管壁上残留的抗原,吹吸3~5 次,并将溶液加回至烧杯中。继续搅拌30 min,向标记好的胶体金溶液中加入10 mL BSA(10%)溶液,室温搅拌封闭30 min,4 ℃ 10 000 r/min 离心30 min。结束后取出离心管收集下层浓缩的金标抗体。根据量取的胶体金体积计算加入的复溶液体积,向收集的金标抗体中加入复溶液,混匀,备用。
1.2.8 试纸条的组装
使用喷膜仪在玻璃纤维上喷金标抗体,喷量为8 µL/cm,38 ℃下干燥24 h,即得金标垫;将偶联抗原安眠酮-卵清白蛋白(ovalbumin,OVA)用0.02 mol/L PBS 缓冲液(pH 为7.4)稀释至0.8 mg/mL,用喷膜仪喷于硝酸纤维素(nitrocellulose,NC)膜上,喷量为2 µL/cm,为检测线(T 线);在检测线上面5 mm 处喷涂羊抗鼠IgG(0.8 mg/mL),喷量为2 µL/cm,为质控线(C 线),38 ℃下干燥24 h。干燥完成后依次将NC 膜、金标垫、样本垫、吸水垫贴在聚氯乙烯(polyvinyl chloride,PVC)板上,组装成半成品试纸。将组装好的半成品试纸用切条机切割成4 mm 宽的试纸条,分别装入塑料卡壳中,用压壳机将壳封闭,制备成成品检测试纸条。
1.2.9 检测时间分析
按照安眠酮胶体金免疫快速检测试纸条操作流程,2 人一组,共计5 组,对阴阳性标准品进行检测,记录样本检测时间。
1.2.10 试纸条操作方法
将检测卡平放,用微量移液器吸取待检样本100 µL 加入检测卡加样孔中,静置5~8 min后观察结果并读数,其他时间读数无效。如果T 线显色强于C 线或与C 线显色无明显差异,说明样本呈阴性,即样本不含安眠酮或其浓度低于检测限;如果T 线显色明显弱于C 线显色,或者T 线不显色,说明样本呈阳性,即样本中安眠酮浓度等于或高于检测限;如果C 线不显色,则无论T 线显色与否都说明此试纸条已经失效(图1)。
1.2.11 试纸条的性能评价
1.2.1 1.1 敏感性试验 将安眠酮标准品配成1 µg/kg 浓度,再将5 个阴性尿样配制成不同浓度(0、10、20、30、40、50 µg/kg),分别用试纸条进行检测,观察显色结果。每个浓度重复3 次,根据结果确定试纸条的敏感性。
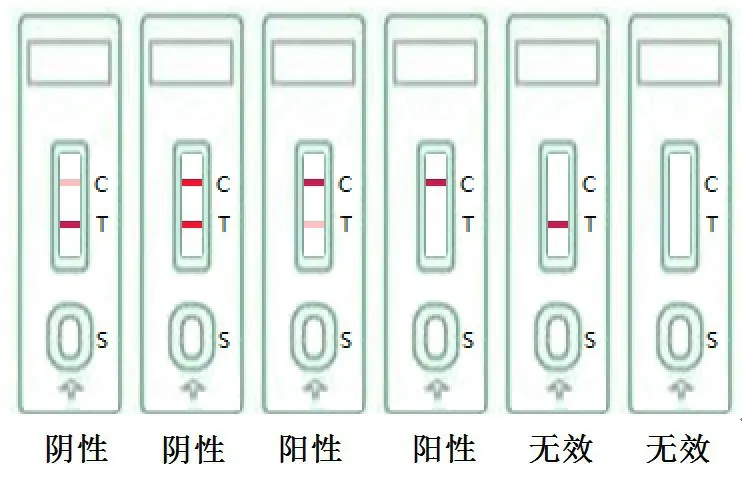
图1 试纸条结果判定示意图
1.2.1 1.2 特异性试验 将其他相关动物常见兽药残留物质包括四环素类、喹诺酮类、磺胺类等药物,用0.02 mol/L PBS(pH 7.4)缓冲液配制成浓度为500 µg/kg 的溶液,分别取100 µL 用试纸条进行检测,观察显色结果。每个浓度的样本重复检测3 次,根据结果确定试纸条的特异性。
1.2.1 1.3 准确性试验 试纸条的准确性通常以假阳性率和假阴性率表示,假阳性率应小于5%,假阴性率应为0。用试纸条检测经仪器确证的50 份阴性样本(质量分数<30 µg/kg)和50 份阳性样本(质量分数>30 µg/kg),计算假阳性率和假阴性率。
1.2.1 1.4 重复性试验 取同一批次和不同批次的试纸条分别检测已经仪器确证的20 份阴性样本(质量分数<30 µg/kg)和20 份阳性样本(质量分数>30 µg/kg),每个样本重复测定3 次,确定试纸条的重复性。
1.2.1 1.5 稳定性试验 将制备好的试纸条密封后储存于37 ℃,分别在第0、5、10、15、20、25、30 天,抽取不同保存期限的试纸条,检测已经仪器确证的样本,确定试纸条的稳定性。
2 结果
2.1 安眠酮半抗原的鉴定结果
对获得的安眠酮半抗原进行质谱鉴定,半抗原的理论相对分子质量是365.3,质谱的正离子模式(+1),测出的相对分子质量是366.3(图2),说明安眠酮半抗原合成成功。

图2 安眠酮半抗原的质谱检测图
2.2 安眠酮抗原的制备结果
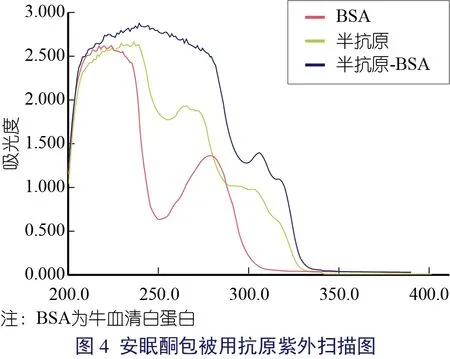
本研究制备的安眠酮半抗原,其结构上有活性基团羧基,利用羧基和氨基成为酰胺键的原理,以此偶联载体蛋白。偶联结果采用紫外分光光度计进行测定,扫描结果显示(图3 和图4),BSA 和卵清白蛋白的波峰均在278 nm,安眠酮在264 nm 处有一个波峰,偶联产物的波峰分别在303 nm 和305 nm。偶联产物紫外吸收峰发生偏移可能是半抗原交联到载体蛋白上引起的,说明两种完全抗原均偶联成功。

2.3 安眠酮多克隆抗体的鉴定
兔血清ELISA 测定结果见表1。由表1 可知,制备的安眠酮多克隆抗体可以特异性识别安眠酮,说明多克隆抗体制备成功。
2.4 胶体金最适标记pH 结果
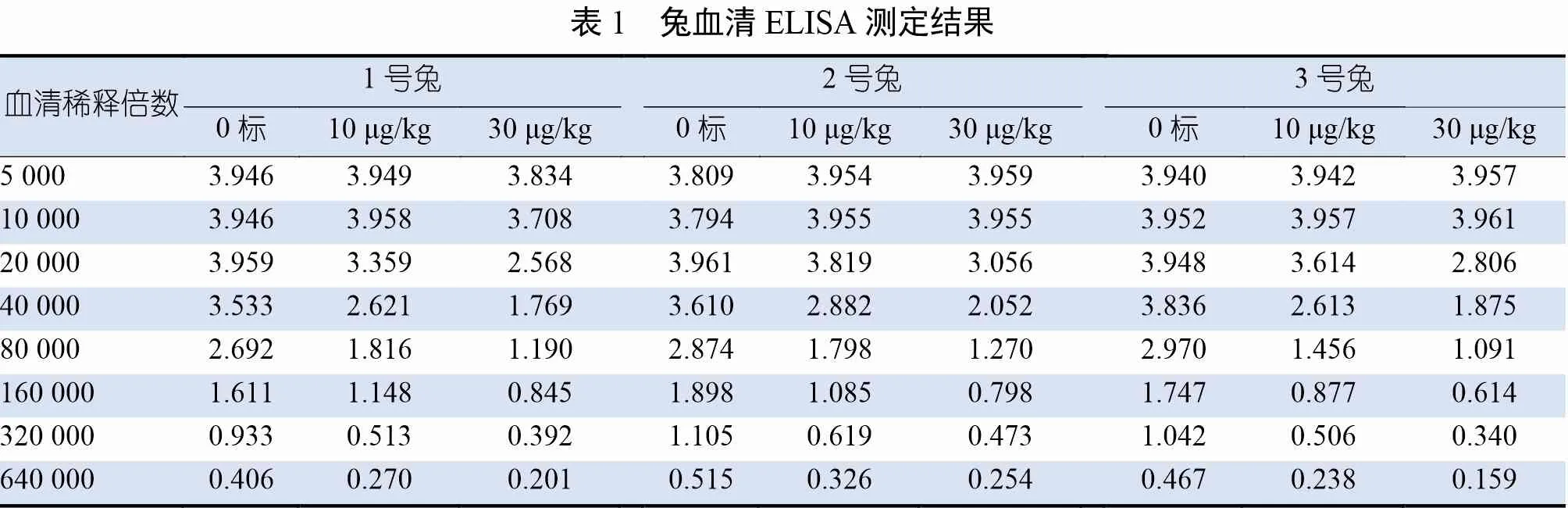

图5 胶体金最适标记pH 结果
胶体金最适标记pH 结果见图5。由图5可知,含2 µL K2CO3的胶体金几乎呈黑色,3 µL 碳酸钾的胶体金呈黑紫色,4 µL K2CO3的胶体金呈酒红色,5 µL K2CO3的胶体金也呈酒红色。说明安眠酮抗体标记调节pH 的K2CO3用量为4 µL。
2.5 胶体金最佳蛋白标记量结果
胶体金最佳蛋白标记量结果见图6。图6 表明,安眠酮抗体标记最佳用量为7.4 µg/mL。
2.6 检测时间分析结果
检测时间分析结果见表2。表2 表明,研制的试纸条检测时间小于5 min。

图6 胶体金最佳蛋白标记量结果

2.7 敏感性试验结果
不同浓度的样本分别与试纸条反应后,观察试纸条显色。由表3 可知,试纸条能够检测出安眠酮的敏感性较高,为30 µg/kg。
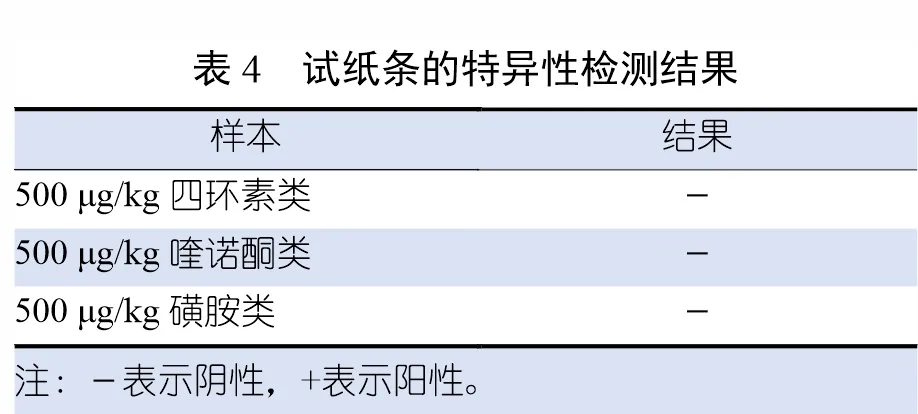
2.8 特异性试验结果
试纸条的特异性检测结果见表4。由表4可知,试纸条检测500 µg/kg 的四环素类、喹诺酮类、磺胺类等药物,结果均为阴性,说明制备出的试纸条能够特异性地与安眠酮结合,与其他小分子药物没有交叉反应,特异性较好。

2.9 准确性试验结果
用检测卡分别检测50 份阴性样本,检测结果如图7 所示,均为阴性,说明假阳性率<5%;用检测卡分别检测50 份阳性样本,检测结果如图7 所示,均为阳性,说明试纸条假阴性率≤0.5%。
2.10 重复性试验结果
同一批次和不同批次的试纸条分别检测每个样本,并重复测定3 次,结果显示检测结果相同,说明试纸条重复性良好。
2.11 稳定性试验结果
试纸条的稳定性检测结果见表5。由表5可知,检测卡在储存温度37 ℃下,一个月内稳定性指标均符合要求,无假阳性或假阴性情况发生,说明试纸条稳定性较好。
3 结论

图7 试纸条的准确性检测结果

本研究成功制备出安眠酮半抗原,使之与牛血清白蛋白/卵清白蛋白偶联,分别得到安眠酮免疫抗原和安眠酮包被抗原,以安眠酮多克隆抗体和安眠酮包被抗原作为主要原料,制备出安眠酮胶体金免疫快速检测试纸条,并对其性能进行了评价,证明该试纸条敏感性较高、特异性较好、准确性较高、重复性良好、稳定性较好,且具有操作方便、快速的优点。因此,本研究开发的安眠酮胶体金免疫快速检测试纸条对动物源性食品中安眠酮残留量的现场快速检测和筛查具有较大的实际意义。

