糖尿病视网膜病变不同分期患者血清δ样蛋白4和环磷腺苷效应元件结合蛋白水平对微血管损伤的预测价值
郭 婧, 李芸云, 刘思思, 沙 颖, 马 凯, 王 红
(首都医科大学附属北京同仁医院, 1. 北京同仁眼科中心, 2. 眼科学与视觉科学北京市重点实验室, 北京, 100730)
糖尿病视网膜病变(DR)是糖尿病患者最常见的眼部并发症之一,也是失明的主要原因之一[1]。随着全球糖尿病患者数量的不断增加,DR所造成的医疗和社会负担也日益加重。DR的发生与发展涉及多种因素,其中微血管损伤是其发病机制的重要环节之一。δ样蛋白4(DLL4)是Notch信号通路中的一个关键成员,在血管生成和维持血管稳态中发挥重要作用。研究[2]表明,在DR患者中, DLL4的表达受到调控,并可能在血管生成紊乱中起到关键作用。高血糖环境下, DLL4的表达可能受到抑制,导致异常的血管新生和血管渗漏,从而加剧视网膜病变的严重程度。环磷腺苷效应元件结合蛋白(CREB)作为转录因子,在细胞增殖、分化和炎症等多种生物学过程中发挥关键作用[3]。在DR中, CREB的激活与炎症反应和细胞凋亡等病理过程密切相关。研究[4]显示,高血糖环境可以通过激活CREB通路来诱导炎症因子的产生,从而引发视网膜病变的发展。
DLL4和CREB作为调控细胞增殖、分化和血管生成的关键因子,在多种疾病中发挥重要作用[5]。然而,在DR中DLL4和CREB的角色及其与微血管损伤的关联尚未得到全面阐明。内皮祖细胞(EPC)、循环内皮细胞(CEC)及循环祖细胞(CPC)作为血管生成和修复关系密切的细胞类型,在人体中,EPC和CPC主要发挥血管修复和再生的功能, CEC则代表着血管内皮细胞已成熟。相关研究[6]发现, DR患者会出现血管异常的生成和损伤,进而诱发EPC和CPC相关功能损伤,导致CEC释放到循环中,造成这些细胞浓度水平改变。本研究探讨不同DR分期患者血清DLL4、CREB水平及其与微血管损伤的潜在关系,现将结果报告如下。
1 资料与方法
1.1 一般资料
经医院伦理委员会审议和批准,选择2020年2月—2023年2月收治的80例糖尿病患者作为研究对象,将所有患者依照DR分期分为无DR组(n=37)、非增生型DR组(n=19)和增生型DR组(n=24)。无DR组男20例,女17例,平均年龄(64.93±5.43)岁,平均体质量(64.39±12.38) kg, 平均体质量指数(BMI)为(22.01±3.84) kg/m2; 非增生型DR组男11例,女8例,平均年龄(64.99±4.94)岁,平均体质量(65.12±12.31) kg, 平均BMI为(22.03±2.98) kg/m2; 增生型DR组男14例,女10例,平均年龄(65.01±4.89)岁,平均体质量(64.98±11.94) kg, 平均BMI为(21.96±3.79) kg/m2。3组受试者一般资料比较,差异无统计学意义(P>0.05), 具有可比性。纳入标准: ① 符合糖尿病治疗指南中相关糖尿病诊断标准者; ② DR分型和诊断符合《我国糖尿病视网膜病变临床诊疗指南(2014年)》[7]者; ③ 患者无精神疾病、免疫性疾病、感染性疾病或心脑血管疾病; ④ 患者依从性良好,可积极配合本研究; ⑤ 患者无青光眼等其他眼部疾病; ⑥ 患者对本研究知情并签署知情同意书。排除标准: ① 妊娠期或哺乳期女性; ② 合并外周或中枢神经疾病史者; ③ 存在DR治疗史者; ④ 入组前半年内参与其他临床试验和研究者; ⑤ 临床资料缺失或主动申请退出本研究者。
1.2 方法
采集受试者空腹静脉血,离心收集血清后采用酶联免疫吸附法检测受试者血中DLL4及CREB水平,所有检测均严格遵照试剂盒说明书进行操作。采集受试者空腹静脉血,采用FACS Count流式细胞仪检测患者EPC、CEC及CPC水平,所用检测抗体均购自CST公司,严格按照流式细胞仪标准操作规程进行操作。
1.3 统计学方法
采用SPSS 20.0统计软件分析数据,计数资料采用百分率表示,组间差异行卡方检验,计量资料采用均值±标准差表示,组间差异行LSD-t检验,多组间计量资料差异采用方差检验分析; 采用Spearman相关性检验分析不同DR分期患者血清DLL4和CREB水平的关系,并采用Logistics回归模型分析DLL4和CREB水平对DR患者病情分期的影响; 采用线性回归模型分析DLL4和CREB水平与微血管评估指标的相关性,以病理检测结果为金标准,绘制受试者工作特征(ROC)曲线,分析DLL4和CREB对微血管损伤的预测价值。P<0.05为差异有统计学意义。
2 结 果
2.1 3组患者DLL4和CREB水平比较
无DR组、非增生型DR组、增生型DR组患者血中DLL4及CREB水平依次递增,其中增生型DR组患者血中DLL4及CREB水平最高,无DR组患者DLL4及CREB水平最低,差异均有统计学意义(P<0.05), 见表1。
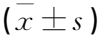
表1 3组患者血中DLL4及CREB水平比较 pg/mL
2.2 不同DR分期与DLL4和CREB水平的关系
DR分期与DLL4、CREB水平均呈显著正相关(r=0.656、0.731,P=0.013、0.005)。
2.3 DLL4和CREB水平对DR患者分期的影响
高DLL4(OR=1.910, 95%CI: 1.311~2.782)、高CREB(OR=2.038, 95%CI: 1.374~3.022)是影响DR患者分期的独立危险因素,差异有统计学意义(P<0.05), 见表2。

表2 DLL4和CREB水平对DR患者分期的影响
2.4 3组患者微血管损伤指标比较
无DR组、非增生型DR组、增生型DR组患者血中EPC、CEC及CPC水平存在差异,其中增生型DR组患者血中EPC、CPC水平最低, CEC水平最高,无DR组EPC、CPC水平最高, CEC水平最低,差异均有统计学意义(P<0.05), 见表3。
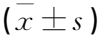
表3 3组患者微血管损伤指标比较 %
2.5 DLL4和CREB水平与微血管评估指标的相关性
患者DLL4及CREB水平与EPC、CPC水平呈显著负相关, DLL4及CREB水平与CEC水平呈显著正相关,见表4、图1。

图1 DLL4和CREB水平与微血管评估指标的相关性

表4 DLL4和CREB水平与微血管评估指标的相关性
2.6 DLL4、CREB对微血管损伤的预测价值
DLL4、CREB预测DR患者微血管损伤的曲线下面积(AUC)均大于0.85, 见表5、图2。

图2 DLL4、CREB预测微血管损伤的ROC曲线

表5 DLL4和CREB对微血管损伤的预测价值
3 讨 论
DR是一种由糖尿病引起的严重眼部并发症,主要影响视网膜血管和组织,可能导致视力损害甚至失明[8]。DR的发生和发展涉及多种因素,包括高血糖、高血压、血脂异常、糖尿病病程等。高血糖是DR发生的主要因素之一,长期的高血糖状态导致视网膜微血管损伤,血管壁通透性增加,易导致渗漏和出血。高血糖还可诱发炎症反应,激活细胞因子、促进生长因子的产生,加速视网膜病变的进展[9]。此外,高血压和血脂异常也与DR密切相关,这些因素进一步损害视网膜的微循环和组织结构。DR的分期评估对于制订个体化的治疗策略和预防措施至关重要[10]。
DLL4是Notch信号通路中的关键成员,属于DSL家族的蛋白质。Notch信号通路在细胞分化、增殖、凋亡等多种生物学过程中发挥着重要作用。DLL4在血管生成、神经发育以及免疫调节等方面具有重要的生理功能[11]。在血管生成过程中, DLL4的主要作用是调控血管内皮细胞的分化和血管分支的形成。在新生血管的末梢, DLL4通过与Notch受体相互作用,抑制附近血管内皮细胞分化为血管平滑肌细胞,从而抑制新血管的扩张和分支。这种抑制机制有助于维持血管的结构完整性和功能稳定性,确保正常的血液循环[12]。CREB是一种转录因子,其在细胞内信号传导和基因表达调控中扮演着重要角色。CREB的活化是通过多种信号通路调控的,其中包括cAMP信号通路、钙信号通路、细胞因子受体通路等。CREB的主要功能之一是参与细胞的生存和适应性反应,在细胞受到外界刺激或内源性信号激活时, CREB被磷酸化,并形成激活态的磷酸化CREB[13]。激活的CREB可以结合到DNA上的cAMP响应元件,从而启动目标基因的转录,进而影响细胞的适应性反应,如细胞增殖、分化和生存等。
DLL4在血管生成和维持血管稳态方面具有重要作用,在糖尿病患者中,由于高血糖状态的存在, DLL4的表达可能受到调节。研究[14]表明,高血糖环境可以降低DLL4的表达,导致异常的血管生成和血管渗漏,加剧视网膜病变的发展。DLL4的过度激活也可能参与了DR的发病机制,进一步加剧了病变的进展。在DR的发展中, DLL4的作用可能涉及多种机制: 首先, DLL4的降低可能导致血管新生不足,造成视网膜缺氧和血管异常; 其次, DLL4的异常激活可能加剧炎症反应,导致炎性因子的过度产生,进而影响视网膜的病理过程[15]。因此, DLL4在DR中既可能是保护因子,也可能是促进因子,其具体作用可能取决于病变的发展阶段和个体的差异。
CREB作为重要的转录因子,在糖尿病环境中, CREB的激活可能涉及多种信号通路,包括cAMP信号通路和炎症通路。研究[16]显示,在糖尿病患者中, CREB的活化与炎症反应密切相关,高血糖状态可以激活CREB, 进而诱导炎性因子的产生和炎症过程的加剧。这些炎症因子可以进一步损伤视网膜微血管,导致视网膜病变的发展, CREB在DR的炎症调节中可能起到重要作用[17]。CREB的激活可能还与视网膜神经损伤有关, DR不仅涉及血管异常,还可能引发视网膜神经元的损伤; CREB在神经细胞的存活和可塑性调节中具有重要作用,因此在视网膜神经损伤的发展中也可能发挥一定的作用[18]。
本研究结果显示,增生型DR组患者血中DLL4及CREB水平最高,无DR组DLL4及CREB水平最低; 相关性检验分析显示, DR患者不同分期与DLL4和CREB水平呈显著正相关; 多因素回归分析表明,糖尿病患者血中高DLL4及高CREB水平是影响DR患者不同分期的独立危险因素。在DR发展过程中,血管生成异常和微循环障碍是重要的病理特征, DLL4在正常情况下能够调控血管生成的平衡,但在高血糖状态下,其表达可能受到调控,导致异常的血管生成和血管渗漏,从而加剧视网膜病变。相关研究[19]发现DR患者体内的CREB水平与内皮生长因子水平呈正相关, CREB活化后参与血管内皮细胞形成,诱导血管内皮细胞通透性增加,在很多的血管屏障破坏的疾病中发挥重要的作用; 因此, CREB也可能通过调节血管内皮细胞的功能而影响微循环的稳定性。此外, DLL4和CREB都参与调节炎症和免疫反应,在糖尿病状态下,炎症因子的产生和免疫系统的活化都会加剧视网膜病变的发展。
微血管损伤情况分析显示,增生型DR组患者血中EPC、CPC水平最低, CEC水平最高,无DR组EPC、CPC水平最高, CEC水平最低; 线性回归模型分析显示,患者DLL4及CREB水平与EPC、CPC水平呈显著负相关, DLL4及CREB水平与CEC水平呈显著正相关; ROC曲线分析表明, DLL4和CREB预测DR患者微血管损伤的AUC均大于0.85。EPC、CEC和CPC是与血管生成和修复相关的细胞类型,在正常情况下, EPC和CPC具有血管修复和再生的潜能,而CEC则是成熟血管内皮细胞的代表。在DR发展过程中,异常的血管生成和损伤可能导致EPC和CPC的功能受损,同时CEC可能被释放到循环中,从而影响这些细胞的水平。DLL4和CREB的异常表达可能在这一过程中发挥作用,通过调节血管生成和修复的平衡,影响EPC、CPC和CEC的水平。
DLL4和CREB的水平与EPC、CPC以及CEC的相关性可能反映了其在微血管损伤中的调节作用。DLL4和CREB的异常表达可能导致血管内皮细胞的损伤和功能改变,从而影响EPC、CPC和CEC的分化和释放。DLL4和CREB在预测DR患者微血管损伤方面具有较高的诊断能力,这可能是因为其在调节血管生成、修复和炎症反应等过程中的多重作用。这些分子的异常表达可能成为DR微血管损伤的早期标志,从而有望在临床实践中作为潜在的生物标志物,有助于及早识别和干预病情。DLL4和CREB不仅参与了血管生成和炎症调节等过程,还可能在微血管损伤方面发挥着关键作用,影响EPC、CPC和CEC的水平。
综上所述,随着DR患者分期增加,血清DLL4和CREB水平呈显著升高趋势,且DLL4和CREB对其微血管损伤具有较高的预测价值。

