Maresin1通过抑制JAK2/STAT3信号通路减轻糖尿病大鼠视网膜神经炎症反应
张博,李凤君,刘学政,左中夫
糖尿病视网膜病变(diabetic retinopathy,DR)主要由血管系统改变和炎症引起[1]。炎症的重要过程之一是细胞的快速迁移[2]。Müller 细胞是视网膜内主要的胶质细胞,其在糖尿病(diabetes mellitus,DM)病理生理过程中能被激活[3]。Müller细胞在DR中被激活的最显著迹象之一是胶质纤维酸性蛋白(glia fibrillary acidic protein,GFAP)表达的增加[4]。Müller 细胞激活能促进炎性因子分泌,引发强烈的内源性炎症级联反应,引起DR的发生和发展[5]。
JAK/STAT 通路参与调节多种生物学效应[6]。JAK/STAT 通路激活能促进炎症,诱导多种反应[7]。研究表明,JAK/STAT 通路在DM 中被激活,其中JAK2/STAT3 亚型是目前研究最广泛和深入的一种[8]。但JAK2/STAT3通路对DR的影响尚不清楚。
Maresin1(MaR1)是从omega-3脂肪酸中提取的一种生物活性分子[9],是一种在炎症缓解过程中活跃的脂质介质,在多种疾病中有抗炎效果。MaR1已被证明可通过对抗淀粉样β蛋白介导的炎症沉积,减缓慢性退行性疾病阿尔茨海默病的进展[10]。但MaR1是否参与DR炎症反应有待探讨。本实验拟探讨MaR1 及JAK2/STAT3通路是否参与DR的形成发展及其可能的机制。
1 材料与方法
1.1 主要试剂与材料
1.1.1 实验动物 SPF级雄性SD大鼠40只,购自锦州医科大学实验动物中心[SCXK(辽)2019-003],体质量180~200 g。将大鼠置于温度22~24 ℃、湿度50%~60%、12 h光/12 h暗循环的环境中,自由食水。实验遵循国家《实验动物管理条例》。
1.1.2 主要试剂与仪器 Maresin1购于Cayman公司;链脲佐菌素(STZ)购于Sigma 公司;JAK2/STAT3 通路激活剂colivelin 购于吉尔生化公司;JAK2、STAT3、p-JAK2、白细胞介素(interleukin,IL)-1 β 抗体购于Abcam 公司;p-STAT3、IL-6、肿瘤坏死因子(tumor necrosis factor,TNF)-α抗体购于Affinity公司;HE染色试剂盒和Western blot 二抗购于Solarbio 公司;SP、DAB 试剂盒购于中杉金桥公司;ELISA 试剂盒购于MLBIO公司;RIPA裂解液、BCA试剂盒购于Beyotime公司;倒置显微镜购于Olympus公司;石蜡切片机购于SLEE公司;水平电泳仪购于BIO-RAD公司。
1.2 方法
1.2.1 DM大鼠模型建立及分组给药 大鼠适应性饲养数天,禁食水12 h,采用腹腔注射STZ(50 mg/kg)制备DM 大鼠模型[11]。3 d 后血糖≥16.7 mmol/L 的大鼠为造模成功,纳入后续研究。入组大鼠随机分为4组,每组10 只:对照组(Con 组)、糖尿病组(DM 组)、Maresin1预处理组(MaR1组)和Maresin1+colivelin组(colivelin 组)。DM 成模后,给与MaR1 组大鼠MaR1(4 ng/g)腹腔注射,2 次/周;Con 组和DM 组给予等量PBS注射[12];colivelin组大鼠在MaR1组给药的基础上,将大鼠麻醉后用微量进样器向玻璃体内一次性注射colivelin 5 μL(10-4μmoL/L)[13]。12周后取材。
1.2.2 标本收集 采用戊巴比妥钠(10 g/L)腹腔注射麻醉大鼠。一部分大鼠用4%多聚甲醛灌流1.5~2 h,取眼球放至固定液中,置于-4 ℃冰箱48 h,将组织转移到蔗糖溶液中脱水后,石蜡包埋,备于HE 和免疫组化染色;一部分大鼠取新鲜视网膜组织进行ELISA 检测和Western blotting检测。
1.2.3 视网膜组织病理形态学检测 采用HE 检测视网膜神经节细胞(retinal ganglion cell,RGC)数量。眼球石蜡切片脱水后苏木素溶液染色5 min,盐酸乙醇分化30 s,伊红染色2 min,流水冲洗5 min,酒精和二甲苯溶液脱水透明,中性树胶封片。
1.2.4 免疫组织化学检测视网膜GFAP蛋白表达 眼球石蜡切片经二甲苯脱蜡、乙醇水合。抗原修复待恢复室温,3%H2O2避光反应10 min。PBS 清洗3 次。滴加山羊血清工作液30 min。用抗GFAP 抗体(1∶300)4 ℃孵育过夜(>18 h)。次日复温1 h,二抗孵育1 h,PBS 清洗,链霉素亲和素孵育1 h。DAB 显色,苏木素复染。酒精和二甲苯溶液脱水透明。中性树胶封片。
1.2.5 ELISA 法测定视网膜组织IL-6、IL-1β和TNF-α含量 向新鲜视网膜中加入RIPA 裂解液,收集上清,于4 ℃、12000 rpm 离心20 min。按照说明书加液后37 ℃水浴60 min。弃去液体,每孔加入A 液B 液混匀后反应15 min。加入终止液,以450 nm波长测OD值。
1.2.6 Western blot检测视网膜组织IL-6、IL-1β、TNF-α、p-JAK2、JAK2、p-STAT3 和STAT3 蛋白表达水平收集上清同ELISA法。BCA试剂盒测定蛋白浓度。电泳、转膜。抗IL-6抗体(1∶1000)、抗IL-1β抗体(1∶2000)、抗TNF-α抗体(1∶1000)、抗p-JAK2抗体(1∶4000)、抗JAK2抗体(1∶5000)、抗p-STAT3 抗体(1∶4000)、抗STAT3 抗体(1∶5000)以及β-actin和GAPDH内参(1∶4000)在4 ℃孵育过夜(>18 h)。次日用TBST洗膜,二抗(1∶5000)室温孵育2 h,ECL显影。用ImageJ软件分析。
1.3 统计学分析
采用SPSS 25.0 软件处理数据。符合正态分布以及方差齐性的计量资料以(±s)表示,多组比较方法采用单因素方差分析;P<0.05为差异有统计学意义。
2 结果
2.1 MaR1改善了糖尿病大鼠视网膜形态
HE染色显示,Con组视网膜平整,RGC密集。DM组RGC 数量明显减少。与DM 组相比,MaR1 组RGC数量增多。colivelin 组较MaR1 组RGC 数量明显减少,见图1。

图1 大鼠视网膜HE染色
2.2 MaR1抑制了糖尿病大鼠视网膜GFAP的表达
免疫组织化学和Western blot 结果显示,DM 组大鼠的视网膜中,Müller 细胞大量被激活,GFAP 表达增多(P<0.01);MaR1 组大鼠视网膜GFAP 表达明显减少(P<0.01);Colivelin 组较MaR1 组GFAP 表达增多(P<0.01),见图2、图3。
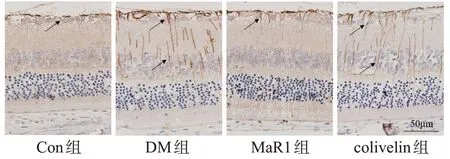
图2 免疫组化检测大鼠视网膜GFAP表达
2.3 MaR1 抑制了糖尿病视大鼠网膜炎症因子IL-6、IL-1β、TNF-α的表达
ELISA和Western blot结果显示DM组IL-6、IL-1β、TNF-α的水平增高(P<0.01);MaR1 组IL-6、IL-1β、TNF-α的表达水平显著下降(P<0.01);与MaR1 组相比,colivelin组IL-6、IL-1β、TNF-α的表达水平上升(P<0.01),见图4、图5。
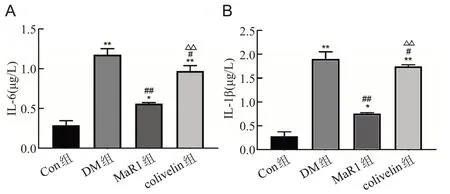
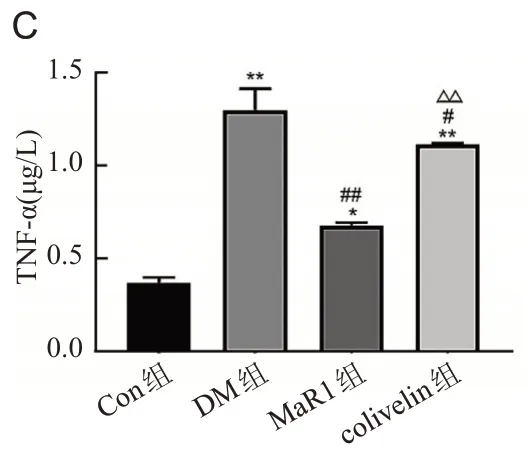
图4 ELISA检测大鼠视网膜组织中IL-6、IL-1β、TNF-α因子的表达
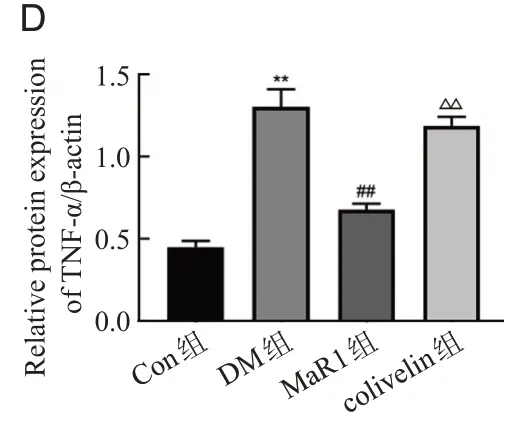
图5 Western blot检测大鼠视网膜组织IL-6、IL-1β、TNF-α的表达水平
2.4 MaR1 抑制了糖尿病大鼠视网膜JAK2/STAT3 通路蛋白表达水平
Western blot 结果显示DM 组JAK2 和STAT3 磷酸化增加,p-JAK2 和p-STAT3 表达上调(P<0.01)。MaR1 治疗12 周后,p-JAK2 和p-STAT3 表达下调(P<0.01)。在MaR1 组基础上给予JAK2/STAT3 通路激活剂colivelin 后,MaR1 的保护作用被逆转(P<0.01)。4组的JAK2、STAT3 总表达无改变。提示DM 大鼠的JAK2/STAT3 通路被激活,磷酸化增加,而MaR1 能有效抑制JAK2和STAT3磷酸化,见图6。

图6 Western blot检测大鼠视网膜组织p-JAK2、JAK2、p-STAT3、STAT3的表达水平
3 讨论
近年来研究发现Müller 细胞参与了DR 的发病机制,被认为是神经血管功能障碍的一种形式[14,15]。炎症激活Müller 细胞并破坏组织稳态。在DR 的持续过程中,Müller 细胞中炎性细胞因子的产生和消除之间的微妙平衡被破坏,导致细胞损伤和疾病恶化[16]。在DR中,RGC 数量减少,同时GFAP 上调,视网膜神经胶质反应性增强,促进炎症细胞因子IL-6、IL-1β和TNF-α的产生。MaR1 在DM 大鼠模型中抑制Müller 细胞炎症反应。因此,控制炎症反应可能对DM 患者预防或减轻视网膜损伤起到重要作用。
MaR1 是由巨噬细胞通过人12-脂氧合酶从二十二碳六烯酸中产生,具有强大的促分解和组织稳态作用[17]。文献报道促分解介质可以减轻DM 的疾病变化,包括炎症[18]。研究表明,MaR1 具有强大的抗炎和促解毒活性,包括抑制Müller 细胞的活化[19]。视网膜神经胶质细胞的激活与缺血、神经损伤、炎性因子等视网膜疾病引起的神经元损伤有关。此外,我们的研究发现MaR1 显著改善节细胞排列紊乱,抑制STZ 诱导的Müller细胞激活和炎症反应,并有助于DR的治疗。
炎症是Müller细胞激活和胶质细胞增生的首要反应,释放的大量因子如IL-6、IL-1β和TNF-α等,引起炎症反应[3]。在DR 中,我们发现MaR1 可以降低GFAP的上调。但是MaR1 和JAK2/STAT3 通路激活剂colivelin 联合用药后,与MaR1 组相比,神经胶质细胞GFAP升高。免疫组化发现MaR1组较DM组的GFAP表达降低,而colivelin组较MaR1 组的GFAP 表达水平增加,所以MaR1可能是通过降低DR的Müller细胞激活减轻炎症。Müller 细胞是IL-1β产生的关键来源。神经胶质细胞对IL-1β极其敏感,并在这种促炎细胞因子的作用下迅速发展为细胞死亡。除了IL-1β,Müller细胞还产生其他促炎细胞因子如TNF-α和IL-6[20]。本研究以MaR1 处理DR 大鼠,降低了视网膜组织中IL-6、IL-1 β 和TNF-α 蛋白表达。然而,以MaR1 和JAK2/STAT3 通路激活剂colivelin 联合处理DR 大鼠,可增强IL-6、IL-1β和TNF-α炎症因子的释放,表明MaR1 抑制DR 大鼠炎症反应,是下调JAK2/STAT3 通路的因素。
JAK2/STAT3 信号通路的激活作为炎症中的一个重要信号,可促进神经胶质细胞的活化,在啮齿动物DR模型的进展中发挥关键作用[21]。但目前MaR1通过JAK2/STAT3 信号通路对DR 保护作用的影响尚未报道。本实验表明,DR 中p-JAK2 和p-STAT3 表达上调。在MaR1 治疗后,p-JAK2 和p-STAT3 表达下调。MaR1 和通路激活剂colivelin 联合干预后,p-JAK2 和p-STAT3蛋白表达较MaR1组明显下调,说明MaR1可能通过抑制JAK2 和STAT3 的磷酸化,下调JAK2/STAT3通路活性。
综上所述,本研究证实MaR1可抑制JAK2/STAT3信号通路的激活,减少GFAP和促炎因子的表达,有助于减轻DM 大鼠的视网膜损伤。MaR1 可能有助于减轻DM炎症的进展,是缓解DR的一种潜在新方法。

