miR-206、miR-125、miR-21 在乳腺癌新辅助化疗疗效和预后评估中的价值
高建朝 王思思 张志生 张京力 李晓霞 马 科 冯志林 周海丰 王展海
(1.河北北方学院附属第一医院乳腺外科,河北 张家口 075000;2.河北北方学院附属第一医院妇产科,河北 张家口 075000;3.河北北方学院附属第一医院检验科,河北 张家口 075000)
乳腺癌是女性常见的恶性肿瘤之一,其发病率呈逐年升高趋势[1]。新辅助化疗是指对无远隔转移的乳腺癌患者在手术治疗前,以系统性化疗作为治疗的第1步,可有效减轻术前肿瘤负担,提高手术成功率,或变不可保乳为可保乳,变不能手术为能手术,即病理完全缓解(pathological complete response,pCR)[2-3]。有研究结果显示,非pCR者无法从新辅助化疗中获益,且可能延误手术时机,导致预后不良[4]。因此,寻找特异性标志物,早期预测乳腺癌新辅助化疗疗效及其预后具有重要意义。微小RNA(microRNA,miRNA)是肿瘤领域的研究热点,其表达水平可对多种肿瘤细胞生物学行为产生影响,可作为临床诊断和预后评估的标志物[5]。有研究结果显示,乳腺癌患者miR-206、miR-125、miR-21表达均明显异常[6-7],但是否可作为评估新辅助化疗疗效和患者预后的指标尚需进一步研究。为此,本研究拟探讨miR-206、miR-125、miR-21在新辅助化疗疗效和患者预后评估中的价值。
1 材料和方法
1.1 研究对象
选取2021年7月—2022年7月在河北北方学院附属第一医院诊断并接受新辅助化疗的乳腺癌患者82例(乳腺癌组),均为女性,年龄36~58岁。纳入标准:1)符合《中国抗癌协会乳腺癌诊治指南与规范(2017年版)》[8]中乳腺癌诊断标准;2)初治,且无远隔转移;3)未接受过化疗和内分泌治疗,可完成治疗和随访;4)患者及其家属均知情同意。选取同期河北北方学院附属第一医院健康体检者40名作为正常对照组,均为女性,年龄29~55岁。纳入标准:1)全身体检结果正常;2)知情同意。排除标准:合并内分泌系统疾病、原发性血液系统疾病,处于妊娠期或哺乳期。本研究经河北北方学院附属第一医院伦理委员会批准(202012067)
1.2 方法
1.2.1 临床资料和样本收集
收集所有对象的临床资料,包括年龄、性别、体重指数、月经情况、肿瘤数量、肿瘤直径、临床分期、病理分级、Ki-67表达情况。采集乳腺癌患者新辅助化疗前和正常对照者体检当日的空腹静脉血3 mL,1 096×g离心5 min,分离血清,保存待测。
1.2.2 血清miR-206、miR-125、miR-21检测
采用TRIzol试剂(美国ThermoFisher Scientific公司)提取总RNA,将RNA用反转录试剂盒(湖北艾普蒂生物工程有限公司)逆转录成cDNA,以cDNA为模版进行聚合酶链反应(polymerase chain reaction,PCR)扩增。ALLin-One miRNA qPCR Kit试剂盒购自广州复能基因有限公司,检测仪器为ProFlex PCR仪(美国ThermoFisher Scientific公司)。引物由南京金斯瑞生物科技有限公司设计合成。U6上游引物为5'-TGCGGGTGCTCGCTICGCAGC-5',下游引物为5'-CCAGTGCAGGGTCCGAGGT-3';miR-206上游引物为 5'-TGGAATGTAAGGAAGTG-3',下游引物为5'-CAGTGCGTGTCGTGGAGT-3';miR-125上游引物为5'-GGGTCCCTGAGACCCTAACTTGT-3',下游引物为5'-GCTGTCAACATACGC-TACGTA-3';miR-21上游引物为5'-ACACTCCAGCTGGGTAGCTTATCAGACTGA-3',下游引物为5'-GTGTCGTGGAGTCGGCAATTC-3'。以U6为内参,采用2-ΔΔCt法计算miR-206、miR-125、miR-21相对表达量。
1.2.3 新辅助化疗方案
采用TAC方案(多西紫杉醇75 mg/m2,多柔比星50 mg/m2,环磷酰胺500 mg/m2)进行新辅助化疗。以3周为1个周期,共6个周期。参考实体瘤疗效评估标准[9],将疗效分为完全缓解、部分缓解、稳定、进展。以完全缓解+部分缓解为化疗有效,以稳定+进展为化疗无效。
1.2.4 随访
通过微信或电话方式对所有患者随访1年,随访终点事件为全因死亡。
1.3 统计学方法
采用SPSS 22.0软件进行统计分析。计量资料采用Bartlett方差齐性检验和Kolmogorov-Smirnov正态性检验确认数据是否呈正态分布。呈正态分布的计量资料以±s表示,2个组之间比较采用t检验。计数资料以例或率表示,组间比较采用χ2检验。等级资料采用Ridit检验。采用Logistic回归分析评估乳腺癌患者新辅助化疗疗效的影响因素。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估各项指标判断新辅助化疗疗效的效能。采用Kaplan-Meier生存曲线评估乳腺癌患者的生存情况。采用Cox回归分析评估影响乳腺癌患者生存率的危险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌组和正常对照组血清miR-206、miR-125、miR-21相对表达量比较
乳腺癌组血清miR-206、miR-125相对表达量低于正常对照组(P<0.001),血清miR-21水平高于正常对照组(P<0.001)。见表1。

表1 乳腺癌组和正常对照组血清miR-206、miR-125、miR-21相对表达量比较
2.2 新辅助化疗不同疗效的乳腺癌患者临床病理资料比较
82例乳腺癌患者新辅助化疗结束后,19例完全缓解,38例部分缓解,22例稳定,3例进展。化疗有效57例,化疗无效25例。化疗无效组与化疗有效组之间肿瘤直径、临床分期、病理分级和血清miR-206、miR-125、miR-21相对表达量差异均有统计学意义(P<0.05),其他指标2个组之间差异均无统计学意义(P>0.05)。见表2。
2.3 乳腺癌患者新辅助化疗疗效的多因素Logistic回归分析
以化疗疗效(化疗有效=0,化疗无效=1)作为因变量,将差异有统计学意义的项目作为自变量,进行多因素Logistic回归分析。结果显示,校正肿瘤直径、临床分期、病理分级后,血清miR-206、miR-125低表达和miR-21高表达是乳腺癌患者化疗无效的独立危险因素[比值比(odds ratio,OR)值分别为0.438、0.432、4.512,95%可信区间(confidence interval,CI)分别为0.232~0.826、0.257~0.725、2.886~7.054,P<0.05]。见表3。

表3 乳腺癌患者新辅助化疗疗效多因素Logistic回归分析
2.4 血清miR-206、miR-125、miR-21对新辅助化疗疗效的预测价值
采用Logistic回归分析建立联合检测方程:Logit(P)=0.384 42-0.577 09×miR-206-0.514 14×miR-125+0.250 89×miR-21。ROC曲线分析结果显示,miR-206、miR-125、miR-21单项和联合检测判断化疗无效的曲线下面积(area under curve,AUC)分别为0.795、0.761、0.782、0.899。见图1、表4。
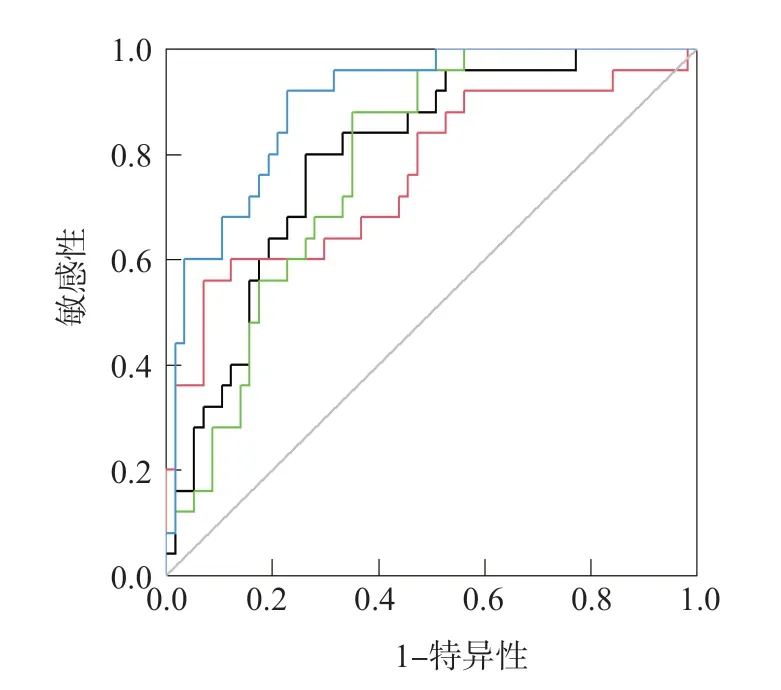
图1 血清miR-206、miR-125、miR-21单项和联合检测判断化疗无效的ROC曲线

表4 血清miR-206、miR-125、miR-21新辅助化疗疗效预测价值
2.5 不同预后乳腺癌患者各项指标比较
82例乳腺癌患者化疗后随访1年,有61例生存(生存组),21例死亡(死亡组)。生存组与死亡组临床分期、病理分级和血清miR-206、miR-125、miR-21相对表达量差异均有统计学意义(P<0.05);其他指标2个组之间差异均无统计学意义(P>0.05)。见表5。
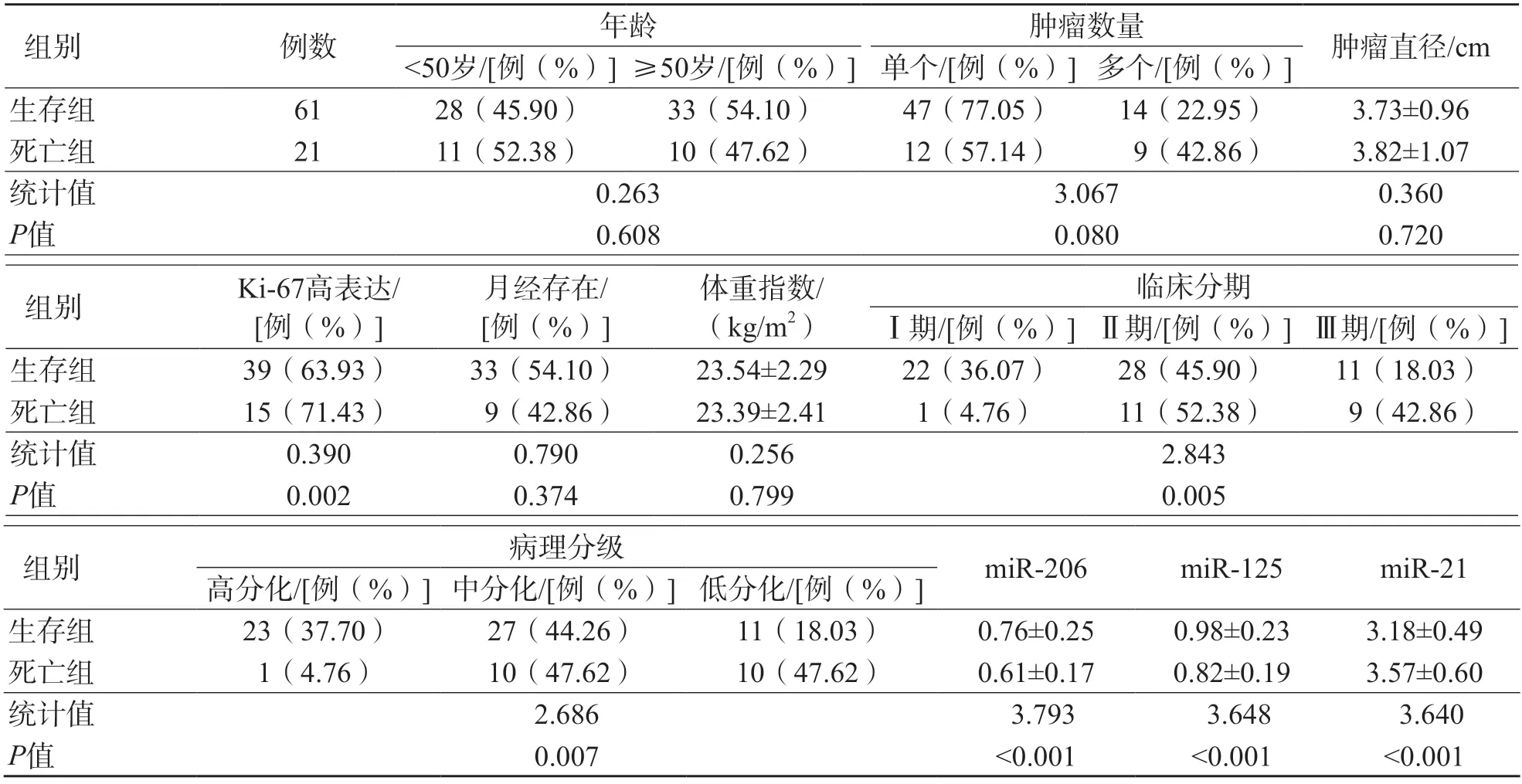
表5 死亡组和生存组各项指标比较
2.6 血清miR-206、miR-125、miR-21判断乳腺癌患者1年死亡的效能
采用Logistic回归分析建立联合检测方程:Logit(P)=0.267 71-0.500 13×miR-206-0.477 99×miR-125+0.243 86×miR-21。ROC曲线分析结果显示,血清miR-206、miR-125、miR-21单项检测和联合检测判断乳腺癌患者1年死亡的AUC分别为0.757、0.698、0.676、0.838。见图2、表6。
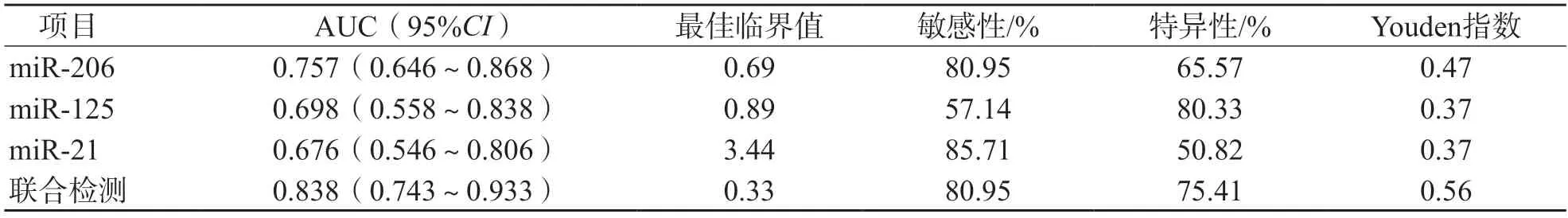
表6 血清miR-206、miR-125、miR-21判断乳腺癌患者1年死亡的效能
2.7 不同血清miR-206、miR-125、miR-21相对表达量的乳腺癌患者1年生存率比较
根据ROC曲线得出的最佳临界值将所有乳腺癌患者分为低表达(<最佳临界值)组和高表达组(≥最佳临界值)。Kaplan-Meier生存曲线分析结果显示,miR-206高表达组、miR-125高表达组1年生存率分别高于血清miR-206低表达组和miR-125低表达组(P<0.05),miR-21低表达组1年生存率高于miR-21高表达组(P<0.05)。见图3。

图3 不同miR-206、miR-125、miR-21相对表达量乳腺癌患者的Kaplan-Meier生存曲线
2.8 乳腺癌患者1年死亡的危险因素分析
以预后作为应变量(生存=0,死亡=1),以血清miR-206、miR-125、miR-21相对表达量作为自变量(<均值赋值为1,≥均值赋值为2),进行Cox回归分析。结果显示,校正临床分期、病理分级后,血清miR-206、miR-125低表达和miR-21高表达均为乳腺癌患者1年死亡的独立危险因素[风险比(hazard ratio,HR)分别为0.438、0.437、4.240,95%CI分别为0.253~0.758、0.271~0.706、2.624~6.852,P<0.05]。见表7。
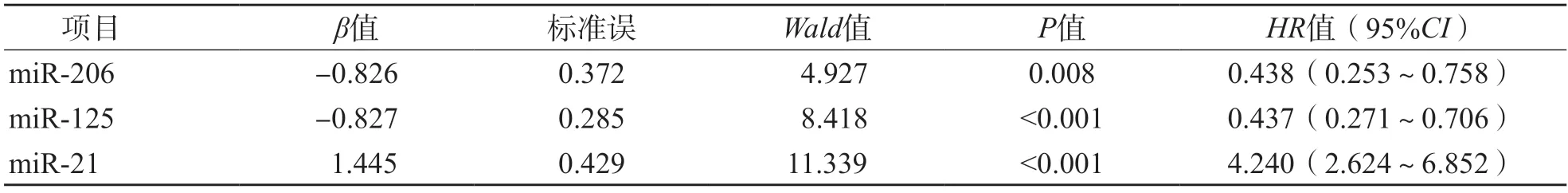
表7 乳腺癌患者1年死亡的危险因素分析
3 讨论
新辅助化疗是乳腺癌治疗的重要组成部分。乳腺癌患者采用新辅助化疗治疗达pCR后,其远期预后较好[10],但仍有<5%的患者新辅助化疗过程中会出现进展,甚至丧失手术机会[11]。故寻找可有效预测乳腺癌新辅助化疗疗效的生物标志物,指导个体化治疗具有重大意义。
miRNA是一类短链非编码RNA,通过介导靶基因mRNA降解,参与细胞分化、增殖、凋亡等,在多种恶性肿瘤中发挥重要作用,影响其生物学行为和耐药的发生[12]。miR-206定位在6号染色体,可参与多种肿瘤细胞的增殖、凋亡、侵袭、转移等生物学行为[13]。覃舒婷等[7]的研究结果显示,乳腺癌患者癌组织miR-206呈低表达,与雌激素受体呈负相关(r=-0.274,P<0.05),且无病生存期明显缩短。有研究结果显示,乳腺癌患者miR-206表达与临床特征密切相关,有望成为评估内分泌治疗敏感性的指标[7,14]。本研究发现,乳腺癌患者血清miR-206相对表达量显著降低,miR-206可能参与了乳腺癌的发生、发展,与文献报道[7,14]一致;血清miR-206低表达是化疗无效(OR=0.438,95%CI为0.232~0.826)和1年死亡(HR=0.438,95%CI为0.253~0.758)的独立危险因素。有研究结果显示,细胞周期阻滞可有效增强化疗药物对肿瘤细胞的敏感性[14-15]。细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)4是一类丝/苏氨酸激酶,通过结合细胞周期素D,促进细胞由G1期向S期转换,其过表达参与乳腺癌、卵巢癌、肺癌等多种恶性肿瘤发生、发展[16]。CDK4是miR-206直接作用的靶标,miR-206或可通过作用于细胞周期关键因子CDK4,抑制乳腺癌细胞生长,并有效提高化疗药物敏感性,改善患者预后,但确切机制仍有待进一步探讨。
miR-125包括miR-125a(染色体19q13)与miR-125b(染色体21q21.1和11q24.1),参与细胞代谢、增殖、凋亡等多过程。有研究结果显示,乳腺癌患者癌组织和肿瘤细胞中miR-125均呈低表达,且与恶性生物学行为密切相关[17-18]。本研究结果显示,乳腺癌患者血清miR-125相对表达量显著降低,提示miR-125可能起抑癌基因的作用;另外,miR-125低表达还是化疗无效(OR=0.432,95%CI为0.257~0.725)和1年死亡(HR=0.437,95%CI为0.271~0.706)的独立危险因素。miR-125是原癌基因ETSI的直接靶点,其可通过调控ETSI抑制细胞增殖,将细胞周期阻滞在G1期,进而抑制肿瘤[19]。细胞周期阻滞具有一定的化疗增敏作用,这可能是miR-125高表达患者在接受新辅助化疗更易达到化疗有效且预后更好的重要因素。也有研究结果显示,miR-125b可通过调节乳腺癌干细胞中的侧群细胞,诱导化疗耐药表型[20]。目前,miR-125在乳腺癌耐药,尤其是新辅助化疗耐药中的具体机制尚不明确,还需对此深入研究。
miR-21是目前研究较多、与恶性肿瘤关系密切的miRNA之一。miR-21在乳腺癌、肝癌、肺癌、胃癌等多种实体瘤中表达上调[21],提示miR-21发挥着致癌作用,其靶基因是抑癌基因。有研究结果表明,miR-21作为一个促癌miRNA,其表达与乳腺癌患者淋巴结转移、病理分期、增殖指数等密切相关[22]。但关于miR-21在乳腺癌新辅助化疗疗效及预后中的价值目前还鲜有研究。本研究结果显示,miR-21高表达可作为乳腺癌新辅助化疗无效(OR=4.512,95%CI为2.886~7.054)及1年死亡(HR=4.240,95%CI为2.624~6.852)的独立危险因素。但miR-21参与化疗抵抗的具体机制仍有待进一步研究。
本研究ROC曲线分析结果显示,血清miR-206、miR-125、miR-21联合检测判断乳腺癌患者新辅助化疗无效和1年死亡的AUC分别为0.899、0.838,具有较高的诊断效能,可为乳腺癌患者新辅助化疗疗效的判断和预后评估提供更有效的量化参考依据。
综上所述,乳腺癌患者血清miR-206、miR-125、miR-21表达均异常,可作为患者接受新辅助化疗疗效和预后的预测指标。

