NCF2/p67phox在泛肿瘤中的表达调控及临床意义研究进展
谢金波,彭 波
(1.皖南医学院第一附属医院(皖南医学院弋矶山医院)泌尿外科,安徽 芜湖 241001; 2.同济大学附属第十人民医院泌尿外科,上海 200072)
活性氧类(reactive oxygen species,ROS)物质是机体常见的有氧代谢副产物,主要包括超氧阴离子、羟基自由基和H2O2等,不仅参与细胞损伤和病原体清除,在细胞和组织中也作为信号分子激活细胞内特定信号通路调控生物学过程,同时在肿瘤发生、发展及耐药等方面还起重要作用[1-2]。还原型烟酰腺嘌呤二核苷酸磷酸(nicotinamide adenine dinu-cleotide phosphate,NADPH)氧化酶催化细胞内的O2还原为ROS,是细胞内源性ROS的主要来源[3-4]。近年来,多项研究报道NCF2/p67phox作为NADPH氧化酶复合物的活化亚基,通过NADPH氧化酶/ROS通路,参与肿瘤发生、发展。本文全面梳理近几十年来NCF2/p67phox在肿瘤中的研究进展,为后续研究提供参考。
1 NCF2/p67phox基本信息
嗜中性粒细胞胞质因子2(neutrophil cytosolic factor 2,NCF2)又名NOXA2(NADPH oxidase activator 2)和p67phox,是一种典型的无糖基化修饰的细胞质蛋白,相对分子质量为67 000,由526个氨基酸残基构成,其中包含氨基端肽重复序列结构域(tetratricopeptide repeat,TPP)、高度保守的活化域(activation domain,DA),次保守的PB1(phox and bem 1)结构域和羧基端Src同源结构域3(Src homology 3,SH3)等4个特征性结构域[2],其三维构象见图1。人类NCF2/p67phox编码基因位于染色体1q25,长度为34 845 bp,尚未见报道该基因存在任何剪切变异体[2]。有学者在对102个不同种族背景个体的基因组测序信息分析后发现,亚洲人群中的NCF2/p67phox表现出以差异化的单倍型结构为特征的多样性模式[5]。
2 NCF2/p67phox的表达调控
NCF2/p67phox一度被认为只存在于吞噬细胞,近几十年研究者们陆续发现其在非吞噬细胞也广泛表达,目前在多种哺乳动物的吞噬细胞[6-7]、B淋巴细胞[8]、肾小球系膜细胞[9]、内皮细胞[10]、神经元[11]、星形胶质细胞[11]和肝脏星状细胞[12]等正常在体细胞中检测到NCF2/p67phox表达。Lindsey等[13]发现在吞噬细胞中HoxA10通过招募HDAC结合至NCF2启动子抑制其转录,这种抑制作用既依赖于HDAC活性也受到细胞因子诱导的HoxA10酪氨酸磷酸化水平的调控。在此基础上Lindsey等[14]提出SHP2突变能协同HoxA10起作用,抑制包括NCF2在内的骨髓特异性基因转录,进而阻碍骨髓细胞分化。Li等[15]进一步证实在未分化的骨髓细胞系中NCF2启动子活性需要骨髓特异性和非骨髓转录因子的合作来维持,包括Sp1/Sp3、PU.1、PU.1/HAF1和AP-1,其中AP-1的作用最为关键。Kautz等[16]研究发现SHP1蛋白酪氨酸磷酸酶通过减少PU.1、IRF1、ICSBP及CBP等与NCF2基因的相互作用,在未分化的骨髓细胞中抑制NCF2/p67phox表达,且IRF1和ICSBP酪氨酸残基对NCF2的转录相对更重要。2005年,Gauss等[17]在NCF2启动子区鉴定出一段全新的增强子应答区,该应答区对TNF-α诱导的NCF2/p67phox表达上调至关重要,紧随其后的一项研究[18]则证实PLAGL2正是通过结合到NCF2启动子TNF-α应答区调控其转录进程。上述对NCF2表达调控的研究主要围绕启动子和转录调控。研究者们还发现NCF2是经典抑癌基因p53的靶基因,经过该通路能实现p53的促进细胞存活作用,该研究结果一经公布受到多位学者认同[19-21]。
除内源性调控外,研究者们也探索了外源性药物对NCF2的表达调控作用:Liu等[22]证实在软骨细胞中苏拉明上调NOX2/p67phox表达可以促进NADPH氧化酶活化于胞内并产生ROS。ROS带来氧化应激的增强抑制PTEN作用从而激活PI3K/AKT通路,通过上调下游SOX9/COL2A/ACAN的表达最终维持软骨细胞表型。此外,NCF2/p67phox对其他分子也具有调控作用,Datta等[23]发现NOX2/p67phox和真核起始因子2(eukaryotic Initia-tion Factor 2,eIF2)的结合能保护eIF2免于被下游激酶磷酸化,而eIF2是翻译起始的必需蛋白之一。
3 NCF2/p67phox是NADPH氧化酶关键活化亚基之一
目前证实NADPH氧化酶的核心催化亚基gp91phox/NOX2至少还有6种同源物(NOX1、NOX3、NOX4、NOX5、DUOX1和DUOX2),被称为NOX蛋白家族[24]。以NOX2为催化核心的NADPH氧化酶最早被关注,研究较为深入。通常认为由胞膜上的NOX2/gp91phox和p22phox形成的异源二聚体是NADPH氧化酶催化亚基,但NADPH氧化酶要发挥生物催化作用,还需来自细胞质中的多个调节亚基配合。巨噬细胞中NADPH氧化酶复合物示意图见图2,其中NCF2/p67phox是NADPH氧化酶的两个重要活化亚基之一[2,25]。关于NOX2激活事件的一般观点是p47phox磷酸化导致p47phox-p67phox复合物转位到细胞质膜,在质膜上p47phox与p22phox相互作用,随后p67phox通过直接的蛋白间互作对NADPH氧化酶发挥活化作用[26-28]。Tlili等[29]发现NADPH氧化酶复合物一旦组装完成,NCF2/p67phox在该复合物中稳定存在并持续发挥作用。更有研究证实NCF2/p67phox结合到细胞指定位置和NADPH氧化酶获得生物活性都离不开p67phox羧基端的SH3结构域[28]。
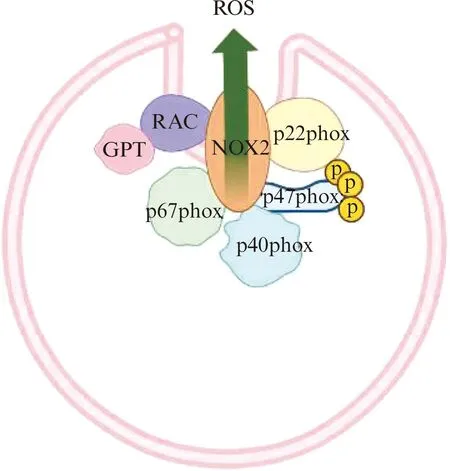
图2 巨噬细胞中NADPH氧化酶复合物示意图
4 NCF2/p67phox通过NADPH氧化酶参与肿瘤多种生物学行为调控
NADPH氧化酶及其调节亚基在多种类型、不同恶性阶段的肿瘤细胞中表达异常,提示NADPH参与肿瘤发生及进展的多个环节[30-32]。
4.1 肿瘤发生
ROS在DNA损伤中的作用已受到广泛认同。报道称细胞暴露于慢性氧化应激可引起基因组不稳定[33-34],且有证据显示上述不稳定的基因克隆体中ROS水平明显增加[35-36]。尽管NADPH氧化酶在上述过程中的确切作用不清楚,一些研究结果还是极具启发性。Gregg等[37]发现NADPH氧化酶NOX蛋白家族中的NOX4在伴有VHL缺陷的人肾细胞癌(renal cell carcinoma,RCC)发生中至关重要,且利用基因技术沉默NOX4能减少RCC细胞内ROS产生,防止HIF-2α在细胞核内积累以及自然插入VHL。上述NOX4沉默的效果能用超氧化物清除剂、TEMPOL、MnSOD或氢氧化酶模拟实现,表明ROS是NOX4调节HIF-2α的关键介质。Shimizu等[38]发现人食管鳞状细胞癌细胞中的NOX2通过B细胞易位基因2(B-cell translocation gene 2,BTG2)相关信号通路影响肿瘤发生。另一项有关NOX2的研究发现夹竹桃麻素(Apocynin)作为NADPH氧化酶抑制剂,通过凝集素和MEK-ERK1/2通路调控细胞增殖,可减少TRAP大鼠模型中的ROS产生同时抑制前列腺癌发生[39]。相信随着研究的深入,NADPH氧化酶/ROS在更多肿瘤发生中的作用将被揭示。
4.2 肿瘤血管新生
血管生成(angiogenesis)是指从已有的血管形成新的血管,参与各项生理过程如胚胎发育和伤口修复,以及病理过程如缺血性心肌病、肿瘤、糖尿病性视网膜病变或者包括动脉粥样硬化在内的慢性炎症等[40]。多项证据显示胞内NADPH氧化酶催化产生的ROS通过VEGF信号通路对肿瘤血管生成起重要作用。Arbiser等[41]证实NOX1诱导的H2O2增加VEGF及其受体表达,增强基质金属蛋白酶(matrix metalloproteinase,MMP)活性,进而促进肿瘤血管再生和肿瘤进展。一项膀胱癌的研究[42]发现ALKBH3通过NOX2-ROS和Tweak/Fn14/VEGF信号影响血管再生和肿瘤侵袭。另有两项研究[43-44]表明,由rac1依赖的NADPH氧化酶催化产生的ROS参与了血管内皮生长因子(VEGF)和血管紧张素-1(Ang-1)介导的内皮迁移。
4.3 肿瘤侵袭转移
目前尚未发现依赖于NADPH氧化酶的ROS生成与上皮间充质转化(epithelial-mesenchymal transition,EMT)、肿瘤细胞侵袭、迁移直接相关,但其参与了细胞骨架重塑、外渗、肿瘤转移等相关基因的调控[45]。例如激活NADPH氧化酶和产生ROS是诱导二聚糖基因(参与细胞黏附和迁移)和TGF-β诱导的细胞骨架重排所必需[46-47]。另外,血管黏附分子1(VCAM-1)可能诱导NADPH氧化酶依赖的ROS生成,激活内皮细胞的MMP,使得淋巴细胞外渗[48]。值得注意的是,Rac GTPase是细胞侵袭和迁移的重要介质之一[49],也是NADPH氧化酶依赖的ROS生成的上游信号酶[50]。Van der Weyden等[51]的一项动物实验似乎间接支持NOX2影响肿瘤转移过程,因为使用基因编辑技术剔除对NOX2发挥催化功能所必需的任何亚基后的小鼠,接受静脉注射肿瘤细胞后显示肿瘤肺转移灶减少。更早的一项研究[52]也证实Cybb-/-小鼠在切除黑色素瘤原发灶后,肿瘤血行转移发生率显著降低。无论如何,NADPH氧化酶对肿瘤侵袭转移影响还有待于进一步验证。
5 NCF2/p67phox在泛肿瘤的临床预后作用
NCF2/p67phox作为NADPH氧化酶的活化亚基,对肿瘤生物学表型和临床预后的作用,来自分子生物学、肿瘤免疫学和临床医学等领域的研究者们都在不断探索,关注的范围涵盖实体肿瘤和起源于血液系统的非实体肿瘤,笔者利用“cancer”“tumor”和“carcinoma”等联合“NCF2”“p67phox”和“NOXA2”等关键词,检索并复习相关文献后,对NCF2/p67phox在泛肿瘤中的特征和临床预后作用研究进展总结见表1。

表1 NCF2/p67phox在泛肿瘤中的表达特征及作用
5.1 泌尿及男性生殖系统肿瘤
相比其他泌尿生殖系统肿瘤,NCF2/p67phox在RCC的作用研究较为深入。Chalbatani等[53]基于GEO数据库,从环状RNA入手,利用生物信息分析手段构建RCC中的竞争性内源RNA(competing endogenous RNAs,ceRNA)调控网络,发现NCF2/p67phox等8个关键基因的表达与肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)的免疫浸润和患者生存正相关。类似地,来自国内的一个研究团队也发现NCF1/2/4与ccRCC的免疫浸润相关,是潜在的临床预后靶标[54]。另一项来自国内的研究[55]则是结合蛋白组学和磷酸化修饰组学分析大量肾细胞癌临床样本,提出肿瘤中NCF2/p67phox磷酸化水平上调是RCC患者潜在预后靶标。Tan等[56]利用检测大量肾癌和正常肾组织中的炎症相关性基因表达水平,发现NCF2/p67phox等基因表达上调的患者伴随更高的死亡风险。
NCF2/p67phox在其他泌尿系肿瘤的研究也有报道。有研究[57]显示前列腺癌瘤体中趋化因子的表达和NCF2/p67phox等相关,而趋化因子可以诱导CD8+效应T细胞在癌组织聚集,通常认为CD8+T细胞是机体消灭肿瘤细胞的“天生武器”,这种特征是否具有特殊的生物学意义暂时还不得而知。Huang等[58]研究发现PI3K/AKT信号介导TGIF诱导NOX2/p67phox活化,细胞内ROS含量增加,激活PI3K/AKT信号促进尿路上皮癌的侵袭迁移。睾丸癌相关的一项研究显示以铂类为基础的睾丸癌化疗患者伴随NCF2等关键基因的DNA甲基化修饰水平变化,但这种表观遗传改变的意义还有待深入讨论[59]。
5.2 其他实体瘤
Tian等[60]发现外周血白细胞中包括NCF2在内的5种免疫相关基因的DNA甲基化修饰水平与乳腺癌发病风险相关。另一项在韩国女性中的研究利用大样本做了与乳腺癌发病风险相关的基因多态性分析,发现NCF2基因多态性与乳腺癌发病风险相关性并不显著[61]。Lomnytska等[62]观察宫颈鳞状细胞癌从上皮内瘤变演变为侵袭性肿瘤的动态过程中NCF2等基因表达的变化,提出NCF2等基因可作为宫颈鳞癌诊断和预后生物标志物。Fletcher等[63]检测子宫正常肌层和子宫肌瘤瘤体中的NCF2/p67phox等表达后,发现NCF2/p67phox在子宫肌瘤中表达上调,对子宫肌瘤具有潜在的临床诊断价值。一项研究联合分析GEO和TCGA数据库后发现包括NCF2在内的10个基因可介导恶性胶质瘤的放疗耐受,可能成为恶性胶质瘤患者放疗相应人群的筛选标志物[64]。Ji等[65-66]连续发表2项研究,从不同角度建立以NCF2等为风险因子的预测模型,比较后发现该模型对恶性胶质瘤的预后预测效果优于传统利用分子病理指标构建的模型,是潜在的放疗效果预测工具。Chen等[67]在全面分析恶性黑色素瘤样本中突变基因表达谱和患者临床病理特征关系后,提出NCF2等8种基因突变可作为免疫检查点阻断治疗有效性的预测指标,为恶性黑色素免疫治疗提供了筛选适应人群的新方法。Huang等[68]在关于肝细胞癌的研究中发现NCF2/p67phox表达上调伴随更多的M2型巨噬细胞浸润和预后不良。另一项研究[69]则是分析肝细胞癌相关的基因共表达网络后构建出NCF2等12个风险基因组成的肝癌诊断及预后预测模型。Osama等[70]发现包括NCF2在内的5种基因过表达对结肠癌具有潜在诊断价值。Yang等[71]发现MHC-I相关的NCF2等基因单核苷酸多态性可以作为非小细胞肺癌的生存预测标志物。Ma等[72]发现姜黄素在舌癌中的作用是通过NCF2等节点基因传递信号,最终抑制舌癌细胞的增殖、迁移。
5.3 血液系统肿瘤
一项急性粒细胞白血病相关的研究显示NADPH氧化酶的各亚基表达上调是急性粒细胞白血病化疗效果的评价标志物[73]。Kikuchi等[74]发现姜黄素在淋巴瘤患者的使用可以上调NCF2/p67phox等表达,代表患者免疫水平增强,可能是判断治疗是否起效的标志物。
6 展 望
NCF2/p67phox不仅在人体多种正常细胞中广泛表达,在泌尿生殖系统、消化系统、血液系统及其他多种肿瘤组织存在基因多态性、异常表达或者NDA甲基化修饰改变等,见表1。目前对NCF2/p67phox调控机制的大多集中于转录调控水平,随着表观遗传学理论的完善和相关技术进步,从转录后和蛋白修饰水平研究NCF2/p67phox的调控机制将有助于更完整解释其在不同细胞或肿瘤组织的表达特异性。
通过文献复习,本文总结NCF2/p67phox在各种肿瘤中以“促癌”作用为主,目前大多数研究关注NCF2/p67phox表达与临床预后的关系,NCF2/p67phox“促癌”效应的分子机制研究不够深入。NADPH氧化酶及其催化产生的胞内ROS在肿瘤中的作用长期以来是研究者们的关注焦点,但胞内ROS作为信号分子参与肿瘤生物学调控的机制仍有待阐明。作为NADPH氧化酶复合物中活化亚基,NCF2/p67phox对NADPH氧化酶发挥催化功能至关重要,但NCF2/p67phox在肿瘤中通过触发NADPH氧化酶/ROS通路发挥间接调控作用以外,是否其他更直接的分子调控机制,需要更多的研究来证实。总之,对NCF2/p67phox的深入研究,极可能为肿瘤生物学机制研究提供新思路。

