RA滑膜成纤维样细胞外泌体促进巨噬细胞向M1极化
虞珊珊,李 静,徐 臻,成 宇,宗 明,范列英
(同济大学附属东方医院检验科,上海 200120)
类风湿关节炎(rheumatoid arthritis,RA)是一种以慢性增生性滑膜炎、侵蚀性关节炎为主要表现的自身免疫病,我国大陆地区的RA患病率约为0.28%[1]。其特征性病理变化为关节滑膜炎症细胞浸润、滑膜成纤维细胞(fibroblast-like synoviocytes,FLS)异常增生、血管翳形成,病变的滑膜组织分泌大量炎性细胞因子及酶类侵蚀关节软骨和软骨下骨质,造成关节不可逆性破坏、畸形和功能丧失[2]。FLS在介导RA的直接组织损伤和疾病的持续发展中发挥着至关重要的作用[3],可分泌IL-6、粒细胞-巨噬细胞集落刺激因子(GM-CSF)等细胞因子[4-6],影响微环境中其他免疫细胞如单核细胞[7]。单核细胞在关节局部活化为巨噬细胞(macrophage,Mø)后通常分为经典活化型(M1)和替代活化型(M2a、M2b)。M1具有很强的吞噬免疫清除功能,可分泌TNF-α、IL-1、IL-6、IL-12等参与促炎及抗原呈递。M2a可分泌TGF-β、VEGF、制瘤素等发挥抗炎、促进伤口愈合和组织修复功能。M2b则分泌大量IL-10和少量IL-12,发挥免疫抑制、控制炎症反应的作用。目前通常认为在RA关节滑膜组织中存在M1过度激活,同时M2数量和功能不足,是滑膜炎难愈的主要因素[8],其具体机制仍未完全明确。

1 材料与方法
1.1 一般资料
滑膜组织取自2020年6月—2022年10月于同济大学附属东方医院风湿免疫科就诊的RA患者关节镜手术切除和常规病理检查后剩余的滑膜组织。PBMC从健康志愿者全血中分离,研究经同济大学附属东方医院医学伦理委员会批准(伦理批准号:No.2020 tjdx),且均取得患者的知情同意。
1.2 试剂与仪器
RPMI 1640培养液购自美国Corning公司;胎牛血清、青霉素、链霉素混合液购自美国Gibco公司;M-CSF购自美国Sigma公司;无外泌体血清购自美国SBI公司;聚丙烯离心管、超速离心机购自美国Beckman公司;透射电子显微镜购自日本日立公司;纳米颗粒跟踪分析仪来自普迈生物科技有限公司;CD9、CD63抗体购自美国Abcam公司;实时荧光定量PCR仪来自ABI公司;电泳仪购自美国Bio-Rad公司;RIPA裂解液、BCA试剂、抗体稀释液购自碧云天生物技术有限公司;TRIzol试剂购自Invitrogen公司;miRNA反转录试剂盒购自广州锐博生物技术有限公司;正置荧光显微镜购自Leica公司;流式微珠阵列(CBA)流式术检测IL-2、IL-4、IL-5、IL-10、IL-12P70、INF-γ、INF-α、TNF-α、IL-17、IL-1β、IL-6和IL-8共12项炎症因子试剂盒购自杭州赛基生物科技有限公司。
1.3 方法
1.3.1 CBA法检测细胞因子 收集RA和OA关节液或细胞培养上清液,1 000×g,离心20 min,转移上清液至新的离心管。使用细胞因子检测试剂盒按照说明书操作,于流式细胞仪器上检测并分析结果。
1.3.2 免疫组织化学法染色 将滑膜组织样本制成石蜡切片,将切片脱蜡脱水。用3%H2O2室温孵育10 min以清除内源性过氧化物酶。加20%山羊血清室温封闭1 h后,加一抗(CD9)4 ℃过夜,加入相应二抗室温孵1 h,加DAB显色。显微镜下观察切片,阳性部位呈棕褐色,细胞核呈蓝色。

1.3.4 FLS上清液外泌体提取和分析 FLS以2×105/mL的密度接种于10 cm培养皿中置于5%CO2、37 ℃培养箱过夜培养,更换为含10%无外泌体血清1640培养液,置于培养箱继续培养48 h;收集细胞培养上清液于50 mL离心管中,4 ℃,300×g离心10 min,以去除悬浮细胞,转移上清液至新的离心管;4 ℃,2 000×g离心10 min,以去除死细胞,转移上清液至新的离心管;4 ℃,10 000×g离心30 min,进一步离心去除细胞碎片;使用天平称重法绝对配平后放入超高速离心机,100 000×g,4 ℃离心60 min;小心去除上清液,加入无菌PBS清洗离心获得的外泌体,100 000×g,4 ℃离心60 min;小心去除上清液,加入无菌PBS于冰上溶解外泌体。
1.3.6 Western印迹法 在外泌体中加入等体积细胞裂解液,使用移液器吹打数次,于冰上裂解10 min,14 000×g离心10 min。上清液液中的蛋白质样品立即收集,BCA法测定蛋白浓度。取30 μg总蛋白用10% SDS-PAGE胶分离后转移到PVDF膜。在含5%脱脂奶粉的PBS封闭2 h后,使用一抗稀释液稀释一抗(CD9、CD63)4 ℃下孵育过夜,随后使用辣根过氧化物酶标记的二抗孵育,洗涤后滴加ECL化学发光液,于化学发光成像系统中扫描。
1.3.7 PBMC分离 采用EDAT抗凝管收集健康志愿者血液,使用等体积PBS对比稀释。稀释后的全血缓慢加入淋巴细胞分离液上层,于室温400×g,离心30 min。小心吸取中间云雾层单个核细胞层细胞(PBMC),加入配制好的红细胞裂解液5 mL,轻轻吹打混匀静置5 min,室温300×g离心5 min。弃上清液,用3 mL的PBS洗涤液重悬细胞,室温300×g离心5 min。重复洗涤1次,弃上清液,加入完全1640培养液重悬PBMC。
1.3.8 Mø诱导 PBMC以每孔2×104个接种于24孔板中,加入100 ng/mL C-MSF,放入5%CO2、37 ℃培养箱中培养6 d,隔天更换新的培养液并补充100 ng/mL C-MSF,细胞完全贴壁,即Mø,用于后续的实验。
1.3.9 RT-PCR检测 外泌体刺激Mø 48 h后,抽提RNA并反转录为cDNA。反应条件为:95 ℃,30 s,95 ℃,5 s,60 ℃,34 s,40个循环,熔解曲线分析:95 ℃,15 s;60 ℃,1 min;95 ℃,15 s。结果处理:每个检测均作3个复孔,计算复孔Ct值的平均值,ΔCt表示目的基因相对表达拷贝数(ΔCt=目的基因Ct值-内参基因Ct值),计算2-ΔΔCt表示实验组目的基因的表达相对于正常对照组目的基因变化倍数。引物序列见表1。
1.4 统计学处理
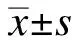
2 结 果
2.1 关节滑膜液中细胞因子表达情况
收集6例RA及6例OA患者关节滑液标本,通过CBA法检测滑液中IL-2、IL-4、IL-5、IL-6、IL-8、IL-1β、IL-17、IL-10、IFN-α、TNF-α、IL-12P70、IFN-γ共12种细胞因子表达情况。结果显示,RA患者关节液中M1型炎性细胞因子IL-1β(P<0.05)、IL-6(P<0.001)、IL-8(P<0.05)及M2型炎性细胞因子IL-10(P<0.05)水平均显著高于OA患者,IL-2、IL-4、IL-5、IL-17、IFN-α、TNF-α、IL-12P70、IFN-γ在两组中均含量较低,差异无统计学意义,见图1。

图1 CBA法检测RA、OA关节液中细胞因子的含量
2.2 RA和OA滑膜组织CD9表达情况
免疫组织化学染色法检测6例RA和6例OA患者关节滑膜组织外泌体标志物CD9的表达,结果显示RA组滑膜中CD9分子明显高表达,见图2。

图2 免疫组化检测RA和OA滑膜组织CD9表达情况
2.3 外泌体鉴定
分离培养滑膜原代RA-FLS和OA-FLS,并收集细胞培养上清液,通过多次离心去除死细胞、细胞碎片及大囊泡后,经超速离心法获得外泌体。Western印迹法和NTA方法鉴定外泌体;Western印迹法结果显示,外泌体特异性表面标志物CD9、CD63均可被检测到,见图3A。NTA结果检测显示外泌体直径大小集中在100 nm左右,见图3B,RA-FLS提取的外泌体浓度显著高于OA-FLS(P<0.05),见图3C。
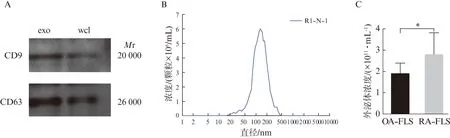
图3 外泌体鉴定
2.4 RA-FLS外泌体对Mø极化的影响
使用OA-FLS和RA-FLS来源外泌体刺激Mø,通过RT-PCR和CBA法检测Mø极化分子mRNA和细胞因子水平。结果显示,相比于OA-FLS外泌体,RA-FLS外泌体刺激Mø后,M1极化标志物TNF-α、CCR-7、NOS-2 mRNA均明显上调表达(P<0.05),而M2a极化标志物TGF-β mRNA明显下调表达(P<0.05),M2b极化标志物IL-10 mRNA表达明显上调(P<0.05)。在细胞因子水平,RA-FLS外泌体明显促进Mø分泌IL-6(P<0.001)、TNF-α(P<0.05)、IL-8(P<0.05)分泌,但对IL-10(P>0.05)分泌无影响,其他细胞因子无分泌,见图4B。上述结果表明,RA-FLS所产生的外泌体主要促进M1极化,对M2的无显著影响。

图4 RA-FLS外泌体对Mø极化的影响
3 讨 论
Mø在组织局部受到不同刺激后分化为M1和M2,在RA的发病和慢性持续炎症进展中起着重要作用。本研究发现,在RA患者关节液中存在明显高水平的包括IL-1β、IL-6、IL-8在内的M1型细胞因子,同时M2型细胞因子IL-10水平也显著高于OA组。外泌体在细胞和组织之间广泛表达,并在细胞与细胞间相互作用及基因调控中发挥作用,与Mø极化密切相关[17]。通过免疫组织化学法发现,在RA滑膜中外泌体标志物CD9显著高表达,提示RA关节滑膜局部可能存在较高浓度外泌体。RA-FLS是RA滑膜的关键组成细胞,分离培养原代RA-FLS,并提取其上清液外泌体,通过粒径分析及Western印迹法检测颗粒大小以及其表面特异的蛋白标志物CD9和CD63,证实采用超速离心法可有效分离RA-FLS细胞上清液外泌体。
以往对RA-FLS外泌体进行的研究发现,通过改变RA-FLS外泌体中miR-486-5p含量,可调节Tob1/BMP/Smad信号通路促进成骨,在RA的治疗中具有一定前景[18]。本研究发现,相较于OA-FLS,RA-FLS分泌的外泌体浓度更高,采用人外周血单个核细胞诱导的Mø进行体外实验,证实RA-FLS外泌体具有更强的诱导Mø向M1分化的功能,进一步揭示了RA-FLS在RA发病及滑膜慢性炎症中的作用,其下游信号通路有待进一步研究。以往研究表明,外泌体中包裹大量miRNA,并可通过外泌体在细胞间转运并在功能上影响Mø表型[17,19-20]。例如,脂肪来源的外泌体中高表达miR-34a,靶向Kruppel样因子4(KLF4)抑制巨噬细胞向M2极化,促进肥胖诱导的脂肪炎症[21]。在肾损伤研究中发现,肾小管上皮细胞来源外泌体中miRNA-19b-3p显著高表达,通过负调控细胞因子信号抑制因子-1(SOCS1),并进一步活化NF-κB,促进巨噬细胞向M1极化,最终导致肾损伤的发生[22]。肠癌细胞来源的外泌体miR-934通过下调PTEN表达和激活PI3K/AKT信号通路诱导M2极化并促进肠癌肝转移[23]。M1和M2具有截然不同的典型表型和功能,但微环境发生改变时Mø极化也可发生可逆性转变[24]。通过调节Mø极化来改善RA滑膜炎症,有望成为新的免疫治疗目标[25]。因此,分析RA-FLS与OA-FLS来源外泌体中差异表达miRNA,探究在M1/M2极化起到关键作用的miRNA分子及其下游信号通路,将是课题组进一步研究重点。
综上,本研究发现RA关节液中M1和M2型细胞因子高表达,滑膜中外泌体标志物CD9表达增高;RA-FLS外泌体分泌能力明显强于OA-FLS,并促进Mø向M1极化。深入研究RA-FLS外泌体中对M1极化起关键作用miRNA及其下游机制,使用药理学或遗传学抑制该关键miRNA的功能可能是一种有前景的治疗RA的方法。

