基于网络药理学和分子对接研究蒙药额尔敦-乌日勒对帕金森病的作用机制*
李晓锋,林玉凤,张雅蓓,陈向辉,赵 蕊,朱 伟,谢雅彬,谢 伟,巴德仁贵,姜树原,8,刘晓蕾,8,邵 国,9,白海花,贾小娥,杨志甫
(1.内蒙古科技大学包头医学院,内蒙古 包头 014040;2.包头医学院第一附属医院神经内科;3.包头医学院神经科学研究所;4.内蒙古自治区低氧转化医学重点实验室;5.濮阳油田总医院急诊科;6.包头医学院基础医学与法医学院;7.包头医学院公共卫生学院;8.包头医学院药学院;9.深圳市龙岗区第三人民医院;10.内蒙古民族大学附属医院基因检测中心)
帕金森病(Parkinson’s disease,PD)又称为震颤麻痹,是一种常见的神经系统变性疾病,临床上特征表现为静止性震颤、运动迟缓、肌强直及姿势步态异常,病理特征是黑质多巴胺能神经元缺失和路易小体形成;目前具体病因不详,可能与环境、遗传、氧化应激、线粒体功能缺陷、免疫、炎症和年龄等均有一定关系[1]。PD具有不可逆性和一定的致残性,严重影响患者学习能力和日常生活,对家庭和社会造成极大的负担。多巴胺能药物是目前临床上治疗PD的常用药物,但长期使用可能会出现药效下降、剂末现象、开-关现象和异动症等并发症。因此探索更加有效、长久和安全的治疗方法,提升患者生活质量是当前研究的热点问题。
民族医药有着悠久的使用历史,具有多靶点、增效减毒等效果,和多巴胺能药物等联合使用可能为更有效、安全地治疗PD提供新的方案。蒙药额尔敦-乌日勒寓意“珍贵神奇的药丸”,是蒙医药历史上的瑰宝之一,主要由珍珠、牛黄、犀角、桅子、肉桂、决明子、檀香、沉香、木香、红花、丁香、川谏子、甘草、黑种草子、肉豆寇、草果、土木香和诃子等29味天然药材配合组成[2-3],是蒙医治疗“白脉病”(即神经系统疾病)的传统验方[4-5],但其具体作用机制尚未完全清楚。
现代医学研究中,初拉等[6]通过不同化学萃取的方法检出16种与神经相关的成分。近年来对蒙药额尔敦-乌日勒的基础研究发现其发挥神经保护作用的机制主要包括促进神经营养因子分泌、调控神经相关基因表达,抑制炎症因子、抗凋亡、抗氧化等方面。但其治疗PD的具体作用机制及靶点研究尚少。网络药理学是基于系统生物学理论,从药物、靶点与疾病间相互作用的整体性和系统性出发,通过采用复杂生物网络模型,揭示药物、基因、靶点、疾病之间复杂的整体生物网络关系,在此基础上分析、预测药物的药理学作用机制[7]。中药方剂成分多,化学成分复杂,作用机制的研究较为困难。网络药理学的出现为中药的机制探究提供了新的方法,为中药寻找治疗靶点,并可能在分析中发现药物新的治疗作用,极大地促进了中医中药的发展。本研究利用网络药理学和分子对接的方法筛选蒙药额尔敦-乌日勒治疗缓解PD的有关活性成分及可能靶点,进一步发现其潜在的作用机制,为后续实验验证和临床应用提供有力的理论依据。
1 资料与方法
1.1蒙药额尔敦-乌日勒活性成分及靶点的收集 通过中药系统药理学分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)(https://old.tcmsp-e.com/index.php)及相关文献收集蒙药额尔敦-乌日勒主要药物的化学成分,以口服利用度(oral bioavailability,OB)阈值≥30%和化合物的类药性(drug-likeness,DL)阈值≥0.18为依据进行筛选,并通过TCMSP平台筛选出蒙药额尔敦-乌日勒的活性成分的作用靶点,通过UniProt数据库把相关靶点基因转化为“Homo sapiens”的标准基因名称,用软件Cytoscape 3.9.1绘制药物活性成分-靶点图。
1.2药物活性成分与PD的共同靶点 在人类基因-疾病相关的数据库(GeneCards)(hppp://www.genecards.org/)、人类基因和遗传紊乱的数据库(Online Mendelian Inheritance in Man,OMIM)(http://www.omim.org)和治疗目标TTD数据库(http://db.idrblab.net/ttd/),以“Parkinson’s disease”为检索词进行检索,获取PD疾病靶点,删除重复靶点,用微生信在线(https://www.bioinformatics.com.cn/static/others/jvenn/example.html)将蒙药额尔敦-乌日勒活性成分相关靶点和疾病靶点进行匹配映射,绘制韦恩图(Venn),以获得蒙药额尔敦-乌日勒活性成分治疗PD的潜在作用靶点。
1.3共同靶点的蛋白互作(protein-protein interaction,PPI)网络构建 String平台(http://string-db.org/Version 10.5)是蛋白质之间相互作用的数据库,可搜索已知蛋白之间和预测蛋白质之间相互作用。将蒙药额尔敦-乌日勒和PD共同靶点输入到String数据库,将研究物种选择为人类(“Homo sapiens”),设置置信度,标准为confidence>0.4,并勾选show your query protein names和Experiments,绘制蛋白互作图,并将String中下载的.tsv文件用Cytoscape 3.9.1进行处理,将蛋白互作图进行可视化分析,根据度值(degree)绘制网络图,得到前200个PPI核心基因靶点。
1.4基因本体(gene ontology,GO)、京都基因和基因百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)功能富集分析 将1.3获得的200个核心基因靶点应用DAVID数据库(https://david.ncifcrf.gov)及微生信平台(www.bioinformatics.com.cn)进行GO和KEGG富集分析,将前20个结果进行可视化。
1.5药物活性成分-靶点蛋白分子对接 先利用Cytoscape 3.9.1软件对蒙药额尔敦-乌日勒中的有效活性成分进行筛选,得到度值最高的5种小分子化合物,分别为槲皮素、山奈酚、β-谷甾醇、豆甾醇和木樨草素,然后在TCMSP数据库中下载小分子的mol.2格式文件。在Autodock1.5.7上对其进行加氢和旋转键设置后导出为pdbqt格式文件。选取预测靶点度值前5位的靶点蛋白,然后在PDB数据库(http://www.rcsb.org/)及相关文献中查找合适的靶点蛋白的pdb文件,运用pymol及Autodock1.5.7分别进行去除水和溶剂分子、配体、加氢操作后导出为pdbqt文件。在Autodock1.5.7中运行AutoGrid和AutoDock后,获得pdbqt格式的对接结果文件及对接能大小等信息。最后在Pymol软件上对对接结果进行可视化处理,并将其对接能绘制成热图。
2 结果
2.1蒙药额尔敦-乌日勒的活性成分及预测靶点 通过TCMSP平台以OB≥30%和DL≥0.18为依据,筛选蒙药额尔敦-乌日勒主要成分(荜茇、丁香、诃子、川楝子、栀子、红花、肉豆蔻、决明子、草果、木香、降香、沉香、海金沙、人工牛黄)的活性成分。筛选后各成分以中文名字的首字母进行命名,其主要化学成分命名为首字母加数字,如荜茇的部分活性成分命名为BIBA1、BIBA2等,其中各药物的重复化学成分共有13种,分别命名为A1、B1、C1、D1、E1、F1、F2、F3、F4、F5、L1、N1、O1,并继续在此平台上筛选出每种药物活性成分的靶点,通过筛选共获得260个预测靶点(图1),蒙药额尔敦-乌日勒207个作用靶点与PD有关。蒙药额尔敦-乌日勒的同一活性成分可以作用于不同的靶点,同一靶点又可以受不同的活性成分作用,体现了蒙药额尔敦-乌日勒治疗PD的多成分、多靶点的特点。
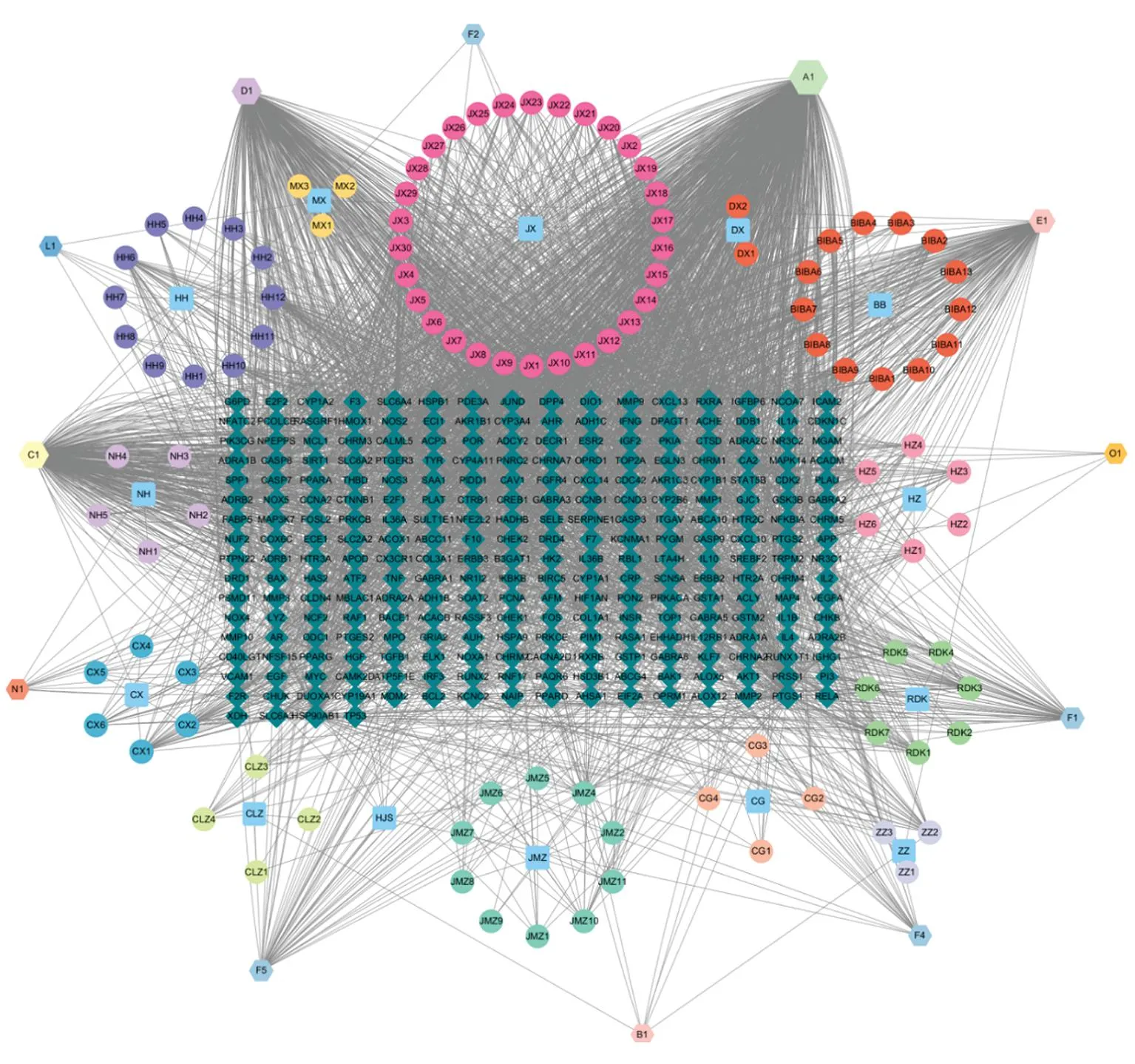
图1 蒙药额尔敦-乌日勒的活性成分及预测靶点:其中青色正方形为蒙药额尔敦-乌日勒的主要成分,环绕药物周围的圆形为其主要化合物成分,五边形代表不同中药里含有的共同化合物成分,菱形为活性成分对应的靶点
2.2药物活性成分与PD的共同靶点 在GeneCards、OMIM和TTD数据库以“Parkinson’s disease”进行检索,获取PD疾病靶点,整合到一起,删除重复靶点,得到PD的靶点9 908个。用微生信在线(https://www.bioinformatics.com.cn/static/others/jvenn/example.html)软件将蒙药额尔敦-乌日勒活性成分相关的260个靶点和9 908个疾病靶点进行匹配映射,绘制Venn图,获得蒙药额尔敦-乌日勒的活性成分的潜在治疗PD的作用靶点共207个(图2)。
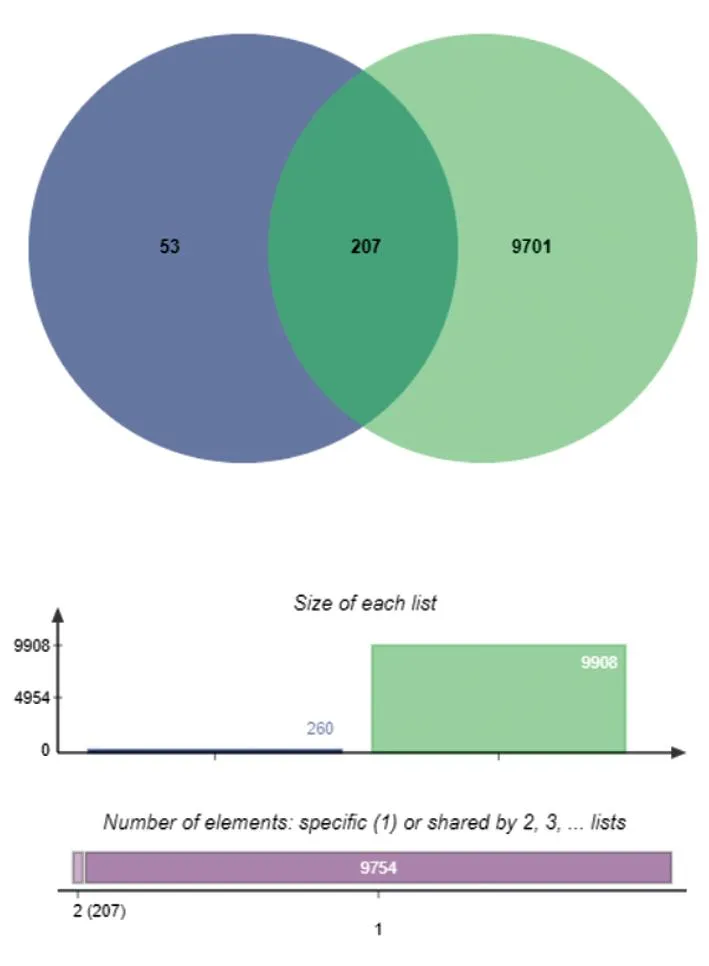
图2 Venn图
2.3PPI网络构建与分析 将2.2获得的蒙药额尔敦-乌日勒活性成分的潜在治疗PD作用的207个靶点,输入到String数据库(https://www.string-db.org/),获得蒙药额尔敦-乌日勒与PD的PPI网络,图中阶段之间的连线表示两者之间存在相互作用,颜色不同则相互作用类型不同,连线越多则作用越密切。节点数为206,边数为2 522,平均节点度为24.5,平均局部聚类系数为0.556(图3A)。将图String中下载的.tsv文件用软件Cytoscape 3.9.1将PPI图网络分析图进行可视化分析,根据度值制圆形,通过圆形的大小及颜色深浅可更直观地看出各节点所链接节点数的多少,圆形越大,颜色越深则该节点在网络中的作用越关键,得到前200个PPI核心基因靶点,其中关联度值最高的前5个节点依次为AKT1、TP53、TNF、VEGFA、CASP3(图3B),表明了这些基因可能是蒙药额尔敦-乌日勒治疗PD的潜在靶点。
2.4GO、KEGG功能富集分析 应用Metascape数据库(http://metascape.org)和微生信平台(www.bioinformatics.com.cn)对获得的靶点进行GO、KEGG富集分析。GO富集分析结果表明,蒙药额尔敦-乌日勒治疗PD的作用机制主要涉及RNA聚合酶启动子转录的正调控、正调控DNA模板转录和正调控基因表达等生物过程(图4)。绘制KEGG富集气泡图,横坐标为基因比例(gene ratio),纵坐标为化合物分子发挥功能的通路,气泡大小表示富集的显著性(即Pvalue的数值大小),Pvalue越小越接近红色,富集程度越高。KEGG富集分析结果表明,共富集到1 021条通路。根据度值筛选到20条关键通路,其中与治疗PD相关的包括与脂质动脉硬化、IL-17信号通路、P13K-Akt信号通路、MAPK信号通路等(图5)。以上结果表示,蒙药额尔敦-乌日勒通过多通路协同作用治疗PD。
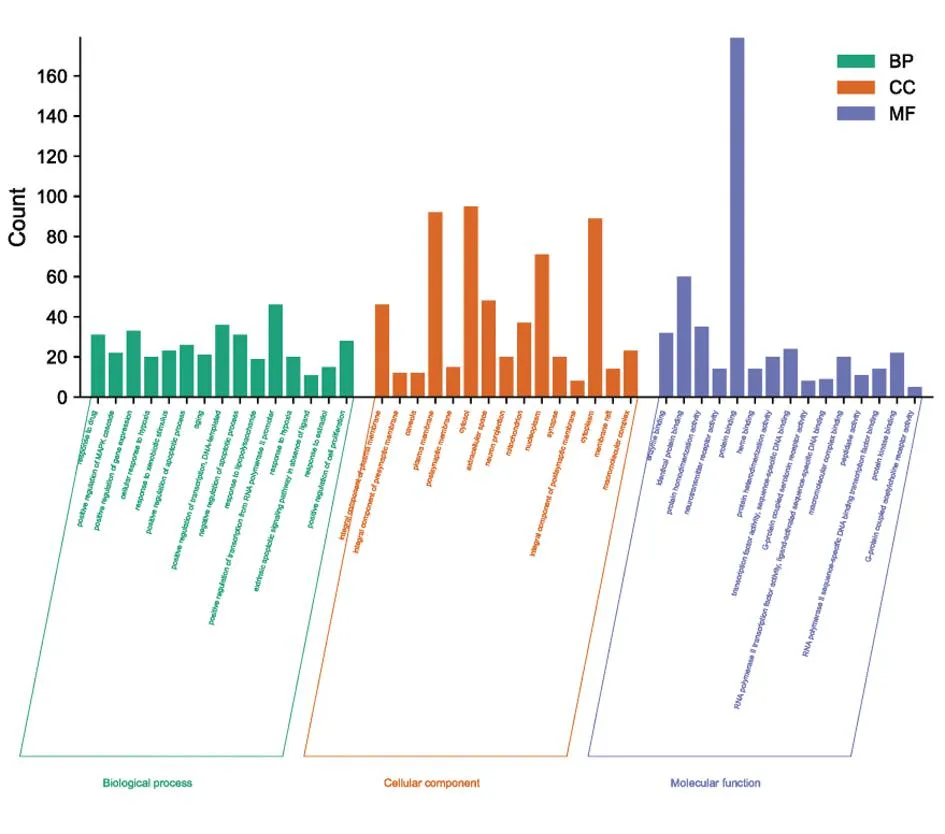
图4 GO富集分析
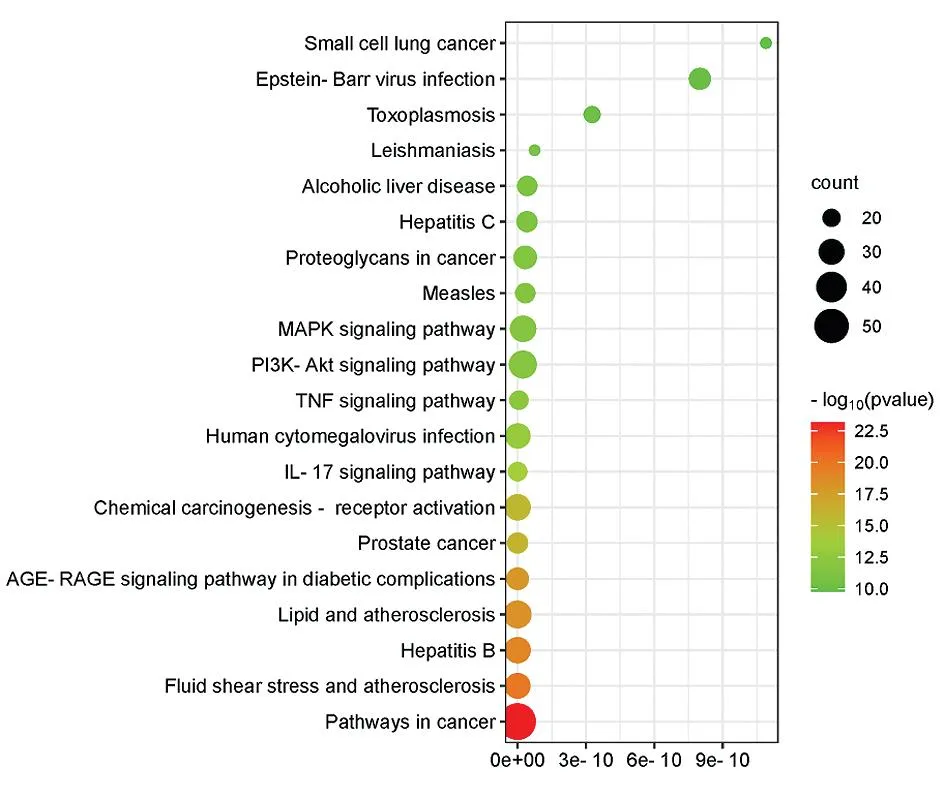
图5 KEGG气泡图:蒙药额尔敦-乌日勒治疗PD相关的通路
2.5分子对接 将蒙药额尔敦-乌日勒中度值最高的5种化合物槲皮素、山奈酚、β-谷甾醇、豆甾醇和木樨草素和靶点蛋白中度值最高的前5位靶点蛋白分子AKT1(3o96)、TP53(1gzh)、TNF(5uui)、VEGFA(1mkk)、CASP3(1nms)分别进行分子对接,获得其结合能的大小,将其绘制成热图(图6A),并分别对每个靶点蛋白结合能最低的小分子化合物进行可视化。共进行25次分子对接,结果显示结合能均小于-6.0,对接结果良好(图6B)。
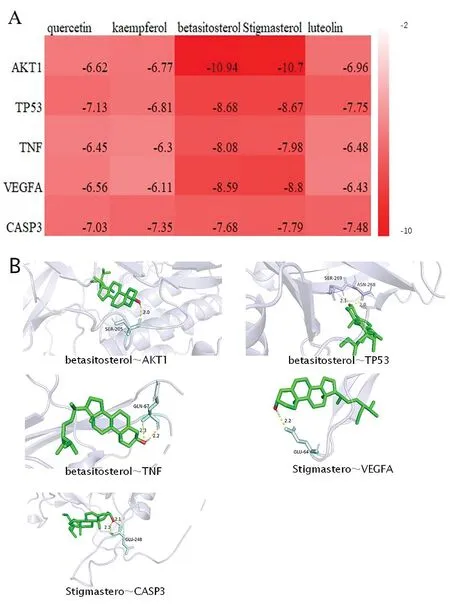
图6 分子对接:A图示结合能大小;B图示对接结果的可视化
3 讨论
蒙药额尔敦-乌日勒中有效成分为黄酮类化合物、木犀草素、栀子苷、桂皮醇等[8-10]。其中黄酮类化合物具有调节炎症和细胞生存相关的microRNA表达的特性;木犀草素可通过降低表皮生长因子(epidermal growth factor,EGF)的mRNA表达,抑制EGF介导氧化磷酸化、ERK和MARK-PI3K-Akt信号通路激活,从而增强脑内神经胶质细胞稳定性[11]。栀子苷可以提高损伤神经细胞活力,减轻神经细胞凋亡,对PD小鼠模型具有调节DA代谢和神经保护作用,改善PD小鼠的睡眠障碍[12]。体外实验表明桂皮醇可减轻IL-1刺激下大鼠脑微血管内皮细胞炎症因子COX和PGE2的释放[13]。大量研究表明,蒙药额尔敦-乌日勒通过多种机制发挥脑源性营养作用和神经保护作用[14-15]。本研究发现,蒙药额尔敦-乌日勒中含有118个活性成分可与和PD相关的207个靶点发挥作用,这些活性成分发挥抗PD作用的主要靶点是AKT1、TP53、TNF、VEGFA、CASP3等。应用Metascape数据库和微生信平台对蒙药额尔敦-乌日勒潜在作用于PD的靶点进行GO分析,结果显示蒙药额尔敦-乌日勒治疗PD的作用机制主要涉及RNA聚合酶启动子转录的正调控、正调控DNA模板转录和正调控基因表达等生物过程。这些通路在细胞代谢、增殖、细胞存活、生长和血管生成等方面发挥作用,额尔敦-乌日勒的治疗作用可能与促进这些生命活动的进行有关。
AKT1是一种丝氨酸/苏氨酸激酶,是PI3K/AKT信号转导途径的重要中间分子,在细胞内信号通路中起重要作用,调节许多过程,包括代谢、增殖、细胞存活、生长和血管生成。李筱媛[16]通过病例对照对我国北方地区汉族中散发PD患者进行研究发现,TLR2和AKT1基因多态性均与中国北方汉族散发性PD的人群具有风险关联。研究表明,PD和动脉粥样硬化在发病机制上有很多相同和相似之处,发病机制都涉及血管内皮功能紊乱、炎症反应等过程[17]。IL-17RA/核因子κB通路激活是PD神经元死亡的主要原因之一。研究发现,在与T淋巴细胞共培养或添加IL-17后,多能干细胞衍生的PD中脑神经元在IL-17受体(IL-17R)上调和NF-κB激活的驱动下,导致神经元死亡增加,而阻断IL-17或IL-17R,或添加FDA批准的抗IL-17抗体secukinumab,可有效挽救神经元的死亡。上述研究表明,产生IL-17的T淋巴细胞在散发性PD中起着关键作用[18-19]。P13K/Akt信号通路可促进细胞代谢、增殖、存活、生长,参与癌症的发生、化疗耐药和血管生成的调控。Shimoke等[20]应用NGF(神经生长因子)治疗MPTP诱导的PC12细胞PD模型,发现其有保护作用,且这种保护作用可被PI3K的特异性抑制剂LY294002所削弱,认为NGF可能通过Akt信号通路起到对PD的治疗作用。刘晓芳[21]研究发现,钙释放激活钙通道调节分子1的表达下降可通过PI3K/Akt/NF-κB信号通路影响神经炎症,从而使多巴胺能神经元含量下降,参与PD发展。MAPK是细胞内的丝氨酸/苏氨酸蛋白激酶,已被证实参与多种细胞生理活动,通过逐步激活将细胞外信号传导至细胞内,进而调整细胞的生长、分化、凋亡、炎症等生理及病理过程。MAPK家族主要包括p38MAPK、c-Jun氨基末端激酶和细胞外信号调节激酶[22]。在多项研究中发现,α-突触核蛋白异常蓄积激活p38 MAPK可促进神经元死亡,进而参与多种神经退行性疾病的致病进程[23]。在伴有认知功能障碍PD小鼠的相关研究中也发现了p38MAPK的异常激活;而抑制p38MAPK可改善PD小鼠突触可塑性,改善其认知功能;该项研究认为,p38MAPK异常激活可损伤突触的可塑性,是PD认知功能障碍的发病机制之一[24]。本研究经KEGG富集发现,蒙药额尔敦-乌日勒治疗PD的主要作用通路包括与脂质动脉硬化相关通路、IL-17信号通路、P13K-Akt信号通路、MAPK信号通路等。我们认为,蒙药额尔敦-乌日勒通过多通路协同作用治疗PD。
综上所述,本研究基于网络药理学对蒙药额尔敦-乌日勒的主要成分进行研究,预测了蒙药额尔敦-乌日勒治疗PD的主要靶点及作用机制,初步诠释了蒙药额尔敦-乌日勒可通过多靶点、多通路治疗PD,为进一步理论研究、实验设计和临床应用指明了方向。

