抗磷脂酶A2受体抗体与特发性膜性肾病的临床病理及预后相关性分析*
卿山林,周 莉,曾 莉,江玉波,尧 鹏
1.四川大学华西医院 肾内科(成都 610041);2.成都医学院第二附属医院·核工业四一六医院 肾内科(成都 610051)
特发性膜性肾病(idiopathic membranous nephropathy,IMN)是一种常见的肾小球疾病,为中老年难治性肾病综合征的常见病理类型,在原发性肾小球疾病中占23.4%~43.3%,近年来其患病率呈增长趋势[1-2]。80% IMN患者出现大量蛋白尿,虽然大部分患者病情进展缓慢,但仍有30%的 IMN患者在5~10 年内发生肾功能恶化,进入肾脏替代治疗[3]。研究[4]证实,70% IMN患者能检测出针对M型磷脂酶A2 受体(phospholipase A2 receptor,PLA2R)构象依赖表位的抗体,该表位存在于正常足细胞中,并在肾小球中免疫沉积与IgG4 亚型共定位。足细胞、滤过屏障结构改变及肾小球毛细血管壁功能受损等导致蛋白尿,这是膜性肾病的主要特征[5-6]。虽然肾活检是诊断膜性肾病的金标准,但作为一项有创性操作,尤其对高龄或存在相对禁忌证的患者,实施肾活检在实际临床实践中有一定局限性。由于血清检测抗PLA2R抗体对高龄及不适合肾活检的患者具有无创性优点,在临床应用于IMN的诊断简便可行。目前有关抗PLA2R抗体与IMN临床及病理表现、预后的相关研究存在一定差异,因此本研究通过回顾性分析IMN患者的临床病理特点及随访期间抗PLA2R抗体水平变化,评估抗PLA2R抗体检测对IMN诊断、治疗及预后判断的价值,分析影响预后的因素,以期为IMN的临床诊治提供参考依据。
1 资料与方法
1.1 临床资料
选取2015年6月至2021年6月在成都医学院第二附属医院·核工业四一六医院肾脏内科行超声引导下经皮肾穿刺活检术的52 例IMN患者为研究对象,根据血清抗PLA2R抗体滴度水平,将其分为抗PLA2R抗体阳性组(n=37)与抗PLA2R抗体阴性组(n=15)。纳入标准:1)行肾活检前3 个月内无糖皮质激素和免疫抑制剂使用病史;2)年龄≥18 岁;3)符合IMN的诊断标准,并排除继发性膜性肾病[7]。排除标准:1)存在严重心肺疾病者;2)有明确的精神类疾病史;3)妊娠及哺乳期者;4)无法配合随访者;5)临床资料缺失者。纳入患者年龄(55.5±14.0)岁,其中男30 例,女22 例。本研究经成都医学院第二附属医院·核工业四一六医院伦理委员会审批(审批号:YJ-2021-009),纳入患者均签署知情同意书。
1.2 实验室指标
实验室指标包括:1)抗PLA2R抗体。患者血清抗PLA2R抗体滴度(IgG检测试剂盒,购自德国欧蒙公司)检测方法为量子点荧光免疫法定量,血清抗PLA2R抗体滴度>14.0 RU/mL检测为阳性,由四川金域医学检验中心完成。2)24 h尿蛋白定量和生化指标。24 h尿蛋白定量、血清白蛋白(albumin,ALB)、血清肌酐(serum creatinine,Scr)、血尿素(blood urea nitrogen,BUN)、甘油三酯(triglyceride,TG)、胆固醇(cholesterin,CH)等送成都医学院第二附属医院·核工业四一六医院检验科检测。
1.3 病理切片检查
肾组织由临床医师在彩色超声引导下经皮肾穿刺活检获取,切取标本,制作病理切片,进行新鲜组织冰冻免疫荧光检测及光镜、电镜观察。光镜检查包括:苏木精-伊红染色、过碘酸雪夫染色、六胺银染色、马松三色染色。免疫荧光染色包含IgA、IgM、IgG、IgG1、IgG4、C1q、C3、C4、FRA等指标检测。其中,免疫荧光、光镜检查由成都医学院第二附属医院·核工业四一六医院病理科独立完成,电镜标本送四川大学华西医院电镜室完成(图1)。所有患者病理均符合膜性肾病的诊断。

图1 肾组织病理检查图片
1.4 治疗方案
根据病情给予IMN患者血管紧张素转换酶受体拮抗剂或血管紧张素Ⅱ受体拮抗剂降尿蛋白、激素联合免疫抑制剂治疗。根据患者经济情况选择免疫抑制治疗方案:1)醋酸泼尼松片0.15 mg/kg·d (山东鲁抗集团赛特有限责任公司,国药准字:H20033023,批号:230613)+他克莫司0.050~0.075 mg/kg·d(杭州中美华东制药有限公司,国药准字:H20084514,批号:2304110),其中他克莫司血药谷浓度为0.005~0.008 ng/L,每月复查谷浓度,根据结果调整剂量。2)醋酸泼尼松片1 mg/kg·d+注射用环磷酰胺(江苏恒瑞股份有限公司,国药准字:H32020856,批号:23061925)静脉滴注1 g/月(根据尿蛋白缓解情况,激素逐渐减量),连续6 个月,其后每3 个月环磷酰胺静脉滴注1 g,共2 次。治疗期间每月复查生化指标及24 h尿蛋白,随访12 个月,抗PLA2R抗体定量分别于治疗后3、6、12 个月检测。
1.5 预后判断
参考2021 年改善全球肾脏病预后组织指南标准(表1),对IMN患者进行预后判断。
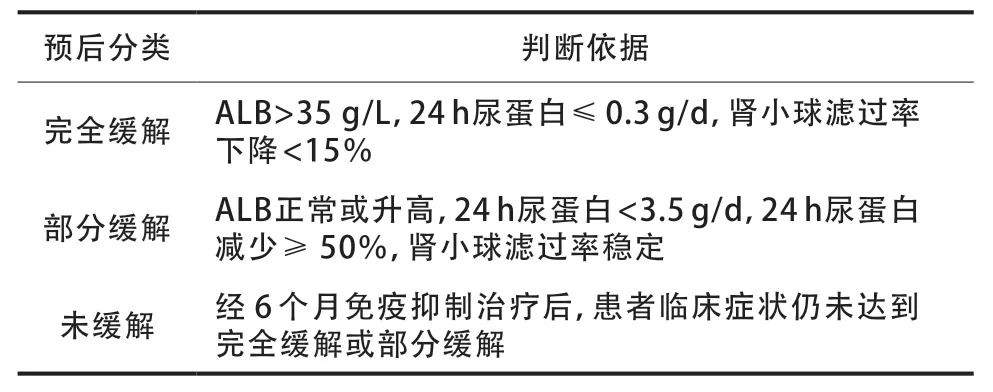
表1 IMN患者进行预后判断依据
1.6 统计学方法
采用SPSS21.0 统计软件进行统计分析,定量资料采用Shapiro-Wilk检验其正态性,服从正态分布的定量资料采用()表示,两组间比较采用独立样本t检验,3 组间比较采用方差分析;不服从正态分布的定量资料采用M(P25,P75)表示,组间比较采用秩和检验;定性资料采用例数(%)表示,组间比较使用χ2检验或Fisher精确概率;应用Kaplan-Meier生存分析及Log-rank检验评估不同初始血清抗PLA2R抗体水平患者治疗效果。检验水准α除特别说明外均设定为0.05。
2 结果
2.1 两组基线资料比较
两组年龄、性别、高血压等基线资料比较,差异无统计学意义(P>0.05)(表2)。
表2 两组基线资料比较[,n(%)]
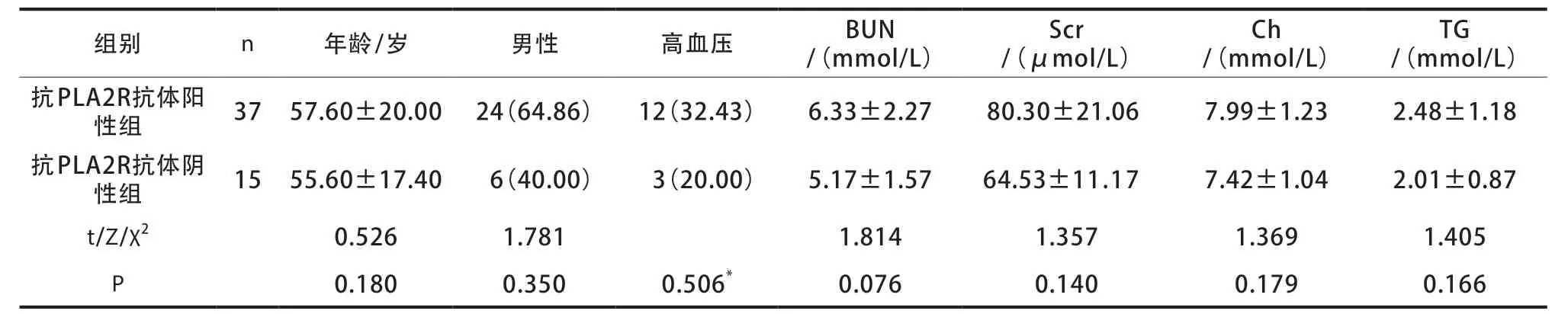
表2 两组基线资料比较[,n(%)]
注:*采用Fisher精确概率。
?
2.2 血清抗PLA 2R 抗体诊断IMN 的价值分析
血清抗PLA2R抗体诊断IMN的ROC曲线显示,其最佳截断值为0.827,敏感性为84.6%,特异性为98.1%,曲线下面积为0.914(95%CI 0.846~0.983,P<0.001)(图2)。
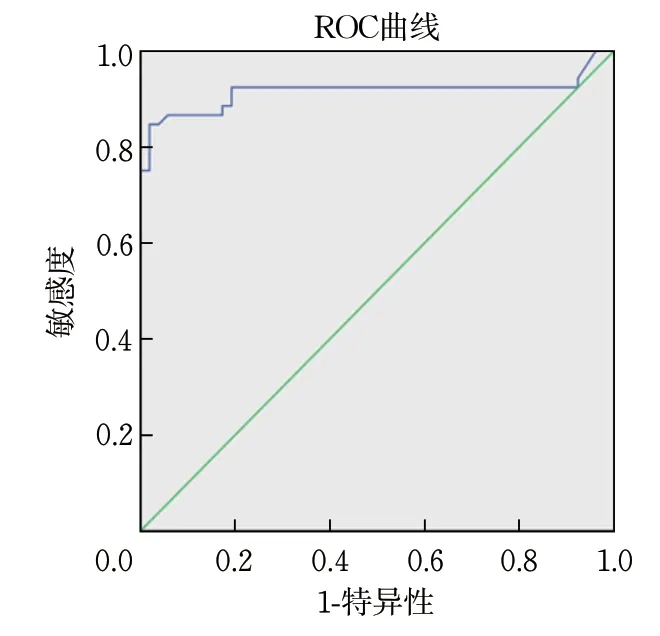
图2 血清抗PLA2R抗体诊断IMN的ROC曲线分析
2.3 两组肾脏病理特点比较
两组肾组织样本电镜下电子致密物沉积部位一致。抗PLA2R抗体阳性组肾小球硬化及慢性肾小管病变发生率高于抗PLA2R抗体阴性组。两组肾组织IgG4 沉积及病理改变特点(肾小球系膜增生、急性肾小管病变、肾间质炎细胞浸等)比较,差异无统计学意义(P>0.05)(表3)。纳入的IMN患者中Ⅰ期28 例,Ⅱ期20 例,Ⅲ期4 例,两组病理分期构成比差异无统计学意义(P>0.05),免疫荧光均以IgG4 沉积为主(图1)。
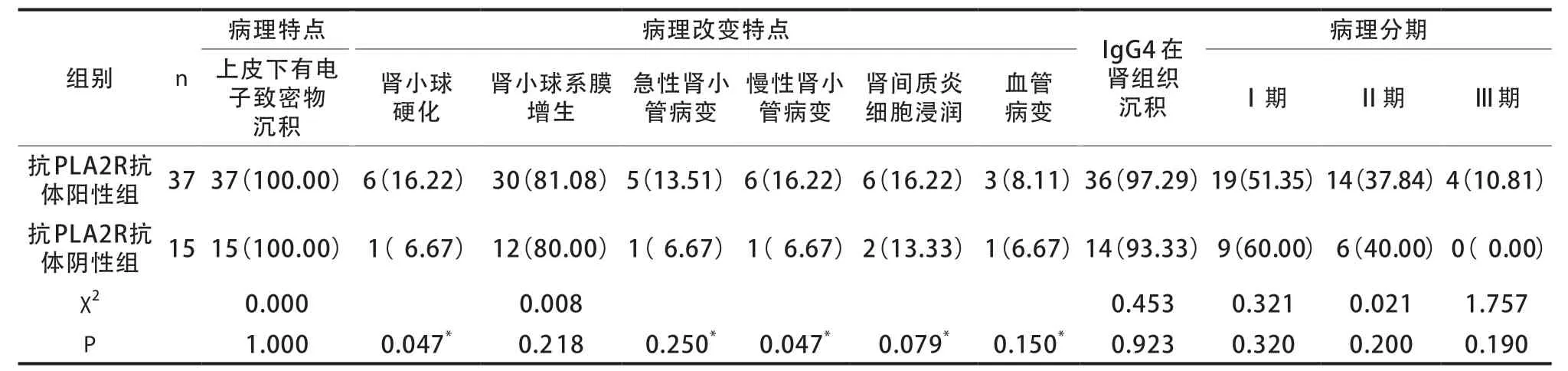
表3 两组肾脏病理特点比较[n(%)]
2.4 血清抗PLA 2R 抗体水平与IMN 临床预后的关系
与治疗前比较,治疗3、6、12 个月后两组24 h尿蛋白定量均较低,ALB水平均较高(P<0.05);且与抗PLA2R抗体阴性组相比,抗PLA2R抗体阳性组同时间点(治疗3、6、12 个月)的24 h尿蛋白定量较高,ALB水平较低,差异有统计学意义(P<0.05)(表4)。
表4 两组24 h尿蛋白定量与ALB水平比较[M(P25,P75),]
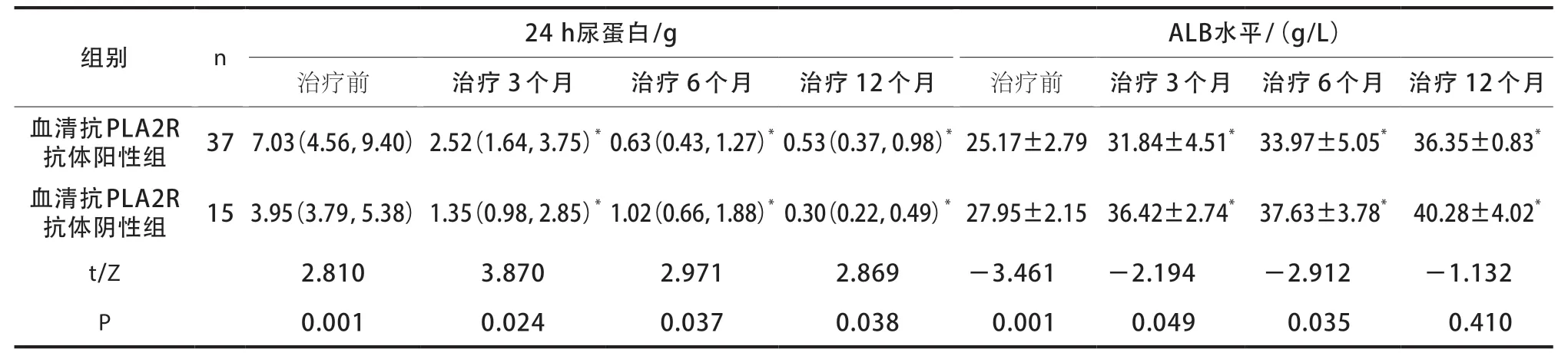
表4 两组24 h尿蛋白定量与ALB水平比较[M(P25,P75),]
注:与同组治疗前比较,*P<0.05。
?
2.5 治疗后两组临床缓解情况比较
在不同时间(治疗3、6、12 个月后)抗PLA2R抗体阳性组临床缓解率均低于同期抗PLA2R抗体阴性组,差异有统计学意义(P<0.05)(表5)。
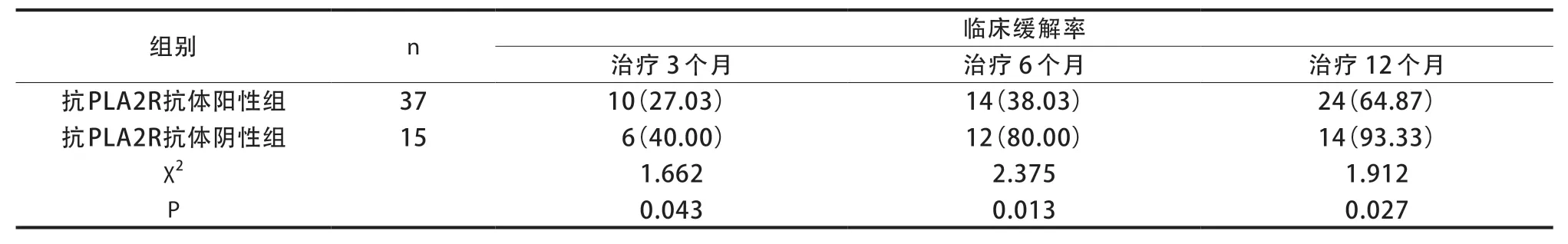
表5 不同治疗时间两组临床缓解情况比较[n(%)]
2.6 IMN 患者预后分析
纳入患者经12个月随访,K-M曲线显示,初始血清抗PLA2R抗体阴性患者更易达到部分缓解(χ2=30.495,P<0.001)(图3)。

图3 IMN患者初始血清PLA2R抗体水平与预后的K-M曲线分析
3 讨论
磷脂酶A2(phospholipase A2,PLA2)分布在人体多个器官中,可与PLA2R结合形成免疫复合物,调节细胞增殖、活性因子分泌,在炎症反应过程中发挥关键作用。IMN是一种自身免疫性疾病,PLA2R在IMN患者肾组织中过表达,诱发机体产生抗PLA2R抗体[8]。据报道,血清抗PLA2R抗体诊断IMN敏感性为52%~78%,特异性为97%~100%[9-11];在健康人群及其他肾小球疾病(如IgA肾病)[12-14]、系统性疾病患者中鲜少检出,在狼疮性肾炎为全阴性[15]。本研究通过回顾性分析IMN患者血清抗PLA2R抗体检测发现,其最佳截断值为0.827,敏感性为84.6%,特异性为98.1%,曲线下面积为0.914(95%CI 0.846~0.983,P<0.001)。血清抗PLA2R抗体检测对IMN的诊断价值较高。有研究[16-17]提出,在肾功能保留且无继发性原因证据的患者中,血清抗PLA2R抗体检测呈阳性可预测PLA2R相关IMN的组织诊断。肾活检作为有创性检查具有一定风险,甚至可并发大血肿,需要输血、介入或手术止血等治疗,导致部分患者接受度差,因此肾活检在临床应用中有一定局限性。血清抗PLA2R抗体在IMN患者具有较高敏感性及特异性,尤其对高龄、有肾活检禁忌证(孤立肾、高风险出血者等)、拒绝肾活检的患者具有无创性优势,可作为有创性肾活检病理诊断的替代或补充方式。
IMN患者的抗PLA2R抗体水平较正常人和非IMN患者明显高,在相关研究[14,18]中也得到证实。IMN患者病理生理过程表现为肾小球足细胞靶抗原与循环中自身抗体(主要为IgG4)结合,形成自身免疫复合物,通过凝集素途径激活补体,引发炎症级联反应,损伤足细胞,导致尿蛋白丢失[19],形成大量蛋白尿。一项前瞻性队列研究[20]对65 例IMN患者进行24 个月随访发现,抗PLA2R抗体阳性与抗PLA2R抗体阴性的IMN患者之间存在不同的临床表型。本研究发现,与抗PLA2R抗体阴性组比较,抗PLA2R抗体阳性组24 h尿蛋白水平明显较高,ALB明显较低(P<0.05)。也有研究[21]报道,抗PLA2R抗体与ALB无相关性,与本研究结果不同,考虑与纳入的肾病综合征患者临床表型不同有关。此外本研究显示,两组在性别、年龄、Scr、BUN、TG等指标比较差异无统计学意义(P>0.05)。一项单中心回顾性研究[22]229 例IMN患者的临床特征,发现抗PLA2R抗体阴性组ALB水平较高,且24 h尿蛋白、Scr和β2-微球蛋白水平低于抗PLA2R抗体阳性组;两组在年龄、性别方面差异无统计学意义(P>0.05)。
本研究通过比较IMN患者肾组织病理特点,发现抗PLA2R抗体阳性组肾小球硬化及慢性肾小管病变的发生率高于抗PLA2R抗体阴性组。而庄永泽等[21]发现,IMN患者抗PLA2R抗体阳性组与抗PLA2R阴性组肾小球硬化的发生率差异无统计学意义(P>0.05),这与本研究发现不同,可能与本研究患者年龄偏大、合并高血压基础病等因素有关。本研究发现,两组肾组织IgG4 沉积、肾小球系膜细胞及基质增生、肾间质炎症细胞浸润、急性肾小管病变等病理改变差异无统计学意义(P>0.05)。研究[22-24]发现,IMN患者抗PLA2R抗体阳性组与抗PLA2R抗体阴性组在病理分期构成比方面比较,差异无统计学意义(P>0.05)。
Guo等[25]随访了42例IMN患者,发现抗PLA2R阳性患者临床病程与抗体水平变化相关(ALB减少、蛋白尿增加与抗体滴度呈正相关),提示IMN患者临床结局与抗PLA2R抗体有关。本研究发现,抗PLA2R抗体阳性组临床缓解率低于抗PLA2R抗体阴性组,表明抗PLA2R抗体阳性患者临床治疗起效慢,治疗缓解时间长,临床总缓解率相对较低,提示IMN患者疾病进展与抗PLA2R抗体水平有关[26-28]。
多数IMN疾病进展缓慢,其转归结局与肾组织PLA2R抗原、血清抗PLA2R抗体水平、免疫抑制方案等多种因素有关[27,29-30],对IMN免疫抑制治疗的最佳时机和持续时间一直存在争议,充分评估抗PLA2R抗体与预后的关系,可对免疫抑制治疗介入的适宜时机和使用疗程的决策提供参考依据,从而避免治疗过度导致的不良反应[25,31]。本研究发现,初始血清抗PLA2R抗体阴性患者更易达到部分缓解,提示IMN患者抗PLA2R抗体水平对疾病预后有一定的预测作用,尤其对高龄、难以耐受使用免疫抑制剂相关不良反应的患者,可帮助临床医师在实际工作中衡量免疫抑制治疗的利弊,选择个体化治疗方案。
本研究不足之处为样本量较小,且为回顾性分析,血清抗PLA2R抗体检测频率不够,随访资料及时间有一定局限性,使用不同的免疫抑制治疗方案均可能影响结果准确性,后期将扩大样本量,延长随访时间进一步研究。
综上所述,IMN患者中血清抗PLA2R抗体阳性组与阴性组在病理上有一定差异。抗PLA2R抗体检测对IMN有较高的敏感性和特异性,具有临床诊断价值。抗PLA2R抗体水平与IMN疾病活动度相关,可作为IMN临床预后判断指标。

