高度近视继发脉络膜病变的相关因素Logistic回归分析及风险模型构建
黄晓寒 唐少华
高度近视发病率占近视人群的27%~33%,随着近视度数增加,可引起多种并发症,包括脉络膜萎缩、脉络膜新生血管病灶[1-2]。脉络膜与视网膜疾病密切相关,可破坏眼部结构影响视功能,而脉络膜萎缩、脉络膜新生血管可引起多种眼底疾病[3-4]。因而探究高度近视继发脉络膜病变的危险因素有助于临床制定干预措施。多因素Logistic回归分析、森林图广泛应用于预测疾病发生风险[5]。Nomogram模型可整合不同相关变量,生成临床事件单个数值概率,以符合生物、临床整合模型需求,并可推动个体化医疗,以协助临床决策[6]。目前高度近视继发脉络膜病变的预测模型尚未统一,本研究通过多因素Logistic回归分析高度近视继发脉络膜病变的影响因素,并构建准确预测脉络膜病变的Nomogram风险模型,以期对脉络膜病变的风险因素进行早期干预。
1 资料与方法
1.1 一般资料与分组
选取2021年1月至2023年1月北京积水潭医院收治的340例(680眼)高度近视患者为研究对象,随机分为A组(170例340眼)、B组(170例340眼),两组患者一般资料差异均无统计学意义(均为P>0.05)(表1),具有可比性。本研究经本院伦理委员会批准(批准号:20210103589),且所有患者均签署知情同意书。
1.2 纳入与排除标准
纳入标准:高度近视定义为眼轴长度≥26 mm且屈光度≥-6.00 D[7];脉络膜萎缩、脉络膜新生血管病灶符合相关标准[8];病灶继发于黄斑中心凹下或旁中心凹;OCT检查显示脉络膜毛细血管断裂。排除标准:无法检查眼底者;合并其他视网膜血管疾病或眼前节其他病变者;严重心肺功能不全者;既往接受过眼部手术者;既往有青光眼病史者;合并严重全身系统性疾病者。
1.3 方法
1.3.1 样本量估算
本研究共20个危险因素,根据建模样本量计算公式的要求,每个自变量需要患者5~10例,高度近视继发脉络膜病变率为36%[9],加上样本流失10%~20%,因此,本研究所需样本量最少为334例[20×5×(1+0.2)÷0.36=333.3]。根据纳入、排除标准本研究共选取368例患者,共有340例高度近视患者完成调查分析。
1.3.2 问卷调查
调查并记录患者基本资料,包括性别、年龄、民族、体重指数、心率、呼吸频率、收缩压、舒张压、受教育程度、吸烟、饮酒、高血压、糖尿病、高脂血症,其中糖尿病符合2型糖尿病诊断标准[10]。
1.3.3 检测患者眼部参数
所有患者均采用NCT-200非接触眼压计测量眼压,使用CR-8800电脑验光仪检测屈光度。由验光师采用国际标准视力表检查最佳矫正视力(BCVA)并换算为logMAR视力。采用OSE-1800 OCT扫描仪检查黄斑中心凹下脉络膜厚度,中心凹下定义为黄斑中心凹起直径500~1 500 μm。IOLMaster 500光学生物测量仪检测眼轴长度。比较两组患者脉络膜病变(脉络膜萎缩、脉络膜新生血管病灶)发生率[9]。在A组、B组中,根据是否发生脉络膜病变分为a组(发生脉络膜病变)、b组(未发生脉络膜病变)两个亚组,比较两亚组患者基本资料差异。
1.3.4 检测患者血清转化生长因子-β1水平
所有患者采集空腹外周静脉血5 mL,经3 500 r·min-1离心10 min分离血清,采用ELISA法检测血清转化生长因子-β1(TGF-β1)水平。
1.4 统计学分析
2 结果
2.1 两组患者脉络膜病变发生率比较
A组和B组患者脉络膜病变发生率比较,差异无统计学意义(P>0.05)(表2)。
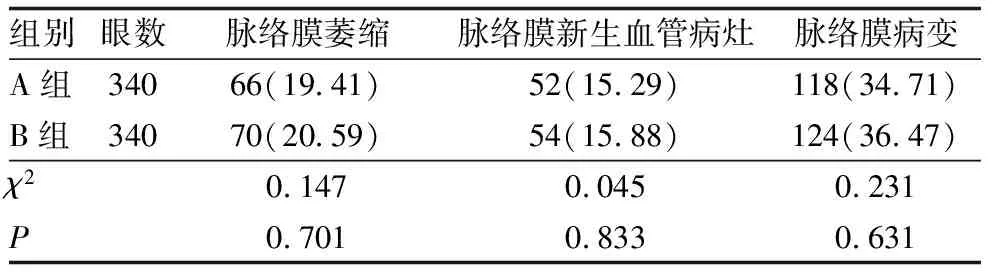
表2 两组患者脉络膜病变发生率比较 [n(%)]
2.2 发生与未发生脉络膜病变患者临床资料比较
A组患者中,a组59例,b组111例。B组患者中,a组62例,b组108例。在A组、B组中,a组患者年龄、糖尿病占比、眼轴长度、血清TGF-β1水平均高于b组,屈光度均低于b组(均为P<0.05),其他指标a组与b组患者相比差异均无统计学意义(均为P>0.05)(表3)。
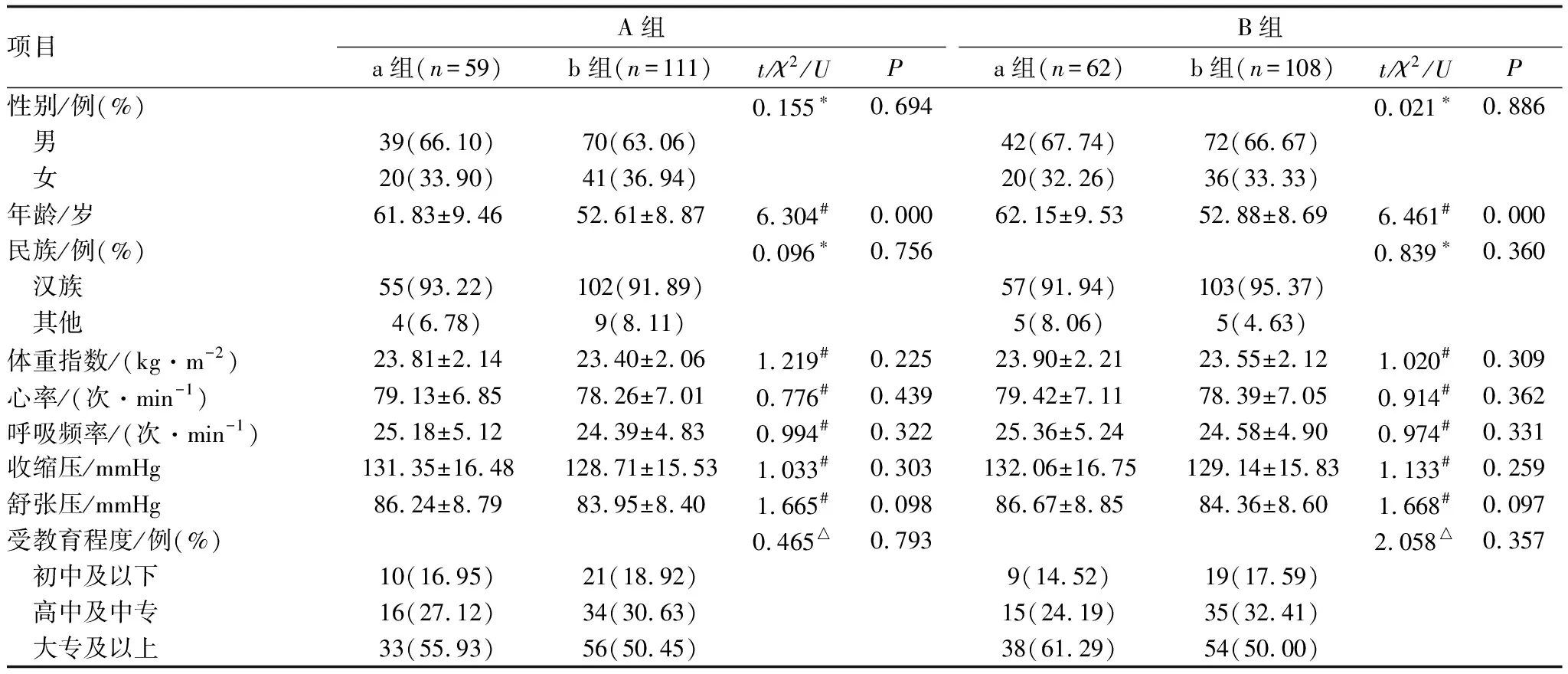
表3 发生与未发生脉络膜病变患者临床资料比较
2.3 高度近视继发脉络膜病变的影响因素
在A组中,以高度近视患者是否继发脉络膜病变为因变量(否=0,是=1),将年龄(连续变量,原值代入)、糖尿病(无=0,有=1)、屈光度(连续变量,原值代入)、眼轴长度(连续变量,原值代入)、血清TGF-β1水平(连续变量,原值代入)作为自变量,通过Logistic回归分析显示,年龄、糖尿病、眼轴长度、血清TGF-β1水平为高度近视继发脉络膜病变的独立危险因素,屈光度为其保护因素(均为P<0.05)(表4)。

表4 高度近视继发脉络膜病变的影响因素
2.4 绘制森林图
在A组中,根据2.3的结果绘制高度近视继发脉络膜病变的影响因素森林图,结果显示,年龄、糖尿病、屈光度、眼轴长度、血清TGF-β1水平均与无效线不相交(均为P<0.05),其中年龄、糖尿病、眼轴长度、血清TGF-β1水平均为高度近视继发脉络膜病变正相关危险因素,屈光度为其负相关危险因素(均为P<0.05)(图1)。
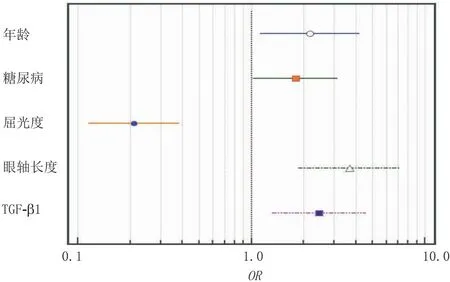
图1 高度近视继发脉络膜病变的影响因素森林图
2.5 Nomogram风险预测模型
在A组中,以年龄、糖尿病、屈光度、眼轴长度、血清TGF-β1水平为预测因素,以高度近视继发脉络膜病变为目标事件,绘制Nomogram风险预测模型,见图2。
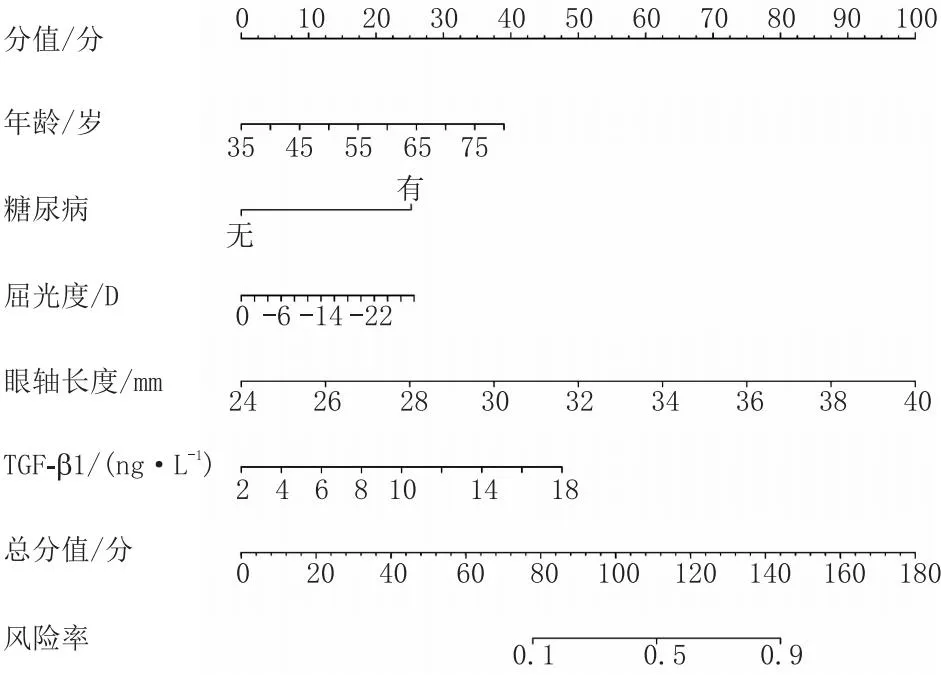
图2 高度近视继发脉络膜病变的Nomogram风险预测模型
2.6 Nomogram风险预测模型外部验证
在B组中,绘制Nomogram风险预测模型预测高度近视患者继发脉络膜病变的校准度曲线(图3),该模型校正曲线趋近于理想曲线,即模型预测结果与实际观测结果有较好的一致性,提示其预测脉络膜病变的校准度良好。绘制Nomogram风险预测模型预测高度近视继发脉络膜病变的ROC曲线(图4),由图可知,AUC为0.818,具有良好预测效能。
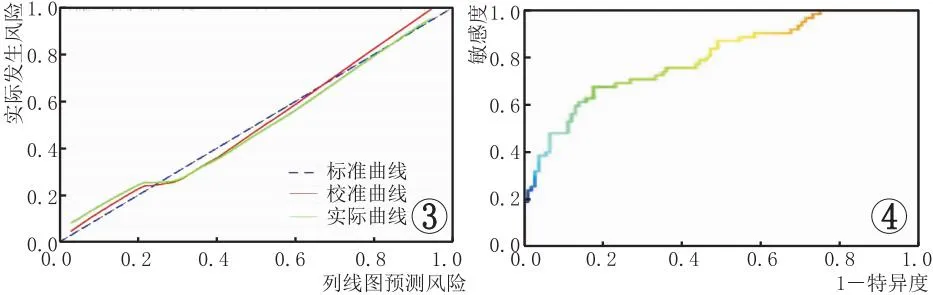
图3 Nomogram风险预测模型的校准度曲线。图4 No-mogram风险预测模型的ROC曲线
3 讨论
3.1 高度近视继发脉络膜病变的发病机制
高度近视继发脉络膜病变的发病机制可能与脉络膜血管减少、黄斑部视网膜缺血缺氧、血管生成因子分泌增加有关,视网膜下新生血管形成可促使视网膜色素上皮脱离,损伤视网膜组织,基底膜增厚可破坏毛细血管完整性,直接损伤血-视网膜屏障,改变脉络膜血管,致使视网膜缺血,最终导致脉络膜病变发生[11-13]。
3.2 Logistic回归分析与森林图分析
本研究在高度近视继发脉络膜病变中首次应用Logistic回归分析、森林图分析,结果显示,年龄、糖尿病、眼轴长度、血清TGF-β1水平为高度近视继发脉络膜病变的独立危险因素,而屈光度为其保护因素。进一步分析发现,年龄、糖尿病、眼轴长度、血清TGF-β1水平为高度近视继发脉络膜病变正相关危险因素,而屈光度为其负相关危险因素,提示临床上应重视上述影响因素,并制定个体化治疗方案,以降低脉络膜病变发生风险。
3.3 年龄与脉络膜病变的关系
高度近视继发脉络膜病变者眼内炎症因子、血管生成因子水平异常,随着年龄增长,脉络膜萎缩面积扩大,漆裂纹不断加宽,逐步融合为弥漫性萎缩,且黄斑部脉络膜萎缩可进一步发展为新生血管病灶[14-16]。本研究结果显示,发生脉络膜病变者年龄高于未发生脉络膜病变者,与其他研究结果相似[17],其原因可能为随着年龄增长,巩膜胶原纤维变性、坚韧性下降、巩膜过度扩张,可加重后巩膜肿胀程度,促使巩膜、脉络膜变薄,导致视网膜变性、萎缩,进而引起脉络膜新生血管等眼底病变。
3.4 糖尿病与脉络膜病变的关系
伴有糖尿病者可引起视网膜代谢失调,血糖变化可影响脉络膜血流、毛细血管功能及视网膜光感受器,诱发微血管内皮损伤,并可促使毛细血管基底膜增厚,增加周细胞凋亡数量[18-19]。本研究结果显示,发生脉络膜病变者糖尿病占比高于未发生脉络膜病变者,分析其原因可能为糖尿病患者视网膜血管白细胞瘀滞、血流缓慢,导致慢性缺氧,引起胶质细胞、神经血管损伤,并可能破坏毛细血管,引起脉络膜病变。
3.5 眼轴长度与脉络膜病变的关系
眼轴长度与脉络膜视网膜伸展或退化有关,可引起脉络膜视网膜微循环障碍,眼轴长度每增加 1 mm,脉络膜萎缩患病率增加13.3%[20]。本研究结果显示,发生脉络膜病变者眼轴长度长于未发生脉络膜病变者,与相关研究结果相似[21],其原因可能为眼轴长度延长可促使视网膜变薄,降低其需氧量,促进脉络膜新生血管形成。
3.6 血清TGF-β1水平与脉络膜病变的关系
脉络膜病变与炎症反应、血管生成、局灶性感染有关,TGF-β1可调控细胞增殖、分化,且与脉络膜新生血管形成有关[22-23]。TGF-β1可诱导血管生成、细胞免疫反应,促使细胞外基质积累,引起重要脏器纤维化,还可通过信号转导维持脉络膜血管循环结构稳定性[24]。本研究结果显示,发生脉络膜病变者血清TGF-β1水平高于未发生脉络膜病变者,提示TGF-β1水平升高可能促进脉络膜病变发生。
3.7 屈光度变化与脉络膜病变的关系
屈光度与多种眼部损伤风险有关,高度近视者黄斑区脉络膜、视网膜发生病变,随着屈光度降低,脉络膜各层血管厚度逐渐变薄[25-26]。发生脉络膜病变者屈光度低于未发生脉络膜病变者,这可能与脉络膜自身厚度调节有关,屈光度降低可能会引起脉络膜-玻璃膜-视网膜色素上皮复合体撕裂,促使脉络膜缺血缺氧,刺激脉络膜病变发生。临床上应高度重视高度近视人群屈光度,若在早期控制屈光度,可正确观察分析高度近视是否继发脉络膜病变,并采取相应治疗手段,有效阻止视功能损害。同时临床上应对高度近视人群密切观察随访,建立视力档案并进行长期随访,以此防止严重眼底病变发生发展。
本研究试图在Logistic回归-森林图分析基础上构建Nomogram风险预测模型,结果显示,该预测模型预测脉络膜病变的AUC为0.818,提示该预测模型具有良好预测效能。为保证该模型校准度,避免数据过度拟合,本研究对模型进行外部验证,结果显示,该模型校正曲线趋近于理想曲线,即该模型预测结果与实际观测结果具有良好一致性,提示Nomogram风险预测模型具有良好预测校准度。
4 结论
年龄、糖尿病、眼轴长度、血清TGF-β1水平为高度近视继发脉络膜病变的独立危险因素,而屈光度为其保护因素,基于上述相关因素构建Nomogram风险预测模型,该模型可有效预测脉络膜病变发生风险,有利于临床上筛查高风险人群,可为临床防治提供新思路。临床上应高度重视高龄、糖尿病、眼轴长度较长、血清TGF-β1水平较高、屈光度较低者,警惕其发生脉络膜病变。

