胰肾联合移植术后糖尿病足重症感染救治患者1例报道*
林令君,万永丽,高 杨
(1.天津医科大学朱宪彝纪念医院感染管理科,天津 300134;2.天津医科大学朱宪彝纪念医院ICU,天津 300134 ;3.天津市内分泌研究所/国家卫健委激素与发育重点实验室/天津市代谢性疾病重点实验室,天津 300134 )
胰肾联合移植术是1型、2型糖尿病合并终末期肾病患者有效的治疗方法,成功移植后绝大多数患者血糖恢复正常,不需要依靠透析和胰岛素治疗,但有研究显示胰肾联合移植术不能逆转已形成的血管、神经病变[1]。本例患者成功行胰肾联合移植术,术后血糖稳定,但1年后出现糖尿病足,且患者术后长期服用免疫抑制剂,机体免疫力低,糖尿病足感染重并继发重症肺炎,感染性休克及多器官功能障碍综合征。经过多学科共同救治,成功救治患者并保留肢体。现对该患者救治过程进行回顾分析,报道如下。
1 临床资料
患者,男,61岁,主诉因“左足破溃2个月余,加重1周”于2020年7月23日收治于本院足科。患者于2个月前出现足底破溃,予外院换药,效果差,1周前创面红肿加重,伴发热,体温最高达39.0 ℃。患者进行胸部CT检查见图1。于本院门诊清创换药,静脉滴注莫西沙星,体温恢复正常,足部创面未愈合,为进一步治疗收入院。既往高血压病史30余年、糖尿病病史19年,冠心病、心肌梗死、心功能Ⅱ级[美国纽约心脏病学会(NYHA)分级]病史3年,因糖尿病肾病、肾衰竭于1年前行胰肾移植术,术后服用抗排斥药强的松(泼尼松)5 mg,每天1次,他克莫司2 mg,每天2次,咪唑立宾100 mg,每天1次。自行监测空腹血糖波动于4~6 mmol/L,目前未服用降糖药。入院时查体:体温36.2 ℃,心率 78次/分,呼吸频率18次/分,血压164/75 mm Hg(1 mm Hg=0.133 kPa)。神清语利,心肺查体未见异常,双下肢不肿,左足背指凹性水肿,双足背动脉搏动减弱,左足外踝可见4 cm×4 cm创面,内可见大量坏死组织,向近端可探及深约5 cm隧道,按压可见少量脓性渗出,创周红肿,不伴触痛。然后对患者进行辅助检查。 血常规:白细胞计数(WBC) 15.96×109L-1,血红蛋白(Hb)106g/L,血小板计数(PLT) 485×109L-1;生化指标检测:血清肌酐(Cr) 111 μmol/L,清蛋白(ALB)30.7 g/L,谷丙转氨酶(ALT)23 U/L,谷草转氨酶(AST)20 U/L,总胆红素(TBIL)10.1 μmol/L;糖化血红蛋白6.6%。眼底镜可见激光斑,黄斑区可见黄白色改变,考虑双眼糖尿病性视网膜病变。双下肢动脉超声结果示双下肢动脉硬化伴多发附壁斑块形成,右股总、双股浅、左胫后动脉节段性狭窄(轻度),双腘、双胫前、左足背动脉阶段性狭窄(中度)。入院诊断:(1)2型糖尿病伴多个并发症、2型糖尿病足3级D期(左足)、足软组织感染(中度)、2型糖尿病性周围神经病、2型糖尿病性视网膜病变。(2)冠状动脉粥样硬化性心脏病、陈旧性心肌梗死、心功能Ⅱ级。(3)高血压3级(极高危)。(4)胰肾联合移植术后。(5)下肢动脉硬化闭塞症。入院后进一步完善相关实验室检查,给予清创换药,分泌物培养结果为大肠埃希菌,依据药物敏感度先后给予莫西沙星及头孢他啶抗感染治疗,予欣康(单硝酸异山梨酯片)扩张冠状动脉、阿司匹林抗血小板及对症支持等治疗,患者间断低热。入院后第13天,患者出现寒战、高热,体温最高38.8 ℃,自诉间断憋气,夜间可平卧,生命体征尚平稳。血常规:WBC 36.04×109L-1,中性粒细胞百分比(N%)91.60%,Hb 92 g/L,PLT 275×109L-1。生化指标检测:Cr 197 μmol/L,ALB 26.4 g/L,BNP 858 pg/mL,更换抗生素为亚胺培南西司他丁钠,同时送分泌物培养。第15天,实验室复查WBC 33.48×109L-1,N% 88.80%,Hb 91 g/L,PLT 272×109L-1,Cr 294 μmol/L,B型脑钠肽(BNP) 1 078 pg/mL,24 d尿量530 mL。第16天,Cr 水平升至335 μmol/L,B型钠尿肽(BNP) 1 105 pg/mL,24 h尿量200 mL。血气分析pH 7.455,氧分压(PO2)57.6 mm Hg,二氧化碳分压(PCO2)31.9 mm Hg,患者出现胸闷、憋气,不能平卧,双肺可闻及湿啰音,左下肢出现指凹性水肿,呼吸衰竭,为进一步治疗转重症监护病房(ICU)。入ICU诊断:(1)脓毒症、 脓毒性休克;(2)慢性心功能不全急性失代偿期 、心功能Ⅳ级;(3)急性肾损伤;(4)重症肺炎、Ⅱ型呼吸衰竭;(5)2型糖尿病伴多个并发症、2型糖尿病足3级D期(左足)、足软组织感染中度、2型糖尿病性周围神经病、2型糖尿病性视网膜病变;(6)高血压3级;(7)胰肾联合移植术后;(8)下肢动脉硬化闭塞症。8月10日,复查胸部CT,提示肺水肿、肺部炎症(图2)。足部分泌物培养提示球菌、杆菌,痰涂片可见大量革兰阳性(G+)球菌及真菌。治疗过程:(1)无创呼吸机辅助呼吸改善低氧血症;(2)循环功能支持、肾脏替代治疗:加强容量管理、新活素等改善心功能,血液净化清除体内代谢废物、减轻容量负荷;(3)抗菌药物:完善相关血培养、分泌物培养,痰培养、真菌检测实验(G实验)、半乳甘露聚糖抗原检测(GM实验)等,积极控制肺部、足部伤口感染。患者既往行胰肾联合移植,长期口服免疫抑制剂,存在免疫抑制因素,出现重症感染,不除外合并机会致病菌感染,给予亚胺培南西司他丁、利奈唑胺联合伏立康唑覆盖球菌、杆菌及真菌,并根据药物敏感度及抗感染治疗效果,适时调整抗感染治疗方案;(4)免疫抑制方案调节:监测血药浓度及根据感染控制情况,动态调节[强的松(泼尼松)、他克莫司、咪唑立宾]剂量;(5)其他脏器功能支持及对症输血、清蛋白,补充免疫球蛋白提高免疫力,加强营养支持及维持内环境稳定,加强伤口换药及对症支持等治疗。经过积极治疗,患者WBC、BNP水平均呈下降趋势,自主尿量逐渐增多;8月16日,停止血液净化;8月17日,复查胸部CT明显好转(图3),8月18日,24 d自主尿量达2 400 mL,血常规:WBC 8.66×109L-1,N% 62.9%,Cr 141 μmol/L,BNP 613 pg/mL,PCT 0.08 μg/L。进一步完善相关检查,左足核磁共振成像(MRI)结果示:(1)左足距骨颈部、跟骨上缘、第1跖骨头、中间锲骨囊变或骨侵蚀;(2)左距上关节面下软骨损伤伴骨髓水肿;(3)左足、踝骨质增生;(4)左足跟部软组织缺损伴窦道形成,伴足底筋膜,足底肌群广泛炎症;(5)左踝关节周围及足底软组织肿胀。左小腿MRI结果示:(1)左侧胫骨前方高信号影,考虑积脓;(2)左侧小腿肌群广泛高信号,考虑炎性累及;(3)左小腿周围软组织肿胀;(4)左膝关节骨质增生。患者足皮肤软组织感染,创面迁延不愈,已出现左小腿及左足脓肿,存在深部窦道,且内踝处红肿,不除外两侧相通,截肢风险高,在病情稍稳定时给予积极手术治疗,尽力保肢,于8月20日在腰硬联合麻醉下行左下肢脓肿切开清创术+抗生素骨水泥填充+负压封闭引流术(VSD),术后继续给予抗感染等治疗,病情平稳后于9月2日转入骨科继续治疗。先后于9月9日、9月18日、9月30日、10月13日行左小腿清创+左足清创+VSD更换术,术后继续给予抗感染、定期换药、加强营养支持等综合治疗,术后恢复良好,创面面积减小,左足跟缺损面积约1 cm×4 cm,少量渗出,基底肉芽组织新鲜,患者出院后继续定期换药。血常规:WBC 8.71×109L-1,Hb 143 g/L,PLT 239×109L-1;生化指标检测:Cr 60.2 μmol/L,ALB 41.1 g/L。出院诊断:(1) 2型糖尿病足病、 左小腿脓肿、 左足脓肿 、左足软组织感染 ;(2)脓毒性休克;(3)慢性心功能不全急性失代偿期 、心功能Ⅳ级;(4)急性肾损伤;(5)重症肺炎、Ⅰ型呼吸衰竭;(6)2型糖尿病伴多个并发症、2型糖尿病性周围神经病、2型糖尿病性视网膜病变;(7)高血压3级(极高危);(8)胰肾联合移植术后;(9)下肢动脉硬化闭塞症。

图1 7月28日患者胸部CT

图2 8月10日患者胸部CT
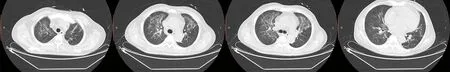
图3 8月17日患者胸部CT
2 讨 论
胰肾联合移植最初主要用于治疗1型糖尿病合并终末期肾病,自从2001年2型糖尿病伴肾衰竭被纳入胰肾联合移植适应证范围[1]。胰肾联合移植已被证明可以显著提高糖尿病合并终末期肾病患者的生活质量,延长其预期寿命[2-3]。成功的胰肾联合移植不仅能治愈糖尿病、终末期肾病,还能延缓甚至逆转糖尿病相关并发症。有研究结果显示,2型糖尿病尿毒症患者胰肾联合移植术后生存时间和移植肾存活时间较单纯肾移植延长,胰肾联合移植在患者预后和并发症控制方面均具有显著优势[4]。绝大多数患者在接受了胰肾联合移植后血糖控制良好,不再需要依赖胰岛素和血液透析,对于其他并发症如大血管病变、外周血管病变可以延缓其进展,但不能逆转已形成的病变[5-6]。糖尿病患者足部组织损伤的风险是由动脉功能不全和周围神经病变共同引起的,糖尿病患者的足部溃疡不能通过肾移植或肾胰腺移植来预防[7]。一项回顾性研究调查了糖尿病肾移植和肾/胰腺联合移植患者足部并发症的风险,结果显示两组患者下肢截肢率和足部骨折率都很高。接受移植前透析的患者移植后截肢的风险更高[8]。
糖尿病足患者因为足部供血不足,常同时伴有严重感染,感染又会进一步加重足部缺血,形成恶性循环,治疗难度大,截肢率高,有些患者甚至需要多次截肢[9]。有研究报道,全球截肢患者中大约70%是因糖尿病足导致的[10]。糖尿病足往往感染严重且常合并下肢血管严重病变,静脉滴注一般剂量抗生素无法在创面端达到有效的血药浓度,而加大抗生素剂量则不良反应显现[11]。抗生素骨水泥在骨科感染中得到广泛应用,其疗效不受局部缺血的影响。抗生素骨水泥通过浓度梯度向周围扩散抗生素,创面的药物浓度远高于全身静脉用药,且作用时间较长,在局部达到治疗感染的目的,同时可减少全身长期用药所引起的不良反应[12-13]。
本例患者行胰肾联合移植术后1年,出现糖尿病足、皮肤软组织感染,因患者移植术后长期服用激素及免疫抑制剂预防器官排异反应,免疫力低下易致感染,发生脓毒症的风险更高。患者在住院治疗过程中疾病进一步加重,出现脓毒症,重症肺炎及多脏器功能不全(呼吸衰竭、急性心力衰竭、急性肾损伤)。治疗方面需要兼顾患者4个方面:(1)加强血药浓度的监测,及时调整免疫抑制方案。(2)控制感染,根据足部分泌物及痰培养等细菌学资料调整抗感染治疗方案,加强创面清创换药,同时加强营养支持,为后期尽早手术创造了条件。(3)早期无创通气改善低氧血症,血液净化联合新活素改善心脏、肾脏功能,精准的容量管理,避免气管插管,同时血液净化及时清除体内炎性介质、代谢废物,保护了移植的肾脏。(4)在患者病情有所稳定后,及时进行手术,脓肿切开清创、持续引流,以及局部抗生素骨水泥填充,对感染的控制起到很大作用,保留了肢体。
糖尿病足患者多数病史较长,常合并多种严重内科疾病,临床工作中需要多学科协作,共同救治。本例患者是1例胰肾联合移植术后的患者,长期服用激素及免疫抑制剂治疗,存在免疫抑制因素,感染难以控制,创面迁延不愈,出现左小腿及左足脓肿,并出现脓毒症、脓毒性休克,导致重要器官功能损伤,病情危重,救治难度大,截肢风险高。前期足科及ICU的积极治疗,全面改善患者的整体状况,为尽早手术治疗创造了条件。骨科尽力保肢,在经历多次手术及术后综合管理,患者病情改善明显,保留了肢体,避免了截肢。本病例经过多学科积极、综合治疗,转逆为顺,免于高位截肢致残,收效甚佳。

