醋酸铵促进烯胺酮的双Michael加成反应研究
叶青青, 陈浩宇, 谢吉娜, 何心伟
(1.滁州城市职业学院 医学院,安徽 滁州 239000; 2.安徽师范大学 化学与材料科学学院,安徽 芜湖 241002)
亲核试剂对α,β-不饱和醛、酮等Michael受体的1,4-共轭加成作为C—X(X=C,N等)键构建的重要方法在有机化学领域得到广泛应用,为重要有机分子或活性药物分子的合成提供了简便途径[1-3].近年来,Michael加成反应因具有强有力的合成能力而备受关注,有机催化的不对称Michael加成反应[4-6]、Michael加成/环化串联反应[7-9]等得到快速发展.此外,利用亲核试剂对前驱体进行双Michael加成反应为不对称合成具有多个立体中心的复杂环状化合物开辟了新途径[10].

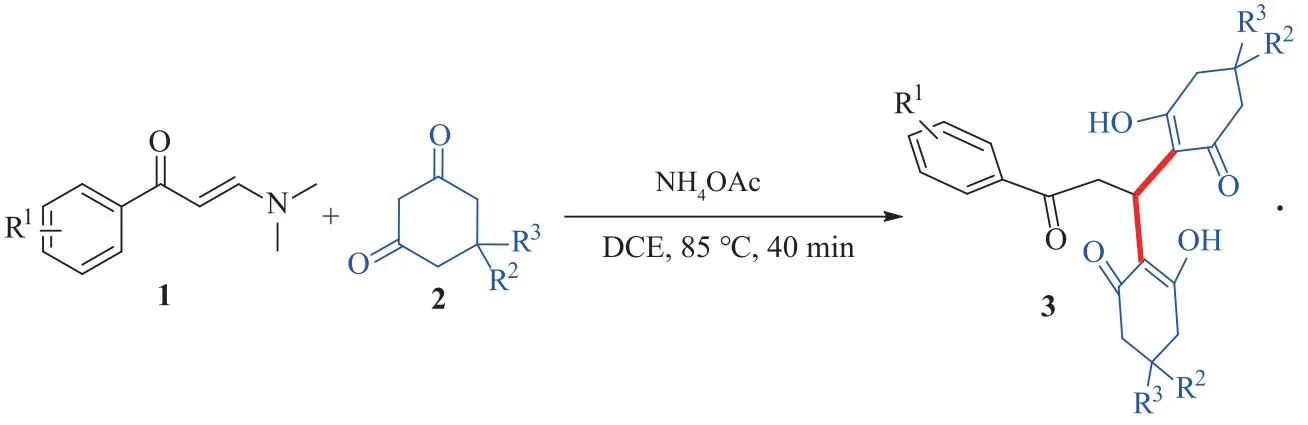
图1 目标化合物的合成路线Fig.1 Synthesis Route of Target Compounds
1 实验部分
1.1 试剂与仪器
BRUKER-AV-300型核磁共振仪(德国布鲁克公司,300 MHz,CDCl3为溶剂,TMS为内标);X-4 数字显示显微熔点测定仪(北京泰克仪器有限公司,温度计未经校正);Agilent 6200 LC/MS TOF 飞行时间质谱仪(美国安捷伦公司).
所用溶剂和试剂均为分析纯.
1.2 目标化合物的合成
称取81 mgN,N-二甲基烯胺酮(0.5 mmol)、112 mg 1,3-环己二酮(1.0 mmol)和57.75 mg醋酸铵(0.75 mmol)加入到装有磁力搅拌子的Schlenk管中,再加入3 mL二氯乙烷并拧紧塞子.随后置于油浴锅中,加热回流反应40 min,利用薄层色谱(TLC)跟踪反应,反应结束后,冷却至室温.浓缩反应液,先用10 mL饱和食盐水洗涤,再分别用10 mL二氯甲烷萃取3次,接着用无水Na2SO4干燥2~3 h,浓缩滤液,最后通过柱层析分离得到目标化合物3a.其他目标化合物可由同样方法制得.
1.3 产物表征数据
3,3-二(2-羟基-6-氧代-4,4-二甲基环己烯-1-基)-1-苯基丙-1-酮(3a):黄色固体,174 mg,收率85 %,熔点132~133 ℃.1HNMR(300 MHz,CDCl3)δ:12.49(s,1H),7.93(d,J=6.9 Hz,2H),7.52(d,J=6.9 Hz,1H),7.44(d,J=6.9 Hz,2H),4.80(s,1H),3.75(d,J=6.6 Hz,2H),2.26(s,8H),1.03(s,6H),0.98(s,6H);13CNMR(75 MHz,CDCl3)δ:198.1,190.5,189.4,136.8,133.0,128.5,128.0,116.4,46.9,46.1,38.6,31.1,29.8,26.3,24.3;IR(KBr)ν:2 947,2 831,2 656,1 679,1 632,1 499,1 335,1 224,1 156,916,745,606;HRMS(APCI) calcd for [C25H30O5+H]+411.198 6,found 411.199 0.
3,3-二(2-羟基-6-氧代-4,4-二甲基环己烯-1-基)-1-(4-甲基苯基)丙-1-酮(3b):黄色固体,182 mg,收率86 %,熔点112~113 ℃.1HNMR(300 MHz,CDCl3)δ:12.50(s,1H),7.83(d,J=7.2 Hz,2H),7.22(d,J=7.2 Hz,2H),4.82(s,1H),3.72(d,J=6.6 Hz,2H),2.39(s,3H),2.26(s,8H),1.03(s,6H),0.98(s,6H);13CNMR(75 MHz,CDCl3)δ:197.3,190.6,189.5,128.3,125.7,125.7,125.6,125.6,116.2,109.9,46.9,46.1,38.9,31.1,29.8,26.3,24.3;IR(KBr)ν:3 012,2 971,2 731,1 665,1 639,1 588,1 468,1 334,1 247,1 115,1 009,979,875,726,658;HRMS(APCI) calcd for [C26H32O5+H]+425.235 1,found 425.235 3.
3,3-二(2-羟基-6-氧代-4,4-二甲基环己烯-1-基)-1-(4-甲氧基苯基)丙-1-酮(3c):黄色固体,180 mg,收率82 %,熔点134~135 ℃.1HNMR(300 MHz,CDCl3)δ:12.49(s,1H),7.90(d,J=7.2 Hz,2H),6.89(d,J=7.2 Hz,2H),4.78(s,1H),3.83(s,3H),3.68(s,2H),2.25(s,8H),0.99(s,12H);13CNMR(75 MHz,CDCl3)δ:196.6,190.4,189.3,163.4,130.3,130.0,116.5,113.6,55.4,46.9,46.1,38.1,31.1,29.7,26.3,24.5;IR(KBr)ν:3 217,3 091,2 916,2 827,2 630,1 699,1 655,1 448,1 268,1 247,1 135,1 024,976,863,691;HRMS(APCI) calcd for [C26H32O6+H]+441.225 7,found 441.225 4.
3,3-二(2-羟基-6-氧代-4,4-二甲基环己烯-1-基)-1-(4-氟苯基)丙-1-酮(3d):黄色固体,194 mg,收率91 %,熔点118~119 ℃.1HNMR(300 MHz,CDCl3)δ:12.47(s,1H),7.96(s,2H),7.10(t,J=7.8 Hz,2H),4.79(t,J=6.0 Hz,1H),3.73(d,J=6.6 Hz,2H),2.26(s,8H),1.03(s,6H),0.97(s,6H);13CNMR(75 MHz,CDCl3)δ:196.5,190.5,189.4,165.7(d,JC-F=252.7 Hz),133.2,130.6(d,JC-F=9.0 Hz),116.3,115.6(d,JC-F=21.7 Hz),46.9,46.1,38.4,31.1,29.7,26.2,24.4;IR(KBr)ν:3 117,3 031,2 816,2 727,2 631,1 659,1 655,1 548,1 456,1 368,1 274,1 235,1 024,978,874,691;HRMS(APCI) calcd for [C25H29FO5+H]+429.198 9,found 429.198 6.
3,3-二(2-羟基-6-氧代-4,4-二甲基环己烯-1-基)-1-(4-溴苯基)丙-1-酮(3e):黄色固体,210 mg,收率86 %,熔点153~154 ℃.1HNMR(300 MHz,CDCl3)δ:12.47(s,1H),7.79(d,J=6.0 Hz,2H),7.58(s,2H),4.78(s,1H),3.72(s,2H),2.26(s,8H),1.03(s,6H),0.97(s,6H);13CNMR(75 MHz,CDCl3)δ:197.2,190.5,189.4,135.5,131.8,129.5,128.2,116.3,46.9,46.1,38.5,31.1,29.8,26.3,24.4;IR(KBr)ν:3 091,3 007,2 816,2 801,2 730,1 700,1 656,1 548,1 368,1 249,1 134,1 124,947,836,611;HRMS(APCI) calcd for [C25H29BrO5+H]+489.120 1,found 489.119 7.
3,3-二(2-羟基-6-氧代-4,4-二甲基环己烯-1-基)-1-(4-三氟甲基苯基)丙-1-酮(3f):黄色固体,203 mg,收率85 %,熔点158~159 ℃.1HNMR(300 MHz,CDCl3)δ:2.46(s,1H),8.06(d,J=7.2 Hz,2H),7.70(d,J=7.2 Hz,2H),4.80(s,1H),3.78(d,J=6.3 Hz,2H),2.27(s,8H),1.04(s,6H),0.98(s,6H);13CNMR(75 MHz,CDCl3)δ:197.3,190.6,189.5,128.3(q,J=25.5 Hz),125.6(q,J=254.4 Hz),116.2,109.99,46.9,46.1,38.9,31.1,29.8,26.3,24.3;IR(KBr)ν:2 936,2 846,2 651,1 691,1 553,1 432,1 345,1 279,1 171,1 054,997,864,715;HRMS(APCI) calcd for [C26H29F3O5+H]+479.201 7,found 479.202 0.
3,3-二(2-羟基-6-氧代-4,4-二甲基环己烯-1-基)-1-(3-氯苯基)丙-1-酮(3g):黄色固体,191 mg,收率86 %,熔点127~128 ℃.1HNMR(300 MHz,CDCl3)δ:12.47(s,1H),7.89(s,1H),7.81(d,J=7.2 Hz,1H),7.51(d,J=7.2 Hz,1H),7.38(t,J=7.2 Hz,1H),4.77(t,J=6.0 Hz,1H),3.73(d,J=6.6 Hz,2H),2.27(s,8H),1.04(s,6H),0.99(s,6H);13CNMR(75 MHz,CDCl3)δ:196.8,190.5,189.4,138.3,134.9,133.0,129.9,128.0,126.1,116.3,46.9,46.1,38.8,31.1,29.7,26.3,24.3;IR(KBr)ν:2 893,2 886,2 613,1 678,1 551,1 539,1 399,1 228,1 165,1 108,905,767,649;HRMS(APCI) calcd for [C25H29ClO5+H]+445.177 6,found 445.177 8.
3,3-二(2-羟基-6-氧代-4,4-二甲基环己烯-1-基)-1-(3-溴苯基)丙-1-酮(3h):黄色固体,207 mg,收率85 %,熔点118~119 ℃.1HNMR(300 MHz,CDCl3)δ:12.46(s,1H),8.04(s,1H),7.86(d,J=7.2 Hz,1H),7.67(d,J=7.2 Hz,1H),7.34~7.29(m,1H),4.77(s,1H),3.72(d,J=6.3 Hz,1H),2.27(s,8H),1.04(s,6H),0.99(s,6H);13CNMR(75 MHz,CDCl3)δ:196.8,190.5,189.4,138.5,135.9,130.2,126.5,122.9,116.3,46.8,46.1,38.7,31.11,29.8,26.3,24.3;IR(KBr)ν:2 931,2 816,2 789,1 691,1 576,1 443,1 368,1 243,1 109,1 088,907,767,649;HRMS(APCI) calcd for [C25H29BrO5+H]+489.120 3,found 489.119 9.
3,3-二(2-羟基-6-氧代-4-甲基环己烯-1-基)-1-苯基丙-1-酮(3i):黄色固体,158 mg,收率83 %,熔点109~110 ℃.1HNMR(300 MHz,CDCl3)δ:12.86(s,1H),7.92(d,J=6.6 Hz,2H),7.52(d,J=6.6 Hz,1H),7.44(d,J=6.9 Hz,2H),4.76(s,1H),3.72(d,J=6.3 Hz,2H),2.64~2.43(m,4H),2.35~2.14(m,2H),2.14~1.87(m,4H),1.01(s,6H);13CNMR(75 MHz,CDCl3)δ:198.1,191.9,190.7,136.8,133.0,128.5,128.0,117.3,41.6,40.9,38.9,38.7,27.4,24.6,24.5,20.5;IR(KBr)ν:2 999,2 847,2 676,1 690,1 663,1 599,1 501,1 488,1 326,1 247,1 154,965,823,773,689;HRMS(APCI) calcd for [C23H26O5+H]+383.167 8,found 383.168 2.
3,3-二(2-羟基-6-氧代-4-甲基环己烯-1-基)-1-(4-甲基苯基)丙-1-酮(3j):黄色固体,170 mg,收率86 %,熔点109~110 ℃.1HNMR(300 MHz,CDCl3)δ:12.86(s,1H),7.82(d,J=6.9 Hz,2H),7.22(d,J=6.6 Hz,2H),4.76(s,1H),3.68(d,J=7.2 Hz,2H),2.65~2.38(m,7H),2.24~2.13(m,2H),2.02~1.86(m,4H),1.01(s,6H);13CNMR(75 MHz,CDCl3)δ:197.7,191.8,190.6,143.8,134.1,129.2,128.1,117.4,41.6,40.9,38.7,38.6,27.5,27.4,24.6,24.5,21.6,20.4;IR(KBr)ν:3 324,3 016,2 901,2 784,2 731,1 696,1 559,1 474,1 318,1 245,1 185,1 103,974,862,689;HRMS(APCI) calcd for [C24H28O5+H]+397.194 5,found 397.194 2.
3,3-二(2-羟基-6-氧代-4-甲基环己烯-1-基)-1-(4-甲氧基苯基)丙-1-酮(3k):黄色固体,162 mg,收率79 %,熔点119~120 ℃.1HNMR(300 MHz,CDCl3)δ:12.86(s,1H),7.91(d,J=8.1 Hz,2H),6.90(d,J=8.1 Hz,2H),4.76(s,1H),3.85(s,3H),3.66(d,J=6.3 Hz,2H),2.62~2.46(m,4H),2.34~2.24(m,2H),2.16~1.85(m,4H),1.01(s,6H);13CNMR(75 MHz,CDCl3)δ:196.6,191.8,190.6,163.4,130.2,130.0,117.4,113.5,55.4,41.6,40.9,38.4,38.2,27.4,24.8,24.7,20.4;IR(KBr)ν:3 271,3 191,3 016,2 847,2 637,1 699,1 675,1 538,1 468,1 374,1 315,1 125,1 003,963,895,681;HRMS(APCI) calcd for [C24H28O6+H]+413.167 6,found 413.167 6.
3,3-二(2-羟基-6-氧代-4-甲基环己烯-1-基)-1-(4-氟基苯基)丙-1-酮(3l):黄色固体,178 mg,收率89 %,熔点125~126 ℃.1HNMR(300 MHz,CDCl3)δ:12.84(s,1H),7.94(s,1H),7.09(t,J=8.1 Hz,2H),4.74(s,1H),3.69~3.66(m,2H),2.64~2.43(m,4H),2.35~2.14(m,2H),2.02~1.82(m,4H),1.01(s,6H);13CNMR(75 MHz,CDCl3)δ:196.5,191.9,190.7,165.7(d,JC-F=253.5 Hz),133.2,130.6(d,JC-F=9.7 Hz),117.2,115.7(d,JC-F=21.7 Hz),41.6,40.9,38.7,38.6,29.6,27.5,27.4,24.6,24.5,20.4;IR(KBr)ν:3 213,2 991,2 916,2 727,2 531,1 703,1 659,1 648,1 568,1 547,1 335,1 024,996,873,655;HRMS(APCI) calcd for [C23H25FO5+H]+401.170 1,found 401.169 9.
3,3-二(2-羟基-6-氧代-4-甲基环己烯-1-基)-1-(4-溴苯基)丙-1-酮(3m):黄色固体,193 mg,收率84 %,熔点129~130 ℃.1HNMR(300 MHz,CDCl3)δ:12.83(s,1H),7.79(d,J=7.8 Hz,2H),7.57(d,J=8.1 Hz,2H),4.74(s,1H),3.68(d,J=6.6 Hz,2H),2.68~2.43(m,4H),2.24~2.13(m,2H),2.02~1.90(m,4H),1.02(s,6H);13CNMR(75 MHz,CDCl3)δ:197.1,191.9,190.7,135.5,131.8,129.5,128.2,117.2,41.6,40.9,38.8,38.6,29.7,27.5,27.4,24.6,24.5,20.4;IR(KBr)ν:3 217,3 119,3 011,2 782,2 630,1 694,1 565,1 544,1 368,1 257,1 235,1 124,1 083,865,676;HRMS(APCI) calcd for [C23H25BrO5+H]+461.097 5,found 461.097 9.
3,3-二(2-羟基-6-氧代-4-甲基环己烯-1-基)-1-(3-溴苯基)丙-1-酮(3n):黄色固体,193 mg,收率84 %,熔点142~143 ℃.1HNMR(300 MHz,CDCl3)δ:12.83(s,1H),8.03(s,1H),7.84(d,J=7.5 Hz,1H),7.66(d,J=6.9 Hz,1H),7.34~7.29(m,1H),4.72(s,1H),3.79(d,J=6.6 Hz,2H),2.61~2.36(m,4H),2.35~2.15(m,2H),2.15~1.90(m,4H),1.02(s,6H);13CNMR(75 MHz,CDCl3)δ:196.8,192.0,190.7,135.9,131.0,130.2,126.5,122.9,117.2,41.6,40.9,39.0,38.9,29.8,27.5,27.4,24.6,24.5,20.4;IR(KBr)ν:2 916,2 866,2 734,1 668,1 543,1 461,1 312,1 308,1 244,1 178,1 093,944,767,656;HRMS(APCI) calcd for [C23H25BrO5+H]+461.097 7,found 461.098 1.
3,3-二(2-羟基-6-氧代环己烯-1-基)-1-苯基丙-1-酮(3o):黄色固体,141 mg,收率80 %,熔点98~99 ℃.1HNMR(300 MHz,CDCl3)δ:12.90(s,1H),7.93(d,J=6.9 Hz,2H),7.53~7.43(m,3H),4.78(s,1H),3.73(d,J=6.0 Hz,2H),2.54~2.32(m,8H),1.86~1.78(m,2H);13CNMR(75 MHz,CDCl3)δ:198.2,192.0,190.9,136.8,133.0,128.5,128.0,117.6,39.0,33.3,32.6,24.7,19.9;IR(KBr)ν:3 065,2 974,2 701,1 685,1 609,1 548,1 478,1 347,1 251,1 095,990,871,762,684;HRMS(APCI) calcd for [C21H22O5+H]+355.158 7,found 355.159 0.
3,3-二(2-羟基-6-氧代环己烯-1-基)-1-(4-甲基苯基)丙-1-酮(3p):黄色固体,156 mg,收率85 %,熔点97~98 ℃.1HNMR(300 MHz,CDCl3)δ:12.90(s,1H),7.83(d,J=7.5 Hz,2H),7.23(d,J=7.5 Hz,2H),4.79(s,1H),3.70(d,J=6.3 Hz,2H),2.54~2.27(m,11H),1.99~1.69(m,4H);13CNMR(75 MHz,CDCl3)δ:197.8,192.0,190.9,143.8,134.4,129.2,128.1,117.7,38.8,33.3,32.6,24.7,21.6,19.8;IR(KBr)ν:3 189,3 062,2 961,2 901,2 631,1 657,1 499,1 448,1 368,1 352,1 217,1 145,1 092,919,889,674;HRMS(APCI) calcd for [C22H24O5+H]+369.153 1,found 369.153 6.
3,3-二(2-羟基-6-氧代环己烯-1-基)-1-(4-氟苯基)丙-1-酮(3q):黄色固体,148 mg,收率80 %,熔点103~104 ℃.1HNMR(300 MHz,CDCl3)δ:12.88(s,1H),8.06~7.87(m,2H),7.13~7.08(m,2H),4.78(s,1H),3.70(d,J=6.0 Hz,2H),2.55~2.28(m,8H),2.04~1.63(m,4H);13CNMR(75 MHz,CDCl3)δ:196.6,192.1,190.9,165.7(d,JC-F=252.7 Hz),133.3,130.6(d,JC-F=25.7 Hz),133.3,130(d,JC-F=9.7 Hz),117.6,115.7(d,JC-F=21.7 Hz),38.9,33.3,32.6,24.7,19.8;IR(KBr)ν:3 117,3 071,2 916,2 872,2 634,1 691,1 654,1 438,1 374,1 368,1 253,1 224,1 176,937,791,659;HRMS(APCI) calcd for [C21H21FO5+H]+373.154 3,found 373.154 7.
3,3-二(2-羟基-6-氧代环己烯-1-基)-1-(4-溴苯基)丙-1-酮(3r):黄色固体,181 mg,收率84 %,熔点101~102 ℃.1HNMR(300 MHz,CDCl3)δ:12.87(s,1H),7.79(d,J=7.5 Hz,2H),7.5(d,J=7.2 Hz,2H),4.77(s,1H),3.69(d,J=6.0 Hz,2H),2.55~2.32(m,4H),1.88~1.78(m,4H);13CNMR(75 MHz,CDCl3)δ:197.1,192.1,190.9,135.5,131.8,129.5,128.2,117.5,38.9,33.3,32.6,24.7,19.8;IR(KBr)ν:2 986,2 936,2 631,1 648,1 563,1 471,1 339,1 218,1 137,1 098,871,853;HRMS(APCI) calcd for [C21H21BrO5+H]+433.060 2,found 433.060 2.
3,3-二(2-羟基-6-氧代环己烯-1-基)-1-(3-溴苯基)丙-1-酮(3s):黄色固体,177 mg,收率82 %,熔点120~121 ℃.1HNMR(300 MHz,CDCl3)δ:12.87(s,1H),8.04(s,1H),7.85(d,J=7.8 Hz,1H),7.67(d,J=6.9 Hz,1H),7.33(d,J=6.9 Hz,1H),4.75(s,1H),3.70(d,J=6.3 Hz,2H),2.56~2.17(m,8H),2.00~1.66(m,4H);13CNMR(75 MHz,CDCl3)δ:196.8,192.2,190.9,135.9,131.0,130.1,126.5,122.9,117.5,39.1,33.3,32.6,24.6,19.8;IR(KBr)ν:3 016,2 976,2 866,1 654,1 604,1 564,1 551,1 477,1 340,1 253,1 201,1 118,1 062,967,867,748,659;HRMS(APCI) calcd for [C21H21BrO5+H]+433.060 4,found 433.060 1.
2 结果与讨论
2.1 反应条件优化
为了优化合成目标产物3a的反应条件,以N,N-二甲基烯胺酮(1a)和5,5-二甲基-1,3-环己二酮(2a)为模板底物,分别考察了碱、溶剂、反应温度和反应时间对该反应的影响,结果见表1.
2.1.1 碱的选择
以1,2-二氯乙烷(DCE)为溶剂,在85 ℃、反应时间为60 min的条件下,考察了碱的类型对3a产率的影响.结果表明:当使用三乙烯二胺(DABCO)时,反应很难进行,仅检测到痕量的3a(见表1编号1);使用不同卤化铵(NH4Cl,NH4Br,NH4I)时,3a的产率分别为33 %,36 %,35 %(见表1编号2~4);使用碳酸铵或醋酸铵时,3a的产率明显提高,分别为75 %,81 %(见表1编号5,6).进一步对醋酸铵的用量进行了考察.与编号6相比,降低或增加醋酸铵的用量,3a的产率(45 %,48 %,78 %)均没有增加(见表1编号7~9).研究还发现,当使用其他醋酸盐(如醋酸钠、醋酸钾)作碱时,仅能以63 %和53 %的产率得到3a(见表1编号10,11).
2.1.2 反应溶剂的选择
以醋酸铵(0.75 mmol)为碱,在85 ℃、反应时间为60 min的条件下,对反应溶剂进行筛选.与1,2-二氯乙烷作溶剂时相比,溶剂为甲苯、1,4-二氧六环、四氢呋喃(THF)、乙醇、二氯甲烷(DCM)、水时,3a的产率均明显降低,分别为33 %,35 %,23 %,45 %,31 %,47 %(见表1编号12~17).
2.1.3 反应温度和反应时间的选择
采用最佳的醋酸铵用量,以1,2-二氯乙烷为溶剂,反应时间为60 min,研究反应温度对3a产率的影响.结果显示,降低温度对反应不利,当反应温度降至45,60 ℃时,3a的产率明显降低,分别为37 %,67 %(见表1编号18,19).在最佳反应温度下,缩短反应时间至20,40,50 min时,3a的产率分别为44 %,82 %,81 %(见表1编号20~22);延长反应时间至80 min时,3a的产率略有降低,为76 %(见表1编号23).
因此,确定该反应的最优条件为:将0.75 mmol的醋酸铵作碱,1,2-二氯乙烷作溶剂,85 ℃下回流反应40 min(见表1编号21).
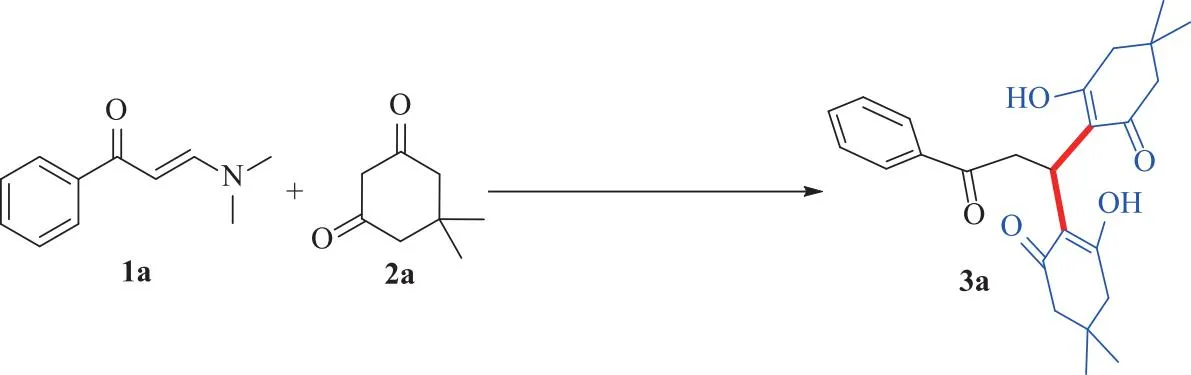
表1 反应条件的优化aTab.1 Optimization of the Reaction Conditions
2.2 反应底物的普适性
在最优反应条件下,进一步对反应底物的普适性进行了探究,结果如图2所示.首先以5,5-二甲基-1,3-环己二酮(2a)为底物,考察了N,N-二甲基烯胺酮(1)中苯环上取代基的电子效应和空间位阻效应对反应的影响.结果显示,当苯环对位上连有中等强度的供电子基团(-Me)或吸电子基团(-F,-Br)时,目标产物的产率均能保持,3b,3d,3e的产率分别为81 %,86 %,85 %.当苯环对位上连有强供电子基团(-OMe)或强吸电子基团(-CF3)时,产物3c,3f的产率分别为75 %,81 %.当苯环间位上连有取代基(—Cl,—Br)时,该反应也能很好地进行,3g,3h的产率分别为86 %,85 %.此外,分别以5-甲基-1,3-环己二酮和1,3-环己二酮为底物,在标准条件下与各种取代的N,N-二甲基烯胺酮(1)反应得到3,3-二环己烯基-1-苯基丙酮衍生物(3i~3s),产率为74 %~86 %.同样地,目标产物的产率不受底物取代基的电子效应和空间位阻效应的影响.为了确认产物的结构,对化合物3f进行了X射线单晶衍射表征,进一步确证了目标产物的结构.

图2 目标化合物3a~3s的分子结构及3f的晶体结构Fig.2 The Molecular Structures of Product 3a~3s and Crystal Structure of 3f
2.3 反应机理
根据实验结果和文献调研[21-23],以目标产物3a的合成为例,对该反应提出了一种可能的机理,如图3所示.5,5-二甲基-1,3-环己二酮(2a)在醋酸铵的作用下发生烯醇异构化生成中间体A,中间体A对N,N-二甲基烯胺酮(1a)进行Michael加成反应得到中间体B.由于氨基是一种较好的离去基团,中间体B在醋酸铵的作用下发生β-消除反应离去二甲胺而生成中间体C.中间体A继续与中间体C发生Michael加成反应得到目标产物3a.

图3 可能的反应机理Fig.3 A Possible Reaction Mechanism
3 结 论
发展了一种在醋酸铵作用下取代的1,3-环己二酮对取代的N,N-二甲基烯胺酮的双Michael加成反应,合成了一系列结构新颖的3,3-二环己烯基-1-苯基丙酮类化合物.该反应在40 min内能够以优异收率得到目标产物,且所需原料廉价易得,实验操作简单,在有机合成中具有潜在的应用价值.

