磁共振增强T1 mapping和IVIM-DWI技术评估乙型肝炎肝硬化患者肝脏储备功能价值研究*
穆玉娟,吴斐斐,陈 莹
乙型肝炎肝硬化是由乙型肝炎病毒(HBV)持续感染引起的肝脏持续性炎症性疾病。由于肝细胞长期损伤,导致肝纤维化和肝硬化[1]。肝硬化可分为代偿期肝硬化和失代偿期肝硬化,后者是在肝硬化的基础上出现了并发症,如门静脉高压症引起的腹水、肝性脑病和上消化道出血等[2]。如果慢性乙型肝炎(CHB)引起的肝硬化未得到有效的治疗,其患失代偿期肝硬化和肝癌的风险就会大大增加[3]。由于肝癌不容易在早期发现,大多数肝癌在被发现时已经是晚期,这时临床治疗效果有限。手术切除和肝移植是治疗肝癌的最有效方法,但术后一系列并发症很容易危害患者的生命安全。因此,术前评估肝脏储备功能是预防肝叶切除术后肝衰竭发生的一个重要的步骤[4]。有研究显示,钆塞酸二钠(gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid,Gd-EOB-DTPA)的代谢方式与吲哚菁绿相似,也被用于临床评估肝储备功能[5]。使用T1 mapping技术绘制T1图像可以更可靠地测量T1弛豫时间,反映肝细胞Gd-EOB-DTPA浓度,从而有效评估肝细胞摄取Gd-EOB-DTPA的能力[6]。然而,这两种技术都需要向体内注射药物,临床上需要一种更方便、更经济的技术方法评估肝脏储备功能。目前,体素内不相干运动(intravoxel incoherent motion,IVIM)扩散加权成像(diffusion weighted imaging,DWI)是唯一可以在不注射造影剂的情况下评估活体肝脏组织灌注状态的功能性磁共振成像(MRI)检查方法[7]。本研究旨在分析应用IVIM-DWI和磁共振增强T1 mapping技术评估了乙型肝炎肝硬化患者肝脏储备功能的价值,现报道如下。
1 资料与方法
1.1 病例来源 2020年3月~2022年3月我院收治的乙型肝炎肝硬化患者60例,男性40例,女性20例;年龄为40~56岁,平均年龄为(48.6±2.1)岁。乙型肝炎肝硬化诊断符合《肝硬化诊治指南》[8]的标准。纳入标准:①有慢性乙型肝炎病史;②超声检查有疑似肝内局部病灶;③在磁共振检查前1周内进行过吲哚菁绿潴留试验。排除标准:①合并甲型肝炎或戊型肝炎;②肝内结节性病灶直径在10 cm以上。本研究经我院医学伦理委员会审核、通过,患者签署知情同意书。
1.2 吲哚菁绿滞留试验 禁食6~8 h,排空尿液和粪便。使用肝脏功能储备分析仪,输入患者身高、体质量和血红蛋白,将探头连接到患者的手指上,配制浓度为0.5 mg.kg-1的吲哚菁绿溶液,经尺静脉建立输液通道,以均匀的速度注射。患者取仰卧位,休息15 min,设备自动计算并记录15 min吲哚菁绿滞留率。吲哚菁绿15 min滞留率<30%被定义为肝脏储备功能良好,吲哚菁绿15 min滞留率≥30%被定义为肝功能受损。
1.3 MRI检查 使用荷兰Philips 3.0 T超导多源MR机和16通道腹部线圈。患者禁食6 h,并进行呼吸练习。在增强前和增强后20 min,使用改良的Look-Locker反转恢复扫描序列获取T1图像。扫描参数:重复时间 370 ms,回波时间 1.0 ms,TI 275.0 ms,视野340.0 mm×290.0 mm,矩阵124×192,层厚8 mm,激发次数1,翻转角度35°。多值轴向扩散加权序列在增强后20 min前使用荷兰Philips 3.0 T进行扫描。扫描参数:重复时间 5400 ms,回波时间 68 ms,视野256 mm×296 mm,矩阵256×256,层厚5 mm,层间间距1 mm,激发次数2。b值取0、50、100、150、200、300、500、800、1000、1200 s/mm2。计算每张图像平均T1弛豫时间,以测量Gd-EOB-DTPA增强前20 min和20 min后的T1弛豫时间,计算肝细胞增强分数。将获得的T1WI图像和具有多个b值的原始弥散加权图像传输至第三方后处理软件Mltalytics 1.0.1(Fitpu Healthcare),所有数据由2名高级影像学医师分别测量。再由该软件根据单指数模型和双指数模型自动测算IVIM-DWI参数,包括表观扩散系数(apparent diffusion coefficient,ADC)和真性水分子扩散系数(true water molecule diffusion coefficient,D)。

2 结果
2.1 肝功能情况 根据吲哚菁绿15 min滞留率,在60例肝硬化患者中,A组30例吲哚菁绿15 min滞留率<10%,B组16例吲哚菁绿15 min滞留率≥10%但<30%,C组14例吲哚菁绿15 min滞留率≥30%。
2.2 肝硬化患者腹部MRI表现 见图1。
2.3不同吲哚菁绿组T1 mapping参数比较 C组增强前20 min T1弛豫时间和增强后20 min T1弛豫时间显著长于A组或B组,差异具有统计学意义(P<0.05);C组肝细胞增强分数显著低于A组或B组,差异具有统计学意义(P<0.05);在IVIM-DWI后处理参数方面,C组ADC和D均显著低于A组或B组,差异具有统计学意义(P<0.05,表1)。
图1 乙型肝炎肝硬化患者腹部MRI表现 男性46岁A:T2WI显示肝实质信号略增高;B:DWI可见肝组织不均匀信号
2.4 各参数评估硬化患者肝脏储备功能的效能情况 经ROC曲线分析显示,增强前20 min T1弛豫时间、增强后20 min T1弛豫时间、ADC、D和肝细胞增强分数评估乙型肝炎肝硬化患者肝脏储备功能均具有较高的价值(表2、图2)。

表1 不同吲哚菁绿组T1 mapping参数比较
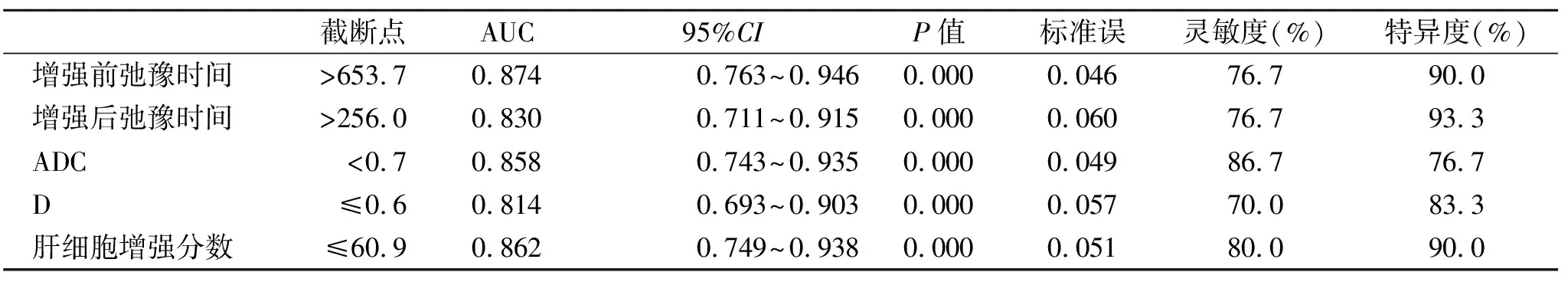
表2 各参数评估硬化患者肝脏储备功能的效能情况
3 讨论
研究结果显示,正常肝脏切除的极限是保留肝脏体积不小于标准肝脏体积的25%~30%。对于无门脉高压征象的Child-Pugh A级患者,吲哚菁绿15 min滞留率<10%,保留肝脏体积不小于标准肝脏体积的40%~50%;吲哚菁绿15 min滞留率在10%~20%,保留肝脏体积不小于标准肝脏体积的60%~70%;吲哚菁绿15 min滞留率在21%~30%,预留肝脏体积不小于标准肝脏体积的70%~80%。Child-Pugh A级和B级患者有门脉高压征象或吲哚菁绿15 min滞留率>30%者,只能进行限量肝叶切除术,而Child-Pugh C级患者禁忌任何肝叶切除术[9]。
Gd-EOB-DTPA增强的磁共振成像目前是肝脏肿瘤术前成像的标准化技术,Gd-EOB-DTPA的代谢方式与吲哚菁绿相似,其扫描参数能够反映肝脏储备功能[10-12]。IVIM-DWI在不注射造影剂的情况下能够提供肝脏微循环灌注信息,其真实的扩散系数值反映了体素中的扩散以及每个体素的毛细血管流动的血液对信号的贡献,而在乙型肝炎肝硬化患者,由于肝脏灌注量减少,肝细胞功能受到日益严重的纤维化的影响,应用肝脏IVIM-DWI参数评估肝脏储备功能也会随之受到影响[13]。以吲哚菁绿15 min滞留率作为参考,比较这两种技术的诊断效果,将有助于验证IVIM-DWI参数评估肝脏储备功能方面的价值。
本研究结果显示,在T1 mapping后处理所得参数中,A组增强前20 min T1弛豫时间和增强后20 min T1弛豫时间显著短于B组和C组,肝细胞增强分数显著高于B组和C组。在IVIM-DWI后处理所得参数中,A组ADC和D显著高于B组和C组。在早期肝纤维化的组织重塑过程中,由于炎症和组织水肿导致肝脏含水量增加,使T1弛豫时间延长不明显。然而,在肝纤维化后期,由于炎症和组织水肿导致的T1松弛时间的延长被缩短的T1松弛时间的顺磁性大分子的沉积所抵消。由于肝细胞数量减少和肝细胞膜表面有机阴离子转运体多肽1表达减少,都会降低肝脏对Gd-EOB-DTPA的摄取,导致肝脏在肝胆期的T1松弛时间延长[14]。肝纤维化引起的细胞外基质(尤其是胶原纤维)的过度合成,减少了细胞外空间,限制了水分子的扩散,导致肝脏内ADC值降低。与健康人比,肝脏各叶的真实扩散系数明显降低,并与Child-Pugh分级呈负相关,应用肝脏右叶的真实扩散系数对肝硬化的诊断最为准确[15]。
本研究经ROC曲线分析显示,增强前后20 min T1弛豫时间、ADC、D和肝细胞增强分数评估乙型肝炎肝硬化患者肝脏储备功能均具有较高的应用价值。Gd-EOB-DTPA的吸收是由肝细胞膜表面的有机阴离子转运肽介导的[16]。注射后20 min,其吸收达到峰值,约50%被吸收到肝细胞内,然后通过多药耐药性相关蛋白-2排泄到胆道系统吸。收和排泄过程未发生代谢变化[17]。肝硬化可能导致钆酸二钠盐的摄取减少[18]。通过增强前和增强后T1图谱序列测量的T1 mapping弛豫时间减少程度是诊断早期肝硬化的有效工具,并显示增强前20 min T1弛豫时间会随着肝硬化严重程度的加重而缩短[19,20]。

