羊草种子胚性组织培养高频再生体系的研究
王英哲,徐 博,张 玲,牟书靓,徐安凯*
(1.吉林省农业科学院,吉林 长春 130033; 2.吉林农业大学林学与草学学院,吉林 长春 130118)
羊草(Leymuschinensis)又称碱草,隶属禾本科赖草属,主要分布于我国东北平原、华北平原以及黄土高原等地[1],是一种优质高产的禾本科牧草和生态草,具有抗寒、抗旱、耐盐碱、耐践踏等优点[2-4],也是我国唯一出口创汇的禾本科牧草。羊草对我国生态环境保护、发展人工草地建设、修复退化草地改良、发展草原畜牧业等方面具有重要作用[5-6]。由于我国羊草草原管理的缺失及羊草自身的“三低”问题,严重制约了羊草资源开发与利用。因此,通过生物技术手段培育羊草优良品种,强化人工栽培驯化将成为加快羊草育种进程的有效途径之一[7]。
从20世纪80年代开始,羊草组织培养的研究取得很多发展,已建立起以种子、幼穗等作为外植体的植株再生体系[8-11]。幼穗作为外植体虽然可获得较高的愈伤诱导率,但成本高、耗时久且受季节限制等缺点;而种子容易储存,取材方便,周年可用,却存在外植体消毒困难、胚性愈伤组织少以及植株再生频率不稳定等问题。因此,优化羊草种子愈伤组织诱导再生体系,提高胚性愈伤组织诱导分化频率,对奠定羊草的遗传转化及生物技术育种的研究基础具有重大意义。
本研究以羊草种子为外植体,对外植体处理、组培污染率控制、改善愈伤组织生长状态,提高其分化能力等方面进行研究,寻找适合以成熟种子为外植体的诱导培养基和分化培养基,打破幼穗和幼胚的季节性限制,随时获得具有高频再生能力的愈伤组织,同时利用分子标记技术,在DNA水平上对再生植株进行遗传变异分析,为羊草分子育种与遗传改良提供技术支持。
1 材料与方法
1.1 材料
本试验材料为‘吉农1号’羊草,‘吉生1号’羊草和白城野生羊草,种子由吉林省农业科学院农业生物技术研究所保存。
1.2 方法
1.2.1外植体的前处理 取成熟、完整、饱满的羊草种子(‘吉农1号’羊草,‘吉生1号’羊草和‘白城野生’羊草),进行人工去稃处理(未处理的种子作对照CK),放在75%酒精浸泡5 min,0.1%升汞溶液震荡10 min,分别接种于MS培养基中。每个处理设6个培养皿,每皿25粒种子,3个重复,7 d后统计两组处理方式外植体的污染率。
选择外植体污染率低的处理方式对供试材料种子进行处理,用100 mg·L-1赤霉素(GA3)浸泡24 h(未使用GA3浸泡作对照CK)。放在75%酒精浸泡5 min,0.1%升汞溶液震荡10 min,分别接种于诱导培养基(MS+2.0 mg·L-12,4-D)中。每个处理设6个培养皿,每皿25粒种子,3个重复,40 d后统计愈伤组织出愈率。
1.2.2愈伤组织诱导及继代培养 将处理后的外植体接种于愈伤组织诱导培养基上,培养基配方:MS+2,4-D(1.0 mg·L-1);MS+2,4-D(1.0 mg·L-1)+KT(0.5 mg·L-1);MS+2,4-D(1.0 mg·L-1)+KT(1.0 mg·L-1);MS+2,4-D(2.0 mg·L-1);MS+2,4-D(2.0 mg·L-1)+KT(0.5 mg·L-1);MS+2,4-D(2.0 mg·L-1)+KT(1.0 mg·L-1);MS+2,4-D(3.0 mg·L-1);MS+2,4-D(3.0 mg·L-1)+KT(0.5 mg·L-1);MS+2,4-D(3.0 mg·L-1)+KT(1.0 mg·L-1);MS+2,4-D(5.0 mg·L-1),以上培养基均添加3%蔗糖和0.7%琼脂,pH=5.8,每份培养基接种外植体25粒,每份培养基设置3个重复,置于(25±1)℃培养箱内进行暗培养,期间换1~2次培养基。40 d后统计外植体的出愈率。
在出愈率最高的激素配比的诱导培养基中培养40 d的愈伤组织转移至继代培养基上,每份培养基放置10块愈伤组织,每份培养基设置3个重复,置于(25±1)℃培养箱内进行暗培养,每15天继代1次,观察愈伤组织状态。
1.2.3愈伤组织的分化及植株再生 将继代生长状态良好的愈伤组织,转置到分化培养基上,培养基配方:MS+6-BA(0.1 mg·L-1);MS+6-BA(0.5 mg·L-1)+NAA(0.5 mg·L-1);MS+6-BA(0.5 mg·L-1)+NAA(1.0 mg·L-1);MS+6-BA(1.0 mg·L-1);MS+6-BA(1.0 mg·L-1)+NAA(0.5 mg·L-1);MS+6-BA(1.0 mg·L-1)+NAA(1.0 mg·L-1);MS+6-BA(2.0 mg·L-1);MS+NAA(1.0 mg·L-1),以上培养基均添加3%蔗糖和0.7%琼脂,pH=5.8,每份培养基接种愈伤块14粒,每份培养基设置5个重复,(25±1)℃光照培养 16 h,(20±1)℃暗培养 8 h,光照强度2 000 lx,30 d后统计愈伤组织的分化率。
1.2.4生根与再生植株的移栽 将分化培养中培养30 d后再生芽转至生根培养基中,生根培养基为1/2MS+3%蔗糖+0.7%琼脂,培养2~3周,待幼苗生长至 15 cm时,打开瓶盖,室内炼苗 3~5 d,洗净根部的培养基移栽至花钵中(营养土∶蛭石=1∶1)。15~20 d后统计植株的成活率。
1.2.5基因组DNA的提取及ISSR检测 以培养的羊草无菌苗为材料,选用17条ISSR引物(上海生工合成)进行PCR梯度扩增。选取9株羊草再生植株(3份不同基因型供试材料中每个基因型随机选3株),1株栽培羊草植株作对照,利用Omega试剂盒提取叶片DNA,共设置3次重复。PCR反应程序为:94℃预变性1 min,94℃变性1 min,36℃退火1 min,72℃延伸2 min,35个循环,72℃延伸10 min,4℃下保存。取5 μL的PCR扩增产物,在2%的琼脂糖凝胶电泳检测。ISSR反应采用10 μL体系:10×Buffer 1 μL,dNTP 0.2 μL,Primer 4 μL,Taq polymerase 0.2 μL,ddH2O 3 μL,模板DNA 1 μL。
1.3 数据统计分析
外植体污染率=外植体受污染数/接种外植体总数×100%;
愈伤组织诱导率=诱导出的愈伤组织数/接种外植体总数×100%;
愈伤组织分化率=有不定芽的愈伤组织数/接种的愈伤组织数×100%;
成活率=存活的幼苗数/移栽的幼苗数×100%。
对各数据采用Excel进行处理和制作图表,SPSS进行统计分析和显著性测验。
2 结果与分析
2.1 种子去稃处理对外植体污染的影响
羊草种子外稃内的污染物寄存大量细菌和真菌,难以彻底杀灭,成为组培过程中难于控制的问题[12],严重影响后续试验的正常进行。统计结果表明,无论是栽培品吉农、吉生系列,还是白城野生材料的种子,直接用未处理的完整种子作为外植体在愈伤组织诱导过程中的污染率在57.56%~65.33%之间,平均污染率为60.89%;而人工去稃后的种子,采用相同的消毒处理方法,污染率均在5%以下;同一品种的种子,两组处理方式之间差异极显著(P<0.01)。由此可见去稃的羊草种子能明显降低组培过程中外植体的污染,从而提高羊草离体的再生频率(表1)。
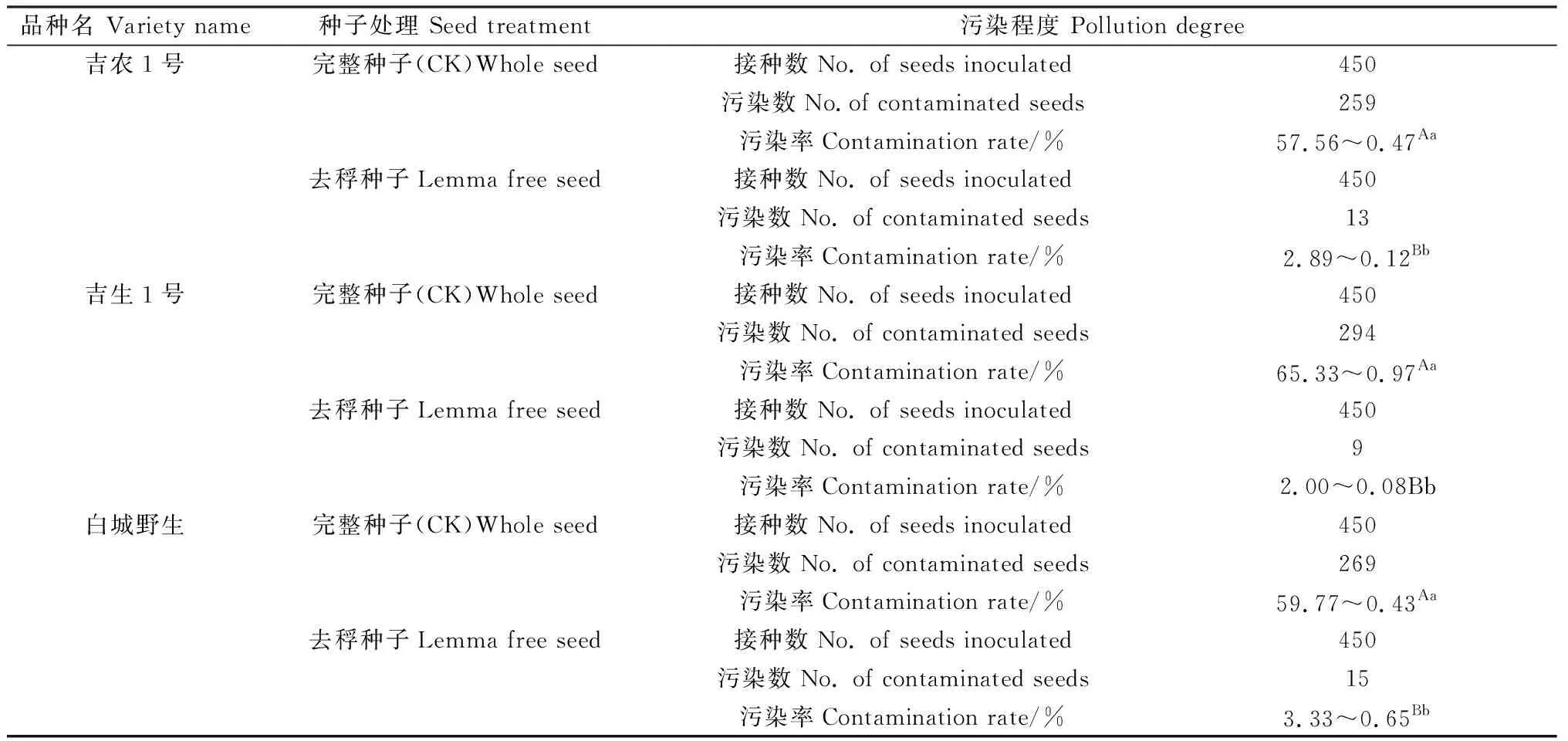
表1 种子不同处理对外植体污染的影响Table 1 The effect of different seed treatments on the contamination on external plant
2.2 影响羊草愈伤组织诱导的因素
2.2.1GA3处理对羊草种子愈伤组织的影响 将人工去稃的羊草种子用100 mg·L-1赤霉素(GA3)浸泡24 h后,接种于愈伤诱导培养基上,观察发现15 d后种子露出白芽,30 d后出现白色或淡黄色颗粒状愈伤组织,40 d后愈伤组织直径达到5 mm左右。本文统计参试品种(‘吉农1号’羊草,‘吉生1号’羊草和‘白城野生’羊草)总体的出愈情况,从表2中可以看出,经过100 mg·L-1赤霉素(GA3)浸泡24 h后种子的愈伤组织的诱导数量显著高于对照CK(P<0.05),说明适当的激素处理对羊草种子的发芽以及愈伤组织诱导至关重要。为提高羊草的愈伤诱导效率,本研究后续试验采用100 mg·L-1赤霉素(GA3)浸泡24 h的去稃羊草种子作为外植体。

表2 GA3处理对羊草种子形成愈伤组织的影响Table 2 Effect of GA3 treatment on callus formation of L. Chinensis seeds
2.2.2不同基因型对羊草种子愈伤组织的影响 供试材料(‘吉农1号’羊草,‘吉生1号’羊草和‘白城野生’羊草),不同基因型种子萌动时间相差5~9 d(表3)。愈伤组织生长30 d后观察其生长状态,发现不同基因型羊草种子的愈伤组织状态相似,但愈伤组织出愈率不同。‘吉农1号’基因型羊草种子出愈率最高48.44%,其次‘吉生1号’出愈率为43.78%,两者之间差异不显著。与野生材料相比,栽培品系羊草种子的出愈率显著高于野生材料(P<0.05)。羊草栽培种的出愈率显著高于野生材料(P<0.05),说明羊草种子的出愈率与其基因型关系密切。

表3 不同基因型羊草种子形成愈伤组织的情况Table 3 Callus formation of different genotypes of L. chinensis seeds
2.2.3不同浓度激素配比对羊草愈伤组织诱导的影响 研究发现,供试材料(‘吉农1号’羊草,‘吉生1号’羊草和‘白城野生’羊草),在2,4-D和KT不同浓度配比的培养基中均能诱导出愈伤组织,但愈伤组织生长的状态和诱导频率存在显著差异。统计结果如图1所示,在不同2,4-D浓度下,诱导率随其浓度的升高呈先上升后下降的趋势。诱导率在2,4-D浓度为2.0 mg·L-1时最高(平均为68.26%),其次是在2,4-D浓度为3.0 mg·L-1时诱导率为38.33%;2,4-D浓度5.0 mg·L-1时最低(平均为16.33%)。在2,4-D和KT浓度不同组合的培养基中,培养基含有2.0 mg·L-12,4-D和0.5 mg·L-1KT产生愈伤组织的频率最高(平均为83.11%),其次是培养基2.0 mg·L-12,4-D +1.0 mg·L-1KT的诱导率(平均为65.02%)。从图1中可以看出,‘吉农1号’和‘吉生1号’羊草栽培品种与‘白城野生’材料在同一配方诱导培养基中的诱导率差异不显著。从试验结果来看,影响羊草愈伤组织诱导率的不是基因型而是生长调节激素的浓度。

图1 不同2,4-D和KT浓度配比对羊草愈伤组织诱导率的影响Fig.1 Effects of different 2,4-D and KT concentrations on callus induction rate of Leymus chinensis
2.2.42,4-D浓度对羊草愈伤组织继代诱导的影响 在试验中,供试材料(‘吉农1号’羊草,‘吉生1号’羊草和‘白城野生’羊草)三种基因型的羊草种子作为外植体,其愈伤组织在含有2,4-D(1.0,2.0,3.0,5.0 mg·L-1)的继代培养基培养15 d后愈伤组织体积加倍增大。就愈伤组织的生长状态而言,三种不同基因型的羊草愈伤组织在相同配方的继代培养基上生长速度和生长状态相似,表明羊草愈伤组织继代培养的生长状态与基因型无关,而受激素2,4-D浓度影响:2,4-D浓度为1.0 mg·L-1继代培养的愈伤组织质地柔软且粘稠,水渍状况减轻,无颗粒状组织诱导(图2A);2,4-D浓度为2.0 mg·L-1继代培养的愈伤组织呈乳白色,结构变得紧密,颗粒状组织明显(图2B);2,4-D浓度为3.0 mg·L-1继代培养的愈伤组织颜色略深,结构变得紧密,颗粒状组织明显,后期一部分出现褐化现象(图2C);2,4-D浓度为5.0 mg·L-1继代培养的愈伤组织全部褐化(图2D)。

图2 不同2,4-D浓度下继代培养基的愈伤组织生长状态Fig.2 Callus growth status of subculture media with different concentrations of 2,4-D注:A,水渍状;B,紧密状;C,部分褐化;D,全部褐化Note:A,Watery B,Compact C,Partial browning D,Total browning
2.3 影响羊草愈伤组织再分化的因素
2.3.1羊草愈伤组织状态对再分化的影响 为进一步确认愈伤组织的生长状态与其分化是否有关,本研究分别取紧密型愈伤组织、易碎型愈伤组织和软粘型愈伤组织放置于分化培养基上(0.5 mg·L-16-BA+0.5 mg·L-1NAA)培养30 d。从图3中可以看出,紧密型愈伤组织分化率最高(53.26%);其次是易碎型(45.12%);软黏型的愈伤组织最低(5.97%)。研究结果表明柔软透明的愈伤组织不具有胚性,而紧密型具有颗粒状的愈伤组织具有胚性,因此,选择紧密型且具有颗粒状的愈伤组织进行分化调控试验。
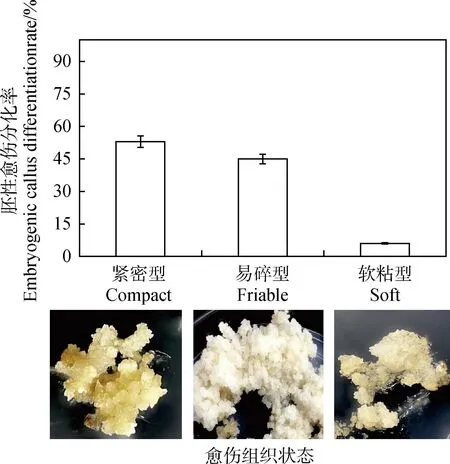
图3 愈伤组织状态对分化率的影响Fig.3 Effect of callus state on differentiation rate
2.3.2不同浓度激素配比对羊草愈伤组织分化的影响 愈伤组织于诱导培养基中培养40 d后接种于分化培养基上,光照条件下培养5 d后出现绿色芽点,20 d后萌发出再生芽。试验观察发现,参试材料的三种基因型羊草,在相同浓度激素条件下,愈伤组织形成的分化愈伤数量相近,且形成的再生芽数量也相近,说明愈伤组织的分化率与材料基因型关联不大,分化率的大小更取决于培养基中激素浓度的配比。因此,对三种基因型羊草愈伤组织的平均值进行比较(表4)。

表4 愈伤组织在不同激素浓度下的分化情况Table 4 Callus Differentiation in different concentrations of hormones
在分化培养基上培养5 d出现绿色芽点,形成胚性愈伤组织为愈伤组织分化初期。此时,在分化培养基中加入1.0 mg·L-16-BA+0.5 mg·L-1NAA愈伤组织的分化率最高,其分化率为84.29%。且两种激素结合使用要比任何一种激素单独使用的效果好。分化率另一评判标准为产生再生苗的愈伤组织数量,胚性愈伤组织经过分化培养基培养20 d后形成再生芽,分化培养基中加入1.0 mg·L-16-BA+0.5 mg·L-1NAA产生胚性愈伤组织数量最多,从而形成的再生芽最多47个,成苗率达52.86%(表4)。
2.4 生根和移栽
羊草愈伤组织分化培养20~30 d愈伤组织上的绿点逐渐形成不定芽。15~20 d待分化出的芽长到3~5 cm时转到生根培养基上,所得的植株都能正常生长。培养1周后开始生根,10 d后每株可长出8~10条根,根长达4~5 cm(图4E)。再培养1周,植株健壮,叶色浓绿,20℃左右室温条件下练苗3~5 d,洗去根部培养基,移栽到盆中放入温室培养,再生苗成活率达到100%(图4H)。

图4 羊草种子的诱导、分化和再生苗Fig.4 Induction,differentiation and regeneration of the seedlings from seeds of Leymus chinensis注:A,种子诱导30 d;B,愈伤组织诱导40 d;C,愈伤组织的继代;D,愈伤组织的分化;E,分化出的幼苗及根;F,再生植株;G,移栽成活植株;H移栽成活植株Note:Panel A,seed-induced for 30 d;Panel B,callus induction for 40 days;Panel C,Callus succession;Panel D,callus differentiation;Panel E,differentiated seedlings and roots;Panel F,Regenerate plants;Panel G,transplanted into live plants;Panel H,live plants from transplantation
2.5 利用ISSR对羊草再生植株进行遗传稳定性分析
选用17条引物对羊草的组培再生苗进行PCR扩增,确定每条引物最适宜的退火温度。结果表明,大部分引物均能扩增出不连续带谱,其中有3个引物反应产物重复性高、扩增稳定且条带清晰(表6),最终筛选出807,811,827共3条扩增条带清晰、重复性好、多态性较高的引物用于羊草的ISSR-PCR扩增。

表6 ISSR引物对羊草再生植株的扩增情况Table 6 ISSRanalysisofLeymuschinensiswith3 primers
随机取9株羊草组培再生苗(1株栽培苗作对照),以其中引物811用于羊草的ISSR-PCR扩增,扩增产物在2%的琼脂糖凝胶上电泳如图6。研究结果表明,引物811对对照和组培再生苗扩增图谱一致,没有检测出多态性片段,表明未在再生植株基因组中检测出遗传变异,说明该组培再生体系诱导羊草再生植株能够保持遗传上的稳定性。
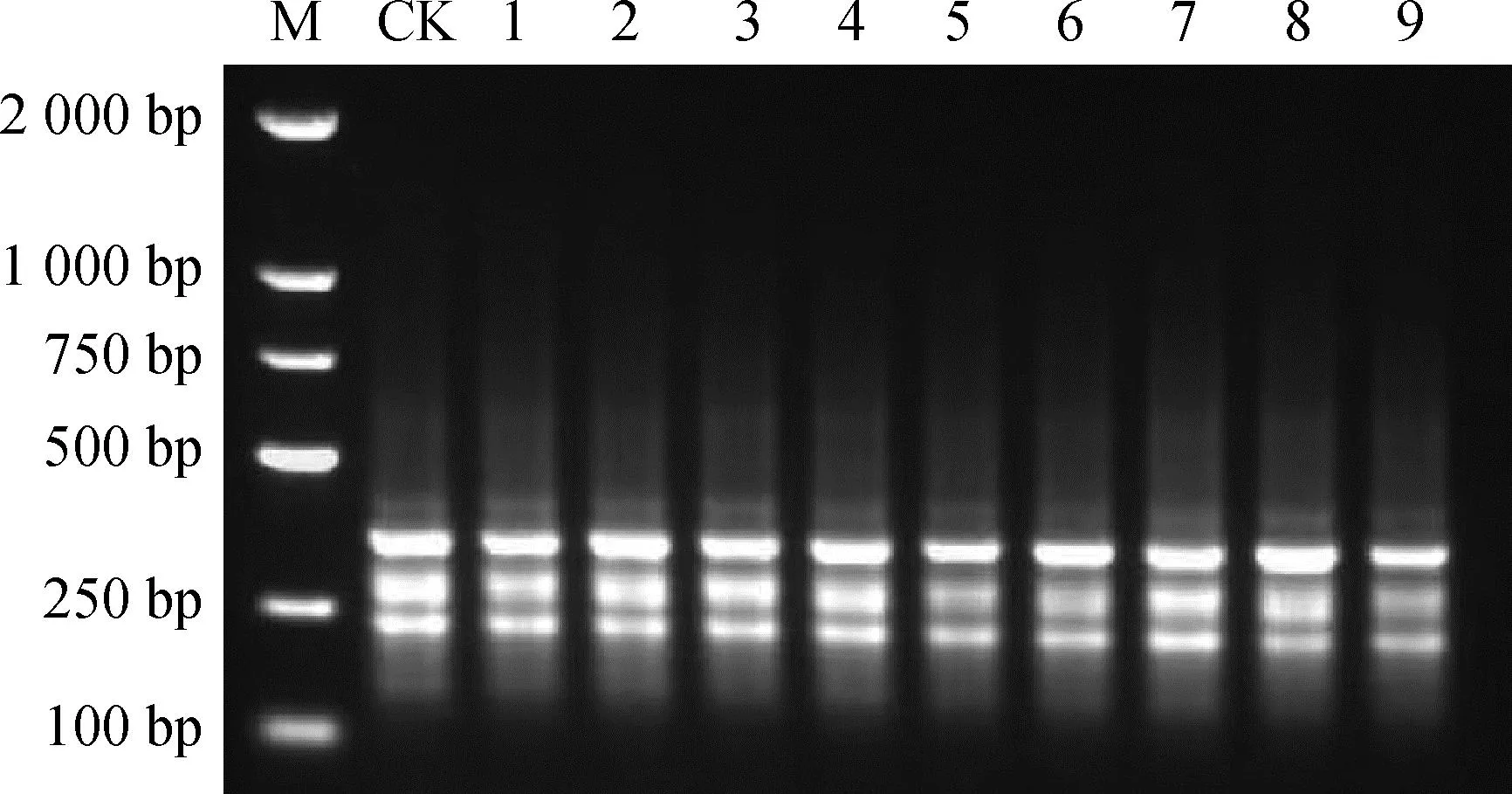
图6 引物S811的ISSR扩增图谱Fig.6 ISSR amplification map of primer S811注:M,分子量标记;CK,对照植株;1~9,再生植株Note:M,DNA marker;CK,Wild plant;1~9,Regeneration plants
3 讨论
20世纪70年代开始,随着基因工程技术的兴起与发展,通过基因转移进行植物遗传改良的研究工作广泛开展,高效的离体再生体系是其中一个重要的环节。对于羊草这类禾本科单子叶植物而言,选用稳定的愈伤组织再生系统才能为遗传转化提供再生频率高和再生能力稳定的受体材料[13-14]。
3.1 种子处理对羊草组织培养的影响
禾本科牧草愈伤组织的诱导中,种子、幼胚、幼穗、根茎都可以用作外植体[15],刘江淑等[8]从幼穗、幼胚和成熟种子诱导的愈伤组织上都得到了再生植株,幼穗和幼胚的诱导率高于90%,而成熟的种子的诱导频率不足20%。魏淇等[16]研究表明羊草种子愈伤组织的诱导率仅12%。曲同宝等[17]将人工去稃的羊草种子在100 mg·L-1GA3浸泡24 h后发芽率从0提高到12%,放置诱导培养上培养15 d后,种子最高出愈率达到25.33%。邹吉祥等[18]研究发现GA3的浓度和浸泡时间对羊草种子发芽率影响较大,200 mg·L-1GA3浸泡48 h对打破羊草种子休眠的效果最佳,羊草种子的发芽率和出愈率分别为7%和16.5%。由此可见,羊草种子虽取材方便且不受季节影响,但作为外植体,种子发芽率低、出愈率低是影响组培效率的首要问题,也是学者们急切解决的难题。禾本科牧草种子的颖壳潜伏的微生物和细菌增加了种子灭菌的难度[19],发现种子去颖后污染率显著降低[20-22]。本研究在建立羊草组织培养体系初期,也发现去稃处理能得到较好的试验结果,组培污染率从从60.89%控制到5%以下;同时去稃后的种子经GA3浸泡处理,种子出愈率从17.93%增加到36.44%,在一定程度上解决了种子作为外植体诱导率低的难题。由此可见,去稃处理对一种自为外植体的禾本科牧草愈伤组织培养具有显著的促进作用。
3.2 不同激素配比对羊草愈伤组织诱导的影响
能否实现羊草愈伤诱导阶段的高频诱导效率,2,4-D的存在及适宜浓度起着至关重要的作用[23]。肖燕等[24-25]研究发现在愈伤组织诱导和继代过程中添加2.0 mg·L-12,4-D有利于羊草胚性愈伤组织再生。邸桂俐等[9]在诱导培养基中添加5.0 mg·L-12,4-D,羊草幼穗出愈率最高达87.5%。本研究共设置了1.0~5.0 mg·L-1共4个水平的2,4-D浓度,结果表明,低质量浓度2,4-D虽能维持愈伤组织的生长但不利于愈伤组织的分化,高质量浓度2,4-D不利于愈伤组织胚性的保持,本研究适宜的2,4-D浓度为2.0 mg·L-1;同时,在培养基中添加微量KT(0.5 mg·L-1)可以明显促进愈伤组织的胚性发育,愈伤组织诱导率平均提高到83.11%。此外,本文对三个不同基因型羊草愈伤组织诱导进行比对,结果表明愈伤组织的生长状态及诱导率受基因型的差异影响不大,而是与培养基中激素浓度配比影响密切。在继代培养基中添加2.0 mg·L-12,4-D能够保持愈伤组织的紧密、稳定结构,提高愈伤组织的胚性或促进其向胚性状态发展[26],而质量浓度过低愈伤组织呈水渍状;过高使愈伤组织容易产生褐变,都不利于其胚性调整。
3.3 不同激素配比对羊草胚性愈伤组织分化和生根的影响
分化培养中激素的组合与浓度的配比是影响愈伤组织分化率的关键因素[27,28]。研究发现,不同禾本科牧草的外植体分化有其最适宜的激素[29],在分化培养基中2,4-D的浓度很低,甚至不添加2,4-D才能保证植株再生。大多数试验表明,6-BA的效果最好,其次是KT。本研究共设计了8种激素浓度梯度的分化培养基,结果表明,外源激素6-BA对愈伤组织分化的影响十分显著,低浓度6-BA(0.1 mg·L-1)未诱发任何可见形态变化发生,高浓度6-BA(2.0 mg·L-1)诱导愈伤褐变。既不会诱导褐变同时防止愈伤组织过度繁殖还能让愈伤组织再生的最佳浓度6-BA为1.0 mg·L-1。为提高愈伤组织的再生芽率,产生良好的分化效果,在不添加2,4-D的培养基中同时加入1.0 mg·L-16-BA和0.5 mg·L-1NAA,再生芽的成苗率可达50%以上。不定芽在MS培养基中受盐胁迫的影响容易失水死亡,1/2MS的培养基中盐分对不定芽的伤害减少,不定芽可直接形成不定根,且生根速度快,根毛生长健壮,从而形成完整植株[30],这与本研究观点一致,本研究选用1/2MS培养基获得良好的生根效果,一方面是因为1/2MS本身具有促进植物生根的能力,另一方面是羊草的生根能力比较强。
植物组培苗的遗传稳定性主要由基因型、继代次数、培养条件等因素影响[31-32],通过表型鉴定无法检测出培养中产生的变异,因此,变异检测成为生产中亟待解决的问题。近年来,几种DNA分子标记技术已被成功应用于检测再生植株遗传稳定性[33-34]。其中,简单重复序列间扩增(ISSR)具有快速高效、操作简便及低成本被广泛使用[35-36]。本研究利用ISSR检测技术对建立的羊草再生体系稳定性进行检测,检测结果发现,随机选择的再生植株扩增图谱一致,没有检测出多态性片段,说明该组培再生体系诱导羊草再生植株能够保持遗传上的稳定性。同时,利用上述引物和ISSR-PCR扩增体系具有可靠的应用价值,可以用作羊草的遗传多样性分析。
4 结论
以去稃的羊草种子为外植体,100 mg·L-1赤霉素(GA3)浸泡24 h后使用,愈伤组织诱导培养基为:MS+2.0 mg·L-12,4-D+ 0.5 mg·L-1KT,诱导率可达83.11%;继代培养基为:MS+2.0 mg·L-12,4-D,胚性愈伤诱导率为53.26%;分化培养基为:MS+1.0 mg·L-16-BA+0.5 mg·L-1NAA,分化率为84.29%,成苗率为52.86%;生根培养基为:MS+1/2MS,生根率及移栽存活率为100%。该组培再生体系对不同品种的羊草愈伤诱导及分化具有共性和参考价值。通过ISSR分析,再生植株没有发生遗传变异,能够保持遗传上的稳定性,为优良羊草种质选育提供了新的途径。

