菌-藻体系中无机碳源对小球衣藻生长和聚集的影响研究
吴雪菲, 陈国炜, 方志鹏, 贾 伟, 刘 丽
(合肥工业大学 土木与水利工程学院,安徽 合肥 230009)
为了应对化石燃料的不可持续问题及其引发的全球变暖和环境污染等问题,发展可持续能源是当前能源行业面临的主要挑战之一[1-3]。微藻是生物质燃料的一种潜在来源,也是化石燃料的一种可行替代品[4-6]。微藻具有的生物量和脂质生产力,是传统作物生产生物柴油的10~300倍[7-8],同时具有环境适应性强、生长周期短、产油率高、养殖面积小等优点[9-13]。此外,微藻还可以吸收二氧化碳,储存光合能量,理论上每生成1 kg干微藻的生物量至少需要消耗1.83 kg二氧化碳[14-15]。
尽管微藻具有这些明显的优点,但微藻体积较小、游离藻类的沉降能力较差,水力停留时间相对较长[7,16],导致在藻类生物制品行业,微藻的收集成本占总生产成本[17-18]的20%~30%,大大增加了运营成本[19-20]。因此,开发一种经济高效的微藻收集方法是一个艰巨的挑战[21]。
目前,微藻可通过物理、化学和生物技术等方法进行收集。物理收集技术包括沉降、离心、浮选、过滤、电、磁和超声等方法,但由于高成本和操作技术要求较高,它们的应用潜力有限[22-23]。化学絮凝技术是采用无机或有机絮凝剂进行微藻收集,其缺点是需要投加大剂量的化学絮凝剂,致使收集成本提高,还会产生不必要的副产品,甚至化学絮凝剂中的一些重金属离子很容易对环境造成一定的污染,这些缺点制约了其在微藻收集中的大规模使用[24]。相对于上述物理、化学的方法,生物方法是最经济的,且不会对环境造成污染[18]。藻类和细菌联合培养与单一藻类相比,可以降低微藻的收集成本[25-26],而共培养体系水力停留时间较短[27-28],与单一藻类相比具有较好的沉降性能,被认为是有效的解决方案之一。因此,本文从菌藻互作出发,以菌-藻共生体系为研究对象,选取生长快、产油高的小球衣藻和活性污泥细菌,探究无机碳源对菌-藻共生体系中小球衣藻生长规律和聚集趋势的影响,解析不同菌藻数量接种比例下碳源质量浓度对微藻生长和聚集的影响,以期对微藻的应用提供理论指导。
1 实验材料与方法
1.1 实验藻种
实验微藻为小球衣藻(Chlamydomonasmicrosphaera),编号FACHB-52,购于中国科学院淡水藻种库,培养于BDP-250人工气候培养箱(上海百典仪器设备有限公司)中,设置温度为(25±1) ℃,光照强度为2 000 lux,光暗比为12 h/12 h,接种后瓶口用已灭菌的透气膜进行封口处理。微藻培养时每天定时摇动2~3次,培养基为SE(Selenite Enrichment)液体培养基。
1.2 实验菌种
采用活性污泥混合菌为实验菌种,以气单胞菌属Aeromonas、邻单胞菌属Plesiomonas、克雷白氏杆菌属Klebsiella为主,活性污泥取自合肥工业大学市政工程系序批式反应器(sequencing batch reactor,SBR)。取出1 mL活性污泥混合液,接种到500 mL内装有250 mL灭菌LB肉汤的锥形瓶中,37 ℃恒温培养16 h后,从中取2份上清液各30 mL,分别放入50 mL的离心管中,在5804高速离心机(美国Eppendorf集团)中以8 000 r/min在4 ℃下离心10 min,弃去上清液,然后用培养液将每个离心管的底物溶解定容到30 mL;重复上述操作2次后,各取1 mL分别稀释500倍、1 250倍、2 500倍,用于测试细菌的数量[29]。
1.3 实验设计
为了考察无机碳源(inorganic carbon,IC)对菌-藻体系中微藻生长和聚集的影响,设置2个实验组和1个对照组,其中实验组1考察在初始菌藻数量比为3∶1时无机碳质量浓度ρIC对菌-藻体系中微藻生长和聚集的影响,实验组2初始菌藻数量比为15∶1,对照组为纯藻,3组实验的具体设计如下所述。
1) 实验组1(菌藻数量比3∶1)。准备3个体积为500 mL的玻璃锥形瓶(其编号分别为1#、2#、3#),向3个锥形瓶中各加入完全相同的315 mL且生长已经达到对数生长期的微藻(6.8×105个/mL),然后向3个锥形瓶中各加入0.25 mL的细菌(8.5×108个/mL),保证初始的菌藻数量比[30]为3∶1。向1#瓶中加入培养液350 mL(1#瓶,不加IC);向2#瓶中同时加入7 mL碳酸氢钠溶液(ρIC=1 880.0 mg/L)、343 mL培养液,混匀,使2#瓶中ρIC=37.6 mg/L(2#瓶,ρIC=37.6 mg/L);向3#瓶中同时加入35 mL碳酸氢钠溶液(ρIC=1 880.0 mg/L)、315 mL培养液,混匀,使得3#瓶中ρIC=188.0 mg/L(3#瓶,ρIC=188.0 mg/L)。在光照培养箱中培养观察,光照培养箱条件与微藻培养条件一致。
2) 实验组2(菌藻数量比15∶1)。将初始菌藻数量比由3∶1变成15∶1,其余条件与实验组1完全相同。
3) 对照组(纯藻)。初始无细菌,其余条件与实验组1相同。
每组样品设置3个平行样,以减小实验误差。
培养液成分[31]如下:
ρ(NaNO3)=121.43 mg/L,
ρ(KH2PO4)=18.00 mg/L,
ρ(MgSO4·7H2O)=90.00 mg/L,
ρ(CaCl2·2H2O)=14.00 mg/L,
φ组分A=1.25 mL/L,φ组分B=1.25 mL/L。
组分A、组分B的成分见表1所列[31]。

表1 组分A和组分B的成分
1.4 分析方法
1.4.1 SEM表征
采用扫描电子显微镜(scanning electron microcope,SEM)观察微藻聚集体表面和内部结构。吸取适量微藻样品置于5 mm×5 mm硅片(艾思科技有限公司)上,放入-4 ℃冰箱冷冻4 h,然后放入BT2KXL真空冷冻干燥机(美国VirTis公司)冷干8 h。冷干结束进行样品预处理[32]。将处理好的样品置于Supra 40场发射扫描电子显微镜(德国Zeiss集团)下观察分析。
1.4.2 微藻聚集率
从反应器中取50 μL样品放在载玻片上,置于BA410光学显微镜(麦克奥迪实业集团有限公司上海分公司)下观察拍摄,采用Motic Images Plus 2.0软件对微藻图像进行采集拍摄,并随机摄取15个视野进行图像分析,图像中2个及2个以上聚集在一起的微藻即判定为聚集体[33],聚集率G计算公式为:
G=(B1/B0)×100%
(1)
其中:B1为视野中聚集的藻细胞数;B0为视野中藻细胞总数。
1.4.3 微藻生物量
摇匀锥形瓶中样品后,取4 mL样品放入5 mL离心管中,在8 000 r/min下离心10 min,弃去上清液,将剩余物重新悬浮在4 mL的90%丙酮(分析纯,国药集团化学试剂有限公司)中,放入冰箱,在4 ℃下避光保存24 h。以8 000 r/min离心10 min,取上清液用紫外分光光度法测定630、645、663、750 nm波长下的吸光度A,以90%丙酮溶液作为空白对照,叶绿素a的质量浓度计算公式[34]为:
ρ叶绿素a=[11.64(A663-A750)-2.16(A645-A750)+0.10(A630-A750)]V
(2)
其中,V为提取样品的体积。
由式(2)得到ρ叶绿素a后,再通过标准曲线将ρ叶绿素a换算成微藻的细胞数。
1.4.4 胞外聚合物的提取和分析
从锥形瓶中取4 mL样品放入5 mL的离心管中,先以4 000 r/min离心5 min后,去除上清液,再加入4 mL去离子水,然后在80 ℃水浴加热1 h,取出样品,以8 000 r/min离心5 min后,将上清液通过0.22 μm滤膜过滤,用于测量胞外聚合物(extracellular polymeric substances,EPS)中的多糖和蛋白质[35]。
1) 多糖的测定。采用硫酸-蒽酮法,以葡萄糖作标准物质测定标准曲线[36-37]。取1 mL合理稀释的滤后样品放入试管中,加入3 mL的0.2%蒽酮-硫酸溶液,然后放入冷水中冷却,充分振荡并立即放入沸水浴中,15 min后取出,冷水浴5 min;以超纯水空白样作参比,在620 nm波长下,使用UV2600紫外可见分光光度计(上海尤尼柯科学仪器有限公司)测其吸光度。
2) 蛋白质的测定。采用Lowry法,以牛血清蛋白作标准物质测定标准曲线,在750 nm波长下测蛋白质量浓度[38]。
2 实验结果与分析
2.1 SEM表征分析
聚集体的形成过程和SEM下的菌藻聚集体如图1所示。

图1 聚集体的形成过程和SEM下的菌藻聚集体
从图1可以看出,纯藻大多处于分散状态,而加入细菌后的微藻从第2天开始,具有明显的聚集趋势,此时没有较大的聚集体出现,到第4天时微藻形成的聚集体开始变大,聚集体尺寸约为50 μm,到第6天时聚集体变得更大,尺寸接近100 μm。这说明细菌有助于微藻的聚集,且随着时间增加,聚集体逐渐增大,有利于微藻的沉降和收集。
由此可知,细菌和EPS将藻细胞联系在一起,形成了菌藻聚集体。
2.2 微藻聚集率分析
不同初始质量浓度碳酸氢钠下微藻的聚集率如图2所示。图2中,a、b、c表示显著性羞异。
西藏藏中电网是以拉萨、山南、日喀则、林芝、那曲五个地区电网联网形成的系统,目前阿里、昌都地区电网仍然独立运行。西藏藏中电网内变压器中性点接地方式,由区调继电保护处统一安排部署,各地区电网根据区调调度员的指令执行。
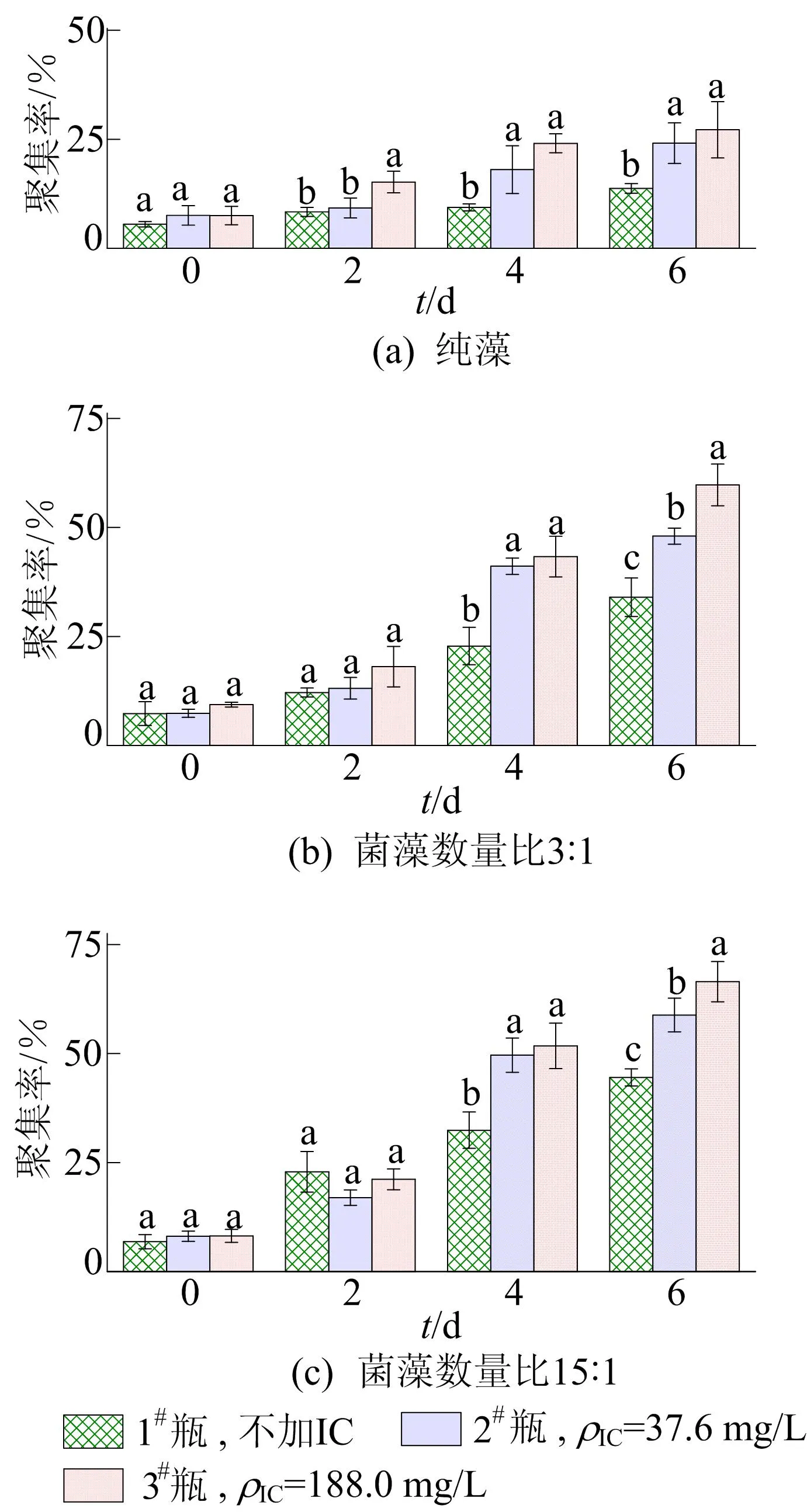
图2 不同初始质量浓度碳酸氢钠下微藻的聚集率
从图2可以看出,随着碳酸氢钠初始质量浓度增加,微藻的聚集率增加。纯藻到第6天,聚集率最大可达27%;菌-藻体系前2 d微藻的聚集率没有太大变化,初始菌藻数量比3∶1下到第4天时,微藻的聚集率骤增,最高可达43%,到第6天时增长到最大,高达60%;初始菌藻数量比15∶1下到第4天时,微藻的聚集率骤增,最高可达52%,到第6天时聚集率达到最大值66%。由此可见,初始投加碳酸氢钠对微藻的聚集率有一定的促进作用,且对菌藻共培养时微藻聚集率的促进效果要远大于纯藻培养时。
2.3 微藻生物量分析
不同初始质量浓度碳酸氢钠下微藻的生长如图3所示。从图3可以看出,初始碳酸氢钠质量浓度越大,微藻的生物量越大。由图3a可知,纯藻在第6天时微藻的生物量随着ρIC增加,1#、2#、3#瓶中依次为1.028×106、1.065×106、1.103×106个/mL,第5天时3#瓶微藻生物量是1#瓶的1.08倍。由图3b可知,初始菌藻数量比3∶1下,在第6天时微藻的生物量随着ρIC增加,1#、2#、3#瓶中依次为0.998×106、1.140×106、1.355×106个/mL,第5天时3#瓶微藻生物量是1#瓶的1.37倍。由图3c可知,初始菌藻数量比15∶1下,在第6天时微藻的生物量随着ρIC增加,1#、2#、3#瓶中依次为0.967×106、1.255×106、1.681×106个/mL,2#、3#瓶分别较纯藻培养体系增加30%、68%。此外,在第5天时3#瓶微藻生物量远高于1#瓶,前者是后者的1.81倍。纯藻培养中,微藻的生物量随着初始ρIC增加而增加的效果不显著(P>0.05),而在菌藻共培养中,微藻的生物量随着初始ρIC增加显著增加,且初始菌藻数量比越大,增加得越显著(初始菌藻数量比3∶1下,P<0.05;初始菌藻数量比15∶1下,P<0.001)。

图3 不同初始质量浓度碳酸氢钠下微藻的生长
2.4 EPS质量浓度分析
不同初始质量浓度碳酸氢钠下蛋白和多糖的质量浓度如图4所示。
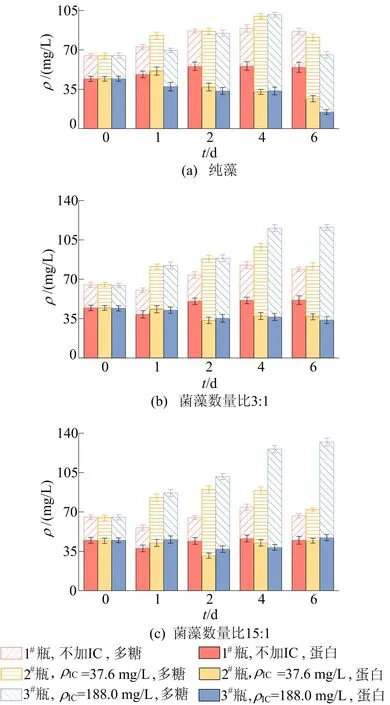
图4 不同初始质量浓度碳酸氢钠下蛋白和多糖的质量浓度
由图4a可知:纯藻蛋白质量浓度随着初始ρIC增加而减小,在第6天时组间差距最大,此时最大是1#瓶,为54.54 mg/L,最小是3#瓶,为14.77 mg/L;多糖质量浓度大致随着初始ρIC增加而增加,在第4天时多糖质量浓度达到最大,为67.66 mg/L。
由图4b可知,初始菌藻数量比3∶1下,蛋白质量浓度随着初始ρIC增加而减小,多糖质量浓度随着初始ρIC增加而增加,第6天时多糖质量浓度达到最大值82.45 mg/L。
由图4c可知:初始菌藻数量比15∶1下,多糖质量浓度随着初始ρIC增加而增加,第4天时达到最大值87.35 mg/L;蛋白质量浓度在第1天随着初始ρIC增加而增加,第2天1#瓶的蛋白质量浓度最大,其次是3#瓶,2#瓶最小,第4天随着初始ρIC增加而减小,到第6天时3个瓶中的蛋白质量浓度已无明显差异。
3 讨 论
由于碳酸氢盐在水中溶解度较高,且与HCO3-相比,CO32-对光合作用没有明显的促进或抑制作用,因而HCO3-易被微藻大量吸收利用[45-46]。在加入碳酸氢钠后,微藻的生物量随着初始ρIC增加而增大,在纯藻培养时微藻的生物量增加得不显著,而在菌藻共培养时出现明显的大幅度增加。随着初始ρIC增加,微藻的生长和聚集都得到促进,一方面是由于在无机碳充足的情况下,微藻能够给细菌提供的营养物质相对变多,细菌本身在这种无有机碳环境下追寻微藻获取营养物质的程度加大,从而更多地与微藻结合在一起,因此对微藻生长和聚集都起到促进作用。
细菌会刺激微藻分泌多糖[47],在无碳酸氢钠情况下,随着初始菌藻数量比增加,多糖的质量浓度不断减小,这是由于细菌数量越多,其消耗营养物质多糖的量会越大;初始加入低质量浓度碳酸氢钠后,微藻自身的营养条件变得更加充足,前2 d随着初始菌藻数量比增加,细菌刺激微藻分泌更多的多糖来作为其营养物,同时微藻也随着初始菌藻数量比的增加生长得更快,到第4天和第6天时,随着初始菌藻数量比增加,多糖的质量浓度不断减小,这是由于随着碳酸氢钠的消耗,微藻的生存压力相对增加,同时细菌的数量增加,加大了对多糖的消耗,分泌的多糖量少于细菌消耗的多糖量。多糖可能是引发菌藻聚集的主要原因,在以往的研究中,通常只关注了蛋白质量浓度对微生物聚集的影响[16,48-49],而忽视了多糖的作用[50-51]。有研究采用激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)技术分析发现,β-多糖(即β-(1,3)-葡萄糖的高聚物)均匀分布在聚集体内,对聚集体内部稳定性起到支撑作用[52]。此外,微藻所分泌的胶鞘多糖与细胞表面密切相关,其所含有的纤维素可作为黏附剂帮助细胞附着[53]。
4 结 论
1) 外源无机碳的出现对于纯培养小球衣藻的生长没有显著影响,但在菌-藻混合体系中可以显著促进微藻的生长。在低质量浓度IC水平下,初始菌藻数量比为15∶1时,经过6 d培养,微藻生物量较纯藻培养体系增加30%;当ρIC升高至188.0 mg/L时,微藻生物量较纯藻培养体系增加68%。
2) 菌-藻共生体系有助于微藻发生聚集,并且随着体系中ρIC增加,其聚集效果变得更明显。
3) 在IC不充足时,菌-藻体系中EPS的质量浓度随初始菌藻数量比的增加而减小,当IC较充足时,菌-藻体系中EPS的质量浓度随初始菌藻数量比的增加而增大,细菌会促进微藻分泌多糖且利用多糖作为自身的营养物质,多糖质量浓度与微藻聚集有重大关系。

