响应面法优化超声提取甘蔗叶多糖工艺研究
陈赵杰,陈伟明,莫萌苗,于淑娟,孔繁晟*
(1 广东华糖实业有限公司,广东江门 529100;2 亚联糖业(广东)有限公司,广东佛山 528211;3 广东药科大学药学院,广东广州 510006;4 华南理工大学食品科学与工程学院,广东广州 510640)
0 前言
甘蔗叶拥有丰富的活性成分,包括多酚、黄酮、多糖等[1]。其中,多糖作为甘蔗叶最重要的活性成分之一,因其独特的抗氧化、抗糖尿病、抗肿瘤等生物活性而受到越来越多的关注[1]。多糖的含量、结构特性与其生物活性的强弱密不可分,因此,合适的对多糖的提取方法具有重要影响。热水提取法方法简单、安全性高,但温度过高且耗时耗能,提取时间过长会使多糖降解,从而降低其药理活性[2]。超声辅助提取(UAE)是一种有效的提取方法[3],其空化作用可以高效地破坏细胞壁、减小颗粒大小并增强溶剂与目标化合物之间的接触[4],并且在高效提取过程中对多糖的结构和分子性质的损害最小,具有能耗低、溶剂消耗小等优点。因此,本研究通过响应面法(RSM)优化超声提取甘蔗叶多糖SLP 工艺条件,以期为超声辅助高效提取SLP 技术的开发及应用提供理论基础。
1 材料与方法
1.1 试验材料
甘蔗叶,购自广西壮族自治区南宁市宾阳县古辣镇农场;葡萄糖,分析纯,山东金胜生物科技有限公司;苯酚、浓硫酸、正丁醇、氯仿、95%乙醇、石油醚(均为分析纯),天津市致远化学试剂有限公司。
1.2 试验方法
1.2.1 甘蔗叶多糖的提取工艺
将新鲜甘蔗叶(1.0 kg)晒干、切段、粉碎并过60目筛。依次通过石油醚和95%乙醇处理后在60℃下干燥后保存。将甘蔗叶粉末进行超声辅助热水提取,提取结束后,将多糖提取液以5000 r/min 的转速条件下离心15 min。离心结束后,取适量的上清液进行甘蔗叶多糖(SLP)提取率的测定。
1.2.2 甘蔗叶多糖提取率的测定
采用苯酚-硫酸法[5]对上述甘蔗叶多糖总糖含量进行测定。于玻璃试管中加入适量的待测溶液加入去离子水定容至2.0 mL 后,依次加入1.0 mL5%的苯酚溶液,再缓慢加入浓硫酸5.0 mL,将反应液振荡混匀,冷却10 min 后于490 nm 的波长下借助紫外分光光度计测定吸光度,并以吸光度为纵坐标,葡萄糖标准品溶液浓度为横坐标绘制标准曲线。甘蔗叶多糖提取率(Y)按以下公式计算:
式(1)中,c代表多糖浓度(mg/mL);V代表多糖提取液体积(mL);D代表稀释倍数;m代表甘蔗叶粉末重量(mg)。
1.2.3 甘蔗叶多糖的超声辅助提取的单因素实验
以超声功率、超声温度、超声时间及液料比为影响因素,研究超声辅助提取下,超声功率(240、300、360、420、480 W)、超声温度(20、40、60、80、100℃)、超声时间(40、50、60、70、80 min)和液料比(20、30、40、50、60 mL/g)对甘蔗叶多糖提取率的影响。
1.2.4 甘蔗叶多糖的超声辅助提取法响应面优化
通过响应面方法(RSM)优化甘蔗叶多糖各提取过程并评估多个变量及其相互作用的影响[6]。如表1所示,以单因素实验为基础,使用Box-Behnken 进行设计,设计3 变量3 水平实验,各因素包括超声时间(40、60、80 min)、超声温度(50、60、70℃)和液料比(30、40、50 mL/g),并通过方差分析评估模型的重要性。

表1 因素水平表
1.2.5 传统热水提取甘蔗叶多糖
设计传统热水提取法提取作为对照组。简而言之,样品直接放入100℃的去离子水中水浴2 h,液料比为40︰1,其他操作步骤与条件与上述超声辅助提取相同。
1.3 数据处理
所有涉及的实验至少平行3 次。所得数据值表示为平均值±标准差(SD)。实验通过单因素方差分析(ANOVA),P<0.05,具有统计学意义。使用SPSS 26.0 和OriginPro 2021 进行统计分析。
2 结果与分析
2.1 单因素实验分析
葡萄糖标准曲线的线性回归方程为:y=16.87x-0.0991,R2=0.9991,表明在 0.01~0.06 mg/mL 范围内,吸光度与葡萄糖标准溶液浓度的线性关系良好。
2.1.1 超声提取功率对多糖得率的影响
如图1 所示,随着功率从240 W 增加到360 W,SLP 的提取率明显增加(P<0.05)。多糖的产率增加可能是由于该功能范围内的超声波会产生较大的空化效应,同时产生微射流和冲击波,从而确保了更高的细胞降解和更高的溶剂渗透[8]。然而,功率大于360 W 时,功率过大会降低超声能量传输到介质中的效率[9]导致SLP 得率降低。

图1 超声功率对SLP 提取率的影响
2.1.2 超声提取温度对多糖得率的影响
由图2 可看出,在超声提取温度为60℃时,多糖的最大提取率为1.97%。提取率随温度呈先升后降。该现象可能是高温增加了多糖的溶解度,并促进了多糖从细胞中扩散出来及较高的温度可能会导致多糖的不稳定性,破坏多糖的结构并导致其降解。

图2 超声提取温度对SLP 提取率的影响
2.1.3 超声提取时间对多糖得率的影响
如图3 所示,在60 min 的多糖得率最大,当超过60 min 时,多糖得率降低,预示着超声时间的延长可能会导致细胞破坏的增加,最终导致多糖的降解。
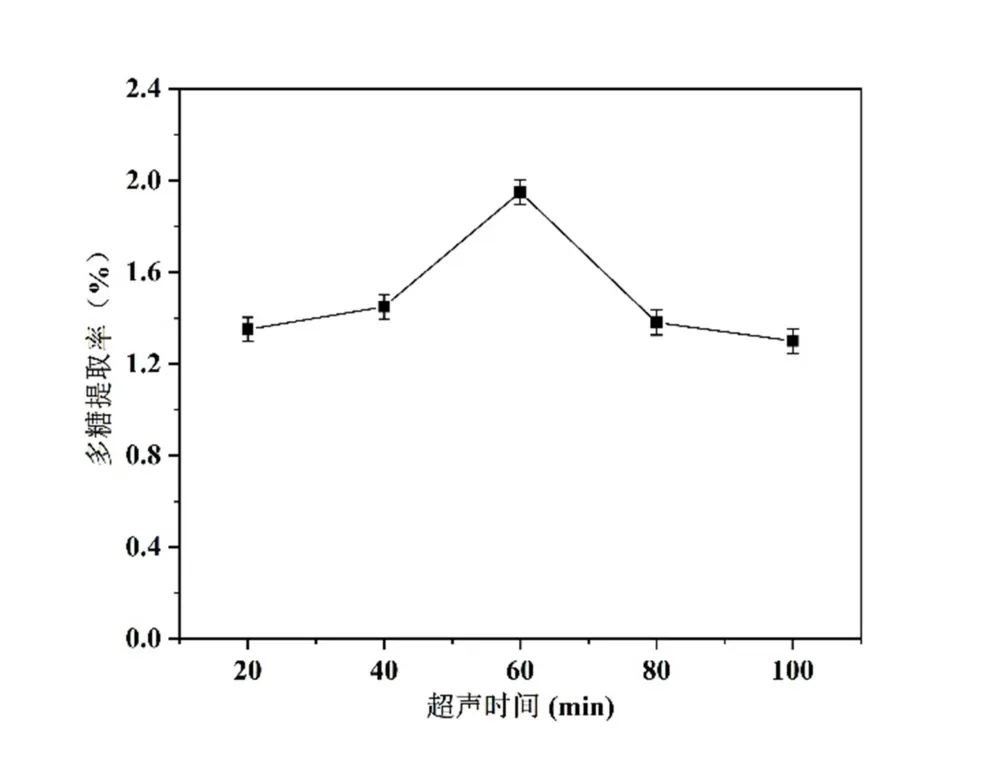
图3 超声时间对SLP 提取率的影响
2.1.4 液料比对多糖得率的影响
如图4 所示,随着液料比的增加,多糖的提取率呈现先上升后下降的趋势,这表示在合适的液料比范围内,液料比越高,植物细胞内外的浓度越大,多糖扩散越快。然而超出范围后,混合物的浓度降低,从而降低超声波能量传输的效率[8]。

图4 液料比对SLP 提取率的影响
2.2 利用响应面法(RSM)与Box-Behnken(BBD)设计优化提取率
综上所述,SLP 的提取在很大条件下受限于提取条件。单独考虑各因素的最佳条件可以概括为:超声提取功率为360 W,提取温度为60℃,提取时间为40 mL/g。其次,将BBD 实验设计与RSM 相结合,能更好地探讨各因素之间的关联性,最终确定最佳提取条件。单因素分析结果表明:超声温度、提取时间和液料比对多糖得率影响较大。因此,优选这3 个因素。超声提取时间为40~80 min,提取温度为50~70℃,液料比为30~50 mL/g。
2.2.1 模型拟合
BBD 实验设计和结果见表 2 。 采用Design-Expert 8.0.6 软件对数据实施多元非线性回归模拟,根据下列公式计算出3 个因素与SLP 提取率相关的二次多元回归方程。
式(2)中,A代表超声提取温度(℃);B代表超声提取时间(min);C代表液料比(mL/g);Y代表提取率(%)。方差分析结果如表3 所示。从表3 结果分析所得,模型Pvalue<0.0001,表明此模型对提取率的响应极显著。失拟项的P值和F值分别为0.3721 和1.37,证明该模型模拟的准确性。此外,在回归模型中,决定系数(R2)为0.9823,调整后的决定系数R2adj为0.9596,精密度高达16.463,变异系数(CV%)低至3.45,表明实验值与预测值呈现高度相关性。3 个变量二次项F值顺序为:A>C>B,表明3 个因素对SLP 提取率的影响顺序依次为:超声温度(A)>液料比(C)>超声时间(B)。

表3 SLP 提取率回归模型的方差分析结果
2.2.2 响应面分析
利用Design Expert 8.0.6 软件绘制交互作用的二维等高线及三维响应面图(图5)。如图5a 所示,超声温度边的曲线呈抛物线,而超声时间边几乎保持直线,曲线较为平滑,这结果表明提取温度对SLP得率的影响尤为重要。因为在一定范围内提高提取温度可显著破坏植物细胞壁,从而使溶剂充分渗透,促进细胞内多糖扩散到溶剂中[10]。二维等高线稀疏,说明超声温度与超声时间的交互作用并不明显。如作用,对SLP 得率的影响显著(P<0.05)。图5e 所示,液料比的斜率明显大于超声时间的斜率,表明液料比对SLP 得率的影响大于超声时间且根据二维图两者的交互作用显著。当液料比适当升高时,相对较大的溶剂浓度梯度同样也提高了多糖的传质效率和驱动力,促进了超声提取过程[10]。而当液料比从40 上升至50 mL/g,SLP 得率下降的原因可能是溶剂过多导致的多糖溶解度降低所致。图5c 所示,三维图响应面的曲面陡峭,二位等高线密集,说明超声温度与液料比之间存在较大的交互

图5 三因素交互作用的三维响应面和二维等高线图
2.2.3 预测模型的验证和最佳工艺条件的确定
根据上述结果,RSM 优化后的最佳条件为超声温度59.62℃、超声时间59.55 min、液料比40.26 mL/g,SLP 得率预测为1.95%。根据实际条件及操作误差考虑,最佳工艺条件修改为:超声温度60℃、超声时间60 min、液料比40 mL/g。
为检验模型方程在最佳响应值预测中的准确性,进行了3 次平行实验。SLP 实际得率为1.96%±0.12%,与预测值基本吻合(P>0.05)。因此,结果表明所采用的回归模型在RSM 优化超声辅助提取甘蔗叶多糖工艺研究条件的显著性和适用性。
2.2.4 与传统热水提取法的比较
2 种不同方法提取 SLP 得率分别为1.96%±0.12%和0.89%±0.23%,UAE 大大提高了SLP得率(约120%),并将提取时间从3 h 缩短至2 h,更能证明UAE 对于甘蔗叶多糖提取的优异性。
3 结论
通过单因素及响应面优化超声辅助提取SLP 的最佳工艺条件为:超声功率360 W、超声温度60℃、超声时间60 min 及液料比40 mL/g。在此条件下SLP实际得率为1.96%±0.12%,与预测值1.95%基本吻合。此外,为了评估超声辅助法(UAE)提取SLP 的提取效率,将其与传统热水法(HWE)进行比较,结果表明,通过UAE 法提取SLP 提取率提高约120%,提取时间从3 h 大大减少至2 h。总体而言,通过响应面法优化超声辅助提取甘蔗叶多糖工艺,不仅是甘蔗叶多糖提取工艺上的技术突破,该研究也为甘蔗叶多糖在工业化生产提供了新的思路。

