三聚甲醛-甲醛-水-[BMIM][NO3] 的气液相平衡研究









摘要:研究了离子液体1-丁基-3-甲基咪唑-硝酸盐([BMIM][NO3])对甲醛-水(FA-H2O)、三聚甲醛-水(TOX-H2O)体系的气液相平衡的影响。结果表明,[BMIM][NO3] 的加入可以有效改善体系的气液相平衡,加入摩尔分数为0.070 的[BMIM][NO3] 可以使共沸现象消失。将非随机双液(NRTL) 模型用于关联实验数据,TOX-H2O-[BMIM][NO3] 三元物系计算值与实验值的平均相对偏差为1.32%, FA-H2O-[BMIM][NO3] 三元物系计算值与实验值的平均相对偏差为1.74%。测定了TOX-FA-H2O-[BMIM][NO3] 的气液平衡数据,结果表明,[BMIM][NO3] 的加入可以使平衡时气相中的TOX 摩尔分数增加17.49%。研究结果对提高气相中TOX 的摩尔分数具有理论指导意义。
关键词:三聚甲醛;甲醛;气液平衡;离子液体;NRTL 模型
中图分类号:TQ311 文献标志码:A
三聚甲醛(TOX) 是甲醛(FA) 的环状三聚体,具有优异的水溶性和生物活性,被广泛用于生产杀虫剂、成型材料、抗菌剂和黏合剂[1]。TOX 还被用于合成工程塑料的聚甲醛(POM) 和柴油添加剂多聚甲醛二甲醚(PODEn)[2]。
目前,TOX 的主要生产工艺是以硫酸为催化剂的液相路线[3]。在反应器中,大量的FA 和H2O 与TOX 一起进入气相,形成TOX-H2O、FA-H2O 共沸体系,导致分离困难[4]。在实际生产过程中,气相产物中TOX 的平衡摩尔分数仅为2% 左右[5]。因此很难从TOX-FA-H2O 中分离出高纯度的TOX。
改善TOX-FA-H2O 体系的气液相平衡是提高平衡气相中TOX 含量的有效途径。离子液体(IL) 是改变气液相平衡的潜在添加剂,可用于调节不同组分之间的相对挥发度[6]。Li 等[7] 研究了2-丁酮-乙醇-ILs([EMIM][DEP]、[BMIM][DEP]、[BMIM][DBP]) 三元体系在101.3 kPa 下的等压气液相平衡(VLE)。结果表明,当ILs 添加到一定剂量时,该体系共沸现象消失。Yao 等[8] 分别测定了加入1-丁基-3-甲基咪唑-四氟硼酸盐([BMIM][BF4]) 和1-乙基-3-甲基咪唑-四氟硼酸盐([EMIM][BF4]) 后异丙醇-水体系的相平衡变化,结果表明加入离子液体可以改善体系的相平衡。
前期实验结果表明, 添加离子液体可以提高TOX 的收率[9]。然而,加入离子液体对气液相平衡的影响尚不明确。本文研究了在101.3 kPa 下离子液体1-丁基-3-甲基咪唑-硝酸盐([BMIM][NO3])的加入对TOX-H2O、FA-H2O 和TOX-FA-H2O 体系的相平衡影响,采用了非随机双液(NRTL) 模型进行数据拟合[10]。研究结果有助于分析离子液体强化TOX 分离的机理。
1 实验部分
1.1 原料和试剂
TOX(质量分数≥99.5%) 和FA 溶液(质量分数37%) 购自成都市科隆化学品有限公司。水由超纯水净化器 (优普超纯技术有限公司,中国成都) 制备,其电导率为0.8~1.2 μS/cm。离子液体[BMIM][NO3] (质量分数≥99%) 购自中国青岛奥瑞克新材料科技有限公司,在373.15 K 和真空条件下干燥24 h,以除去挥发性杂质。通过卡尔费休滴定法测得离子液体中水的质量分数小于0.000 5。
1.2 实验步骤与表征
使用Modified-Othmer 型气液平衡釜测定气液相平衡数据,其装置如文献[11] 所示。平衡釜的总容积约为50 cm3。每次实验开始时,向平衡釜中注入40 mL的溶液,用加热棒加热溶液,产生的蒸气在冷凝管中冷凝并在平衡釜中形成回流。当30 min 内温度的变化小于0.1 K 时,表明体系达到了相平衡,然后对平衡后的气相和液相进行取样分析。使用乙醇作为内标物,采用配备GDX-101 填料柱和FID 检测器的气相色谱仪(SC-3000B,重庆川仪自动化股份有限公司) 分析TOX 摩尔分数。氮气、氢气和空气的流速分别为20、30、100 mL/min。采用程序升温,在413 K 下保持5 min,然后以20 K/min 的速度升温至453 K,并在该温度下保持7 min。根据GB/T 9009—2011,利用亚硫酸钠滴定法测定甲醛的浓度。
2 结果与讨论
2.1 TOX-H2O、FA-H2O 二元体系相平衡数据
在101.3 kPa 下测定了TOX-H2O、FA-H2O 二元体系的气液相平衡数据,分别列于表1、表2。表中,xi 和yi 分别是组分i 在液相和气相中的摩尔分数;T 是平衡温度,K;γi 是组分i 的活度系数;αij 代表组分i 对组分j 的相对挥发度。计算公式如下:
i =pyi/pisxi(1)
αi j =yi/ xi/yj/xj=pisγi/pjsγj(2)
式中:p 为总压,kPa;pis 表示组分i 在T 温度下的饱和蒸气压,kPa,其值可以通过Antonine 方程求出[8]。
lg psi= A-"B/T/K +C(3)
其中,A,B,C 分别为TOX、FA 和H2O 在大气压下的Antonine 系数,列于表3。
将实验结果分别与文献结果进行比较, TOXH2O体系的气液相平衡数据和邱祖民等[12] 的实验数据非常吻合,FA-H2O 体系的气液相平衡实验数据与Masamoto 等[13] 的实验数据吻合,说明数据准确和实验方法可靠。
2.2 TOX-H2O-[BMIM][NO3] 三元体系相平衡数据
在101.3 kPa 下,测定了TOX-H2O-[BMIM][NO3]三元体系的气液相平衡数据,列于表4 与图1。离子液体[BMIM][NO3] 的摩尔分数分别为0.007 5,0.050 0,0.100 0。
从图1 可以看出,气相中TOX 的摩尔分数随着[BMIM][NO3] 摩尔分数的增加而增加, 同时[BMIM][NO3] 的加入提高了TOX 对H2O 的相对挥发度。TOX 的活度系数随[BMIM][NO3] 摩尔分数的增加而增加,相反,H2O 的活度系数随[BMIM][NO3]摩尔分数的增加而下降, 这说明[BMIM][NO3] 和H2O 之间的作用力大于[BMIM][NO3] 和TOX 之间的作用力。当[BMIM][NO3] 摩尔分数达到0.100 0时,可以打破体系共沸。
2.3 FA-H2O-[BMIM][NO3] 三元体系相平衡数据
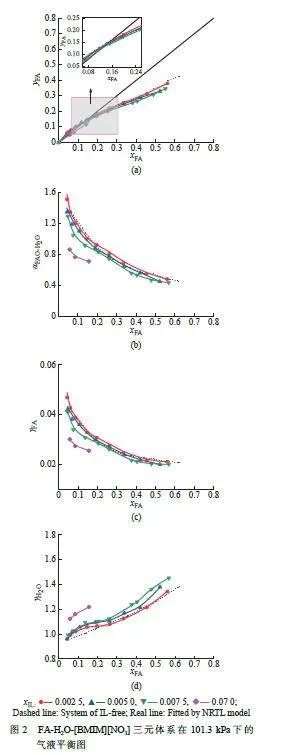
在101.3 kPa 实验条件下, 测定了FA-H2O-[BMIM][NO3] 三元体系的气液相平衡数据,列于表5与图2。其中,离子液体[BMIM][NO3] 的摩尔分数分别为0.002 5,0.005 0,0.007 5,0.070 0。
从图2 可以看出,气相中FA 的摩尔分数随着[BMIM][NO3] 摩尔分数的增加而减小, 同时[BMIM][NO3] 的加入降低了FA 对H2O 的相对挥发度。FA 的活度系数随[BMIM][NO3] 摩尔分数的增加而减小,H2O的活度系数随[BMIM][NO3] 摩尔分数的增加而增大,这说明[BMIM][NO3] 和FA 之间的作用力大于[BMIM][NO3] 和H2O 之间的作用力。当[BMIM][NO3]摩尔分数达到0.070 时,可以打破体系共沸。
2.4 相平衡数据关联
利用NRTL 方程[15] 对相平衡数据进行关联,得到二元交互作用参数(表6) 。采用Levenberg-Marquardt 方法[16] 对实验数据进行模型参数回归,使目标函数最小化,平均相对偏差(ARD)表达式如式(4)所示。
式中:γexpi 和γcali分别代表组分 i 的实验活度系数和计算得到的活度系数,n 是实验点的数量。拟合曲线示于图1~图2 中。由表6 可知,TOX-H2O-[BMIM][NO3]体系的ARD 为1.32%, FA-H2O-[BMIM][NO3] 体系的ARD 为1.74%,表明NRTL 模型能较好地拟合实验结果。
根据NRTL 模型计算结果, 对于TOX-H2O-[BMIM][NO3] 体系,消除共沸点所需的[BMIM][NO3]的最小摩尔分数为0.091 7。实验中当加入[BMIM][NO3]的摩尔分数为0.100 0 时,其共沸现象消失,计算结果与实验结果相符。对于FA-H2O-[BMIM][NO3]体系,消除共沸点所需的[BMIM][NO3] 的最小摩尔分数为0.060 1,与实验结果相符。
2.5 TOX-FA-H2O-[BMIM][NO3] 体系相平衡
所测体系的原始组成(摩尔分数) 为: FA 31.31%,TOX 2.08%,H2O,66.61%。[BMIM][NO3] 的摩尔分数范围为0~0.01,数据列于表7。
如表7 所示,体系中各气相组分的摩尔分数范围为: yFA, 0.184 0~0.201 2; yTOX, 0.022 8~0.026 2,相较于未加入离子液体时(yTOX=0.022 3,yFA=0.206 6),气相中TOX 的平衡摩尔分数增加2.24%~17.49%, FA 的平衡摩尔分数降低2.61%~9.29%。实验结果表明,对于所测反应体系,通过加入适量的离子液体可以提高TOX 的气相组成,有利于TOX 的生产。从表7 数据可以看出,NRTL 模型预测的结果与实验结果相比,误差小于2%,表明NRTL 模型可用于预测TOXFA-H2O-[BMIM][NO3] 体系的相平衡。
3 结 论
(1) 测定了二元体系TOX-H2O、FA-H2O 和三元体系TOX-H2O-[BMIM][NO3]、FA-H2O-[BMIM][NO3]的气液相平衡数据,结果表明,[BMIM][NO3] 的加入可以有效改善体系的气液相平衡,加入一定量的[BMIM][NO3] 可以使共沸现象消失。
(2) NRTL 模型成功用于关联实验数据。通过用模型拟合实验数据,得到了相互作用参数,计算可得TOX-H2O-[BMIM][NO3] 三元物系的平均相对偏差为1.32%, FA-H2O-[BMIM][NO3] 三元物系的平均相对偏差为1.74%。
(3) 测定了TOX-FA-H2O-[BMIM][NO3] 的气液相平衡数据,结果表明,[BMIM][NO3] 的加入可以使平衡时气相中TOX 的摩尔分数增加2.24%~17.49%。利用三元体系关联得到的NRTL 模型参数,成功用于预测TOX-FA-H2O-[BMIM][NO3] 四元体系的气液相平衡数据,其误差小于2%。
参考文献:
[ 1 ]YIN L, HU Y, WANG H. The remarkable effect of organicsalts on 1, 3, 5-trioxane synthesis[J]. Petroleum Science,2016, 13(4): 770-775.
[ 2 ]MASAMOTO J, HAMANAKA K, YOSHIDA K, et al.Synthesis of trioxane using heteropolyacids as catalyst[J].Angewandte Chemie International Edition, 2000, 39(12):2102-2104.
[ 3 ]贾镜渤. 可溶酸液相合成法三聚甲醛制备的工艺管理[J].化工管理, 2022(34): 156-158.
[ 4 ]PEI X P, LI H, ZHANG Z S, et al. Process intensificationfor energy efficient reactive distillation of trioxane productionfrom aqueous formaldehyde[J]. Chemical Engineeringand Processing, 2022, 175: 108914.
[ 5 ]GRUTZNER T, HASSE H, LANG N, et al. Developmentof a new industrial process for trioxane production[J].Chemical Engineering Science, 2007, 62(18): 5613-5620.
[ 6 ]WERNER S, HAUMANN M, WASSERSCHEID P. Ionicliquids in chemical engineering[J]. Annual Review ofChemical and Biomolecular Engineering, 2010, 1: 203-230.
[ 7 ]LI W, LI L, ZHANG L, et al. Isobaric vapor-liquidequilibrium for 2-butanone + ethanol plus phosphate-basedionic liquids at 101.3 kPa[J]. Fluid Phase Equilibria, 2018,456: 57-64.
[ 8 ]YAO G, YANG Z, ZHANG B, et al. Vapor pressure andisobaric vapor-liquid equilibrium for dichloronitrobenzeneisomers[J]. Fluid Phase Equilibria, 2014, 367: 103-108.
[ 9 ]XIE H, LV L, ZHANG T, et al. Reaction kinetics of trioxanesynthesis from formaldehyde catalyzed by sulfuricacid/ionic liquid[J]. Reaction Kinetics Mechanisms andCatalysis, 2021, 133(2): 825-840.
[10]CHEN G, LIANG J, HAN J, et al. Solubility modeling,solute-solvent interactions, and thermodynamic dissolutionproperties of p-nitrophenylacetonitrile in sixteen monosolventsat temperatures ranging from 278.15 to 333.15 K[J].Journal of Chemical amp; Engineering Data, 2019, 64(1): 315-323.
[11]CAO J, YU G, CHEN X, et al. Determination of vaporliquidequilibrium of methyl acetate + methanol + 1-alkyl-3-methylimidazolium dialkylphosphates at 101.3 kPa[J].Journal of Chemical amp; Engineering Data, 2017, 62(2): 816-824.
[12]邱祖民, 骆赞椿, 胡英. 三聚甲醛-水二元系的气液平衡研究[J]. 南昌大学学报(理科版), 1996(1): 9-13.
[13]MASAMOTO J, MATSUZAKI K. A study of vapor-liquidequilibrium of formaldehyde-water mixtures using chemicaltheory[J]. Journal of Chemical Engineering of Japan,1994, 27(1): 6-11.
[14]ZHANG X, HU Y, MA W, et al. Vapor-liquid andchemical equilibria model for formaldehyde+1, 3, 5-trioxane+ methanol plus salt plus water system[J]. Fluid PhaseEquilibria, 2020, 507: 112434.
[15]王俊, 黄秀辉, 崔国民. 碘硫循环制氢中HI 浓缩精馏的模拟[J]. 华东理工大学学报(自然科学版), 2020, 46(1): 92-99.
[16]KHOIROH I, LEE M. Vapor-liquid equilibria of binarysystems composed of polyoxyethylene 4-octylphenyl etherand alcohols: Experimental measurements and correlation[J]. Fluid Phase Equilibria, 2013, 360: 111-117.
[17]许源. 利用离子液体萃取精馏剂分离三聚甲醛的研究 [D]. 北京: 中国石油大学 (北京), 2021.
(责任编辑:张欣)
基金项目: 中央高校基本科研业务费(2022SCUH0041,SCU2023D012)

