地奥心血康基于肠道菌群改善阿霉素致心脏毒性的作用研究
袁楚桥,王涛,邹文俊
以阿霉素(Doxorubicin,DOX)为代表的蒽环类药物产生的心脏毒性已成为威胁肿瘤患者生存的严峻问题。当前有高达60%的癌症患者接受蒽环类药物治疗[1],随着化疗周期的增加,患者出现药物剂量依赖性的不可逆心肌损伤,最终导致充血性心力衰竭(congestive heart failure, CHF)[2],其病机与氧化应激、炎症、线粒体损伤、钙离子超载等多种损伤因素有关[3]。临床通过对DOX进行化学结构修饰,或与右丙亚胺(Dexrazoxane),β受体阻滞剂、辅酶Q10、维生素D等药物联用以治疗阿霉素致心脏毒性[4-5],但右丙亚胺存在明显的骨髓抑制作用,其余心脏保护剂亦缺乏高级别循证医学证据确证其疗效。因此,寻找疗效稳定,副作用小的药物是目前临床面临的一个紧迫问题。
近年研究表明,心脏与肠道存在密切关联,心肌受损后供血能力下降,可能导致肠粘膜毛细血管通透性增加,造成肠道内环境改变,肠道菌群及其代谢产物紊乱[6],菌群变化产生的内毒素通过肠粘膜进入体循环,引发全身炎症反应,加深心脏损伤[7],形成心肌损伤与肠道损伤的“恶性循环”。而化疗药物DOX不仅特异性蓄积于心脏组织,且其通过粪便排泄,可破坏肠道黏膜蛋白的物理屏障引起肠道损伤[8-10]。因此,调控肠道菌群可能成为干预DOX心脏毒性的一个新思路。
地奥心血康(Di'aoxinxuekang, DKKX)是1 9 8 9 年获批的原二类中药,收载于2 0 2 0版《中国药典》,由薯蓣科植物穿龙薯蓣(DioscoreanipponicaMaκino)根茎提取物组成,它具有多种生物功能和药理活性,如抗炎,扩张冠脉血管,改善心肌缺血等。DXXK含有丰富的皂苷类成分,具有显著的心脏保护作用[11],同时已有研究表明DXXK的原料药物穿龙薯蓣可以调节肠道菌群,调控大肠杆菌、白色葡萄球菌等菌株的活性[12],且薯蓣皂苷元作为DXXK的主要有效成分,可以提高大鼠肠道中乳酸菌转化率,维持肠道内环境稳态[13]。综上所述,DXXK作为可通过调控肠道菌群以终止心肠互损的恶性循环。本研究旨在通过DOX致大鼠心肌损伤模型,以肠道菌群为切入点,探究DXXK对DOX心脏毒性的改善作用。
1 材料和方法
1.1 材料和仪器
地奥心血康胶囊购自成都地奥集团(成都,中国),批号190801。注射用多柔比星(批号:2112E3)购自深圳万乐药业有限公司(深圳,中国)。肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)(批号:142622001)的血清生化试剂盒购自深圳迈瑞生物医疗电子有限公司(深圳,中国);心肌肌钙蛋白(cTnT)、脑钠肽(BNP)、肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、白介素-6(IL-6)等酶联免疫吸附测定试剂盒购自武汉伊莱瑞特有限公司。
RM6240BD型多道生理信号采集处理系统(成都仪器厂)、AE224型分析天平(上海舜宇恒平科学仪器有限公司)、RM2235型石蜡切片机(德国Leica公司)、DM1000徕卡显微成像系统、TGL-16高速冷冻离心机(湘仪离心机仪器有限公司)、V4800高通量组织研磨仪(北京鼎昊源科技有限公司)、多功能酶标仪。
1.2 实验动物
8周龄雄性Sprague Dawley大鼠体质量220~240 g,购自北京华阜康生物科技股份有限公司(北京,中国,No.SCXK (京) 2019-0008)。所有动物在特定的条件下饲养,温度(20±5℃),相对湿度(55%±5%),交替光照(12 h光照/12 h黑暗周期),自由饮食饮水。所有操作均按中国《实验动物爱护和使用指导原则》进行。
1.3 实验设计
实验前,所有动物均适应性喂养1周。大鼠随机分为6组(n=6):对照组、DOX组、Dexrazoxane阳性组、DXXK低、中、高组。其中对照组每周腹腔注射生理盐水,其余每周腹腔注射阿霉素(生理盐水配制)1次,按照2.5 mg·kg-1, 1 mL/100g剂量给药,连续6周,总剂量 15 mg·kg-1;同时,DXXK组大鼠分别按50 mg·kg-1、100 mg·kg-1、200 mg·kg-1剂量每天灌胃,对照组及模型组给予等量蒸馏水,连续6周。末次灌胃结束后,禁食禁水12 h,以腹部按摩法收集大鼠粪便,放入冻存管中液氮速冻,放入-80℃冰箱中保存备用。用异氟烷麻醉,采集每只大鼠的腹主动脉血并收集心脏及结肠内容物。
1.4 苏木精-伊红染色
将心脏组织用4%多聚甲醛固定,石蜡包埋。切割石蜡切片(5 μm厚),并将其安装在玻璃片上进行苏木精-伊红(HE)染色。组织学图像用光学显微镜(奥林巴斯,东京,日本)以×400倍的倍率拍摄。
1.5 SD大鼠心功能检测
在大鼠末次灌胃给药后放入小动物麻醉机,使用异氟烷麻醉大鼠。将其仰面固定在实验台上,使用生物信号采集系统采集大鼠的心电图信号,将正负电级分别插入大鼠右上肢和左下肢,将底线插入大鼠的右下肢,记录各组大鼠15 min的Ⅱ导联的心电图,记录其P波、T波、R波、Q波、S波、ST波幅度和大鼠的心率情况。
1.6 心肌酶和炎症因子检测
取大鼠心脏组织,称重后按照说明书加入生理盐水,加入高通量组织研磨仪制备匀浆,按相应试剂盒说明书要求,测定肌酸激酶同工酶MB(CK-MB)、乳酸脱氢酶(LDH)、心肌肌钙蛋白(cTnT)、脑钠肽(BNP)、肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)、白介素6(IL-6)水平。
1.7 16S rRNA扩增序列测定
处死动物前,取粪便放入无菌EP管中,保存于-80°C中进行16S rRNA分析。获得的最终序列用于操作分类单位(OTUS)分析。根据最大样本量分析结果,采用样本序列随机抽样的方法,计算了基于丰度的盖度估计器和CHAO1等代表物种丰富度的alpha多样性指数和以PCoA分析代表的β多样性指数。
1.8 统计分析
本研究数据通过 SPSS 23.0 软件进行处理,数据以均值±标准差(SD)表示,若数据满足正态分布且方差齐,则两组比较采用t检验,多组比较采用单因素方差分析;若其不满足,则采用秩和检验。若P<0.05,则表示数据差异具有统计学意义。
2 结果
2.1 地奥心血康对阿霉素致心脏损伤大鼠心脏功能及形态的影响
与对照组相比,模型组P波及Q波幅度显著降低(P<0.01),R波、T波、S波、ST波幅度明显升高(P<0.01),提示模型组大鼠存在心肌缺血及心电电位异常,如图1(A-F);心肌组织出现纤维变性及坏死,且出现心肌纤维溶解或断裂,部分区域心肌纤维胞质内含空泡,如图2 B;与模型组相比,阳性药组和DXXK高剂量组的 P波及Q波幅度显著升高(P<0.01),R波、T波、S波、ST波幅度显著降低(P<0.01);心脏组织结构完整,未见明显增生或炎性浸润,心肌纤维形态正常如图2 C、F;而DXXK低剂量组P波、Q波、R波、S波、ST波幅度均存在升高趋势,但差异不具有统计学意义;DXXK中剂量组P波、R波幅度存在升高趋势,S波存在降低趋势,但均无统计学意义;T波、Q波、ST波幅度显著升高(P<0.05),如图1 (A-F)。DXXK低、中剂量组的能显著改善心肌组织炎性细胞浸润及纤维结缔组织增生,但改善效果弱于高剂量组,如图2D、E。
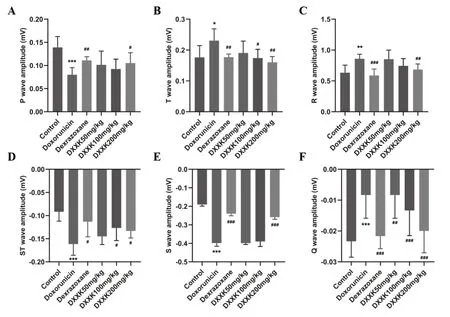
图1 心血康对阿霉素致心肌损伤大鼠心电图的影响(A-F)心电图P波幅度、T波幅度、R波幅度、ST波幅度、S波幅度、Q波幅度。

图2 心血康对阿霉素致心肌损伤大鼠心肌病理变化的影响(A-F)分别为对照组、模型组、阳性组、心血康低、中高、剂量组心脏组织病理情况。
2.2 地奥心血康对阿霉素致心脏损伤大鼠心肌酶及炎症因子水平的影响
与对照组大鼠相比,模型组C K-M B、LDH、BNP、cTnT水平升高,差异具有显著性(P<0.01);与模型组相比,阳性药组、DXXK中、高剂量组的CK-MB、LDH、BNP、cTnT水平显著降低(P<0.01);心血康低剂量组CK-MB、LDH、cTnT水平具有降低趋势,但差异没有统计学意义,BNP水平显著降低(P<0.01),如图3。炎症与心肌损伤密切相关,本实验检测了大鼠心脏组织的炎症因子水平,。与对照组相比,模型组IL-1β、IL-6、TNF-α等炎症因子水平显著上升(P<0.01);与模型组相比,阳性药组、DXXK低、中、高剂量组的炎症因子水平均有不同程度降低,差异均具有统计学意义(P<0.05),如图4。
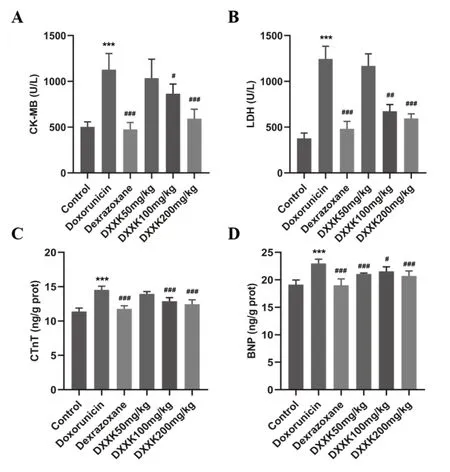
图3 心血康对阿霉素致心肌损伤大鼠心肌酶水平的影响A:CK-MB;B:LDH;C:cTnT;D:BNP水平。

图4 心血康对阿霉素致心肌损伤大鼠炎症因子水平的影响A:TNF-α;B:IL-1β;C:IL-6水平。
2.3 地奥心血康对阿霉素致心脏损伤大鼠肠道菌群多样性的影响
根据前两部分的结果,选取对照组、模型组、DXXK高剂量组进行后续研究。通过双端测序发现,18个样本共获得个OTUs,对照组、模型组、DXXK组OTU数目分别是2178、1480、1676,共有OTUs57个,如图5 A。

图5 心血康对阿霉素致心肌损伤大鼠肠道菌群Alpha多样性的影响A:样本组间OTUs韦恩图;B:Chao1指数稀释曲线;C:Simpson指数稀释曲线;D:Shannon指数稀释曲线;E:Chao1指数分析;F:Simpson指数分析;G:Shannon指数分析
Alpha多样性检测结果表明,随着测序量增加,曲线趋近平滑,仅增加少量新物种,说明测序数据量已经合理。Chao1指数可以估计群落中包含的物种数目;Shannon指数通过信息熵计算,Shannon指数越大,群落的不确定性越高,则该群落中未知因素越多,即多样性高;Simpson指数的数值范围在0-1之间,当群落中物种数仅为1时, Simpson值为0,直观理解为多样性最小;当物种种类趋近无限多,且各物种数目一致时,该群落的物种丰富度最高,均匀度最高,Simpson值为1。本研究中,各组样本的 Chao、Shannon、Simpson 等指数见图5 B-D。与对照组相比,模型组Chao1 指数、Shannon指数及Simpson指数显著降低(P<0.05);与模型组相比,DXXK组的Chao1 指数、Shannon指数及Simpson指数显著升高(P<0.05),如图5E-G。
本研究基于unweighted unifrac 距离算法,采用主坐标分析法(Principal Coordinates Analysis,PCoA),评估大鼠肠道菌群 β 多样性,见图6。结果表明,横坐标PC1 为 17.46%,PC2 为 17.07%,;由PC1轴距离可见,3组组间差异明显,模型组点群与对照组偏差较大,而心血康组与对照组距离较近,说明二者菌群结构相似度较高。

图6 心血康对阿霉素致心肌损伤大鼠肠道菌群Beta多样性的影响
2.4 地奥心血康对阿霉素致心脏损伤大鼠肠道菌群组成的影响
根据物种丰度表和物种注释表,本研究选取丰度TOP30物种分类,如图7A。在门水平上,3组的优势菌群均为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota),变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)。与对照组相比,模型组厚壁菌门、变形菌门占比上升,疣微菌门占比下降;与模型组相比,心血康组厚壁菌门、变形菌门和疣微菌门占比下降,拟杆菌门占比上升,如表1。在属水平上,对照组的优势菌属为:未知的Muribaculaceae菌属(Muribaculaceae_unclassified)、乳酸菌属(Ligilactobacillus)、乳杆菌属(Lactobacillus)、HT002菌属(HT002)、艾克曼菌属(Akkermansia);模型组的优势菌属为:未知的Muribaculaceae菌属、乳杆菌属、乳酸菌属、埃希氏杆菌属(Escherichia-Shigella)、HT002菌属;心血康组的优势菌属为:未知的Muribaculaceae菌属、乳杆菌属、普雷沃氏菌属(Prevotella)、乳酸菌属和HT002菌属,如图7B。在3组的共有优势菌属中,与对照组相比,模型组未知的Muribaculaceae菌属、乳酸菌属的占比降低,乳杆菌属和HT002菌属占比升高;与模型组相比,心血康组乳杆菌属、乳酸菌属、HT002菌属占比降低,未知的Muribaculaceae菌属的占比上升,如表2。
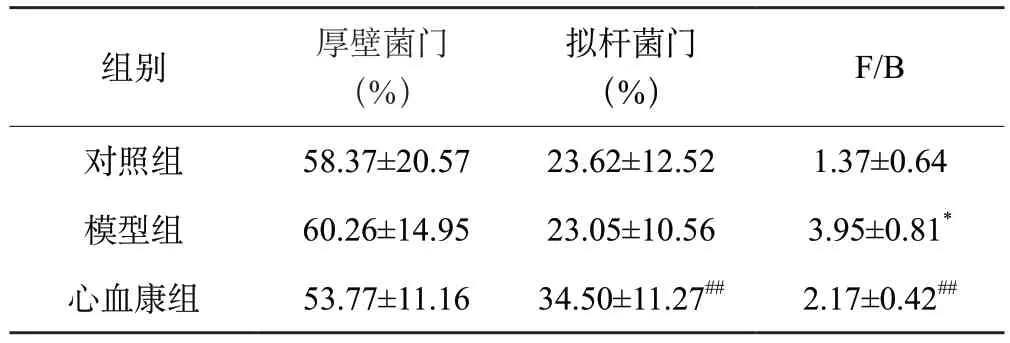
表1 样本组间肠道菌群厚壁菌门、拟杆菌门相对丰度及比值

表2 样本组间肠道菌群共有优势菌属相对丰度

图7 心血康对阿霉素致心肌损伤大鼠肠道菌群物种丰度及组成的影响A:样本组间门水平物种丰度堆叠图;B:样本组间属水平物种丰度堆叠图;C:样本组间差异分析进化分支图;D:样本组间差异分析分布柱状图
本研究采用LEfSe(LDA Effect Size)分析3组组间在丰度上有显著性差异的物种,设置LDA阈值为4,筛选结果如图7C、D。对照组的差异物种主要为拟杆菌门(p_Bacteroidota)、拟杆菌纲(c_Bacteroidia)、拟杆菌目(o_Bacteroidales)、普雷沃氏菌科(f_Prevotellaceae)、普雷沃氏菌属(_Prevotella_unclassified;g_Prevotella)、类杆菌属(_Bacteroides_sp_);模型组的差异物种主要为丹毒丝菌科(f_Erysipelotrichaceae)、异杆菌属(Allobaculum_unclassified;g_Allobaculum);心血康组的差异物种主要包括疣微菌门(p_Verrucomicrobiota)、疣微菌纲(c_Verrucomicrobiae)、疣微菌目(o_Verrucomicrobiales)、艾克曼菌属(f_Akkermansiaceae;
g_Akkermansia; Akkermansia_unclassified)
3 讨论
中医理论认为“心与小肠相表里”,心气可以推动血液顺畅运行,促进肠道泌别清浊的功能。同时“小肠主津”,可吸收水谷精微之津液以供心化血,兼养百脉[14]。而肠道菌群作为维持肠道稳态的重要角色,被称为“微生物器官”,是心肠联系的重要桥梁,而肠道菌群失调则可能通过介导炎症反应、氧化应激诱发多种心脏疾病[15],前期研究表明,心血康可以通过调控氧化应激保护心肌损伤[16],因此本研究基于16S rRNA测序技术探究地奥心血康通过调控肠道菌群抑制阿霉素心脏毒性的作用。
本研究结果表明,阿霉素在造成严重的心脏损伤的同时,还减少肠道细菌OTUs数目,抑制大鼠肠道菌群丰度及多样性,并导致菌群结构异常偏移。而心血康不仅可以显著恢复心肌细胞膜电位,改善心肌纤维化和炎性浸润,降低心脏炎症及心肌酶水平,还能够调整心肌损伤大鼠的菌群丰度及多样性,并恢复异常偏移的菌群结构,使其贴近正常水平。
有研究表明,肠道中的优势菌群厚壁菌门和拟杆菌门的比值(Firmicutes/Bacteroidota,F/B)可以体现肠道内稳态水平,F/B异常升高往往与炎症反应或肥胖相关[17]。通过物种堆叠图分析,本实验3组大鼠的肠道菌群结构均存在差异,与对照组相比,模型组厚壁菌门相对丰度升高,拟杆菌门相对丰度降低,F/B 值增大,说明阿霉素诱导大鼠肠道内环境紊乱。给药后,DXXK组厚壁菌门相对丰度降低,拟杆菌门相对丰度升高,F/B 值减小,说明地奥心血康可以改善阿霉素诱导的菌群紊乱。在属水平上,3组大鼠的肠道菌群存在结构差异,心肌损伤大鼠志贺菌属、乳杆菌属及HT002菌属相对丰度较对照组明显上升,给药后丰度回调,说明心血康可能通过调控上述菌属的数量以恢复菌群稳态。另外,与对照组及模型组比较,心血康组中普雷沃菌属丰度显著升高,该菌属作为肠道重要的基石菌属,其代谢产物短链脂肪酸(SCFAs)对于肠道粘膜具有显著的保护作用[18],说明心血康在保护阿霉素诱导的心肌损伤的同时,可能通过调控菌群稳态,并间接参与修复肠道粘膜,对肠道产生保护作用。
LEfSe 结果表明,对照组特征细菌主要为拟杆菌、普雷沃氏菌和类杆菌等常见肠道菌种;模型组的特征细菌则为异杆菌,高丰度的异杆菌通常出现于肥胖大鼠异常的肠道环境中[19],说明阿霉素的干预促进了该致病菌的增殖;而心血康组的特征细菌为艾克曼菌属,艾克曼菌可以分解肠道粘蛋白,利用分解糖苷键的糖苷酶,将寡聚糖分解成单糖为更多的益生菌所发酵利用[20]。该结果表明,心血康可以通过上调益生菌活性改善肠道内环境。
综上,地奥心血康可以调控阿霉素致心肌损伤大鼠的肠道微生物环境,可能通过恢复菌群结构,参与修复肠道粘膜,提高益生菌活性并抑制致病菌生长等途径,改善因心肌损伤导致的大鼠肠道菌群紊乱。本研究以肠道菌群为切入点,探究地奥心血康的心脏保护作用,并为其作用机制提供新的视角。

