泛素E3连接酶CHIP介导RCC2的泛素化及降解
李贝 范宇宸 赵博


摘要:目的 本課题组前期构建了一种正交泛素链传递方法,并发现染色体浓缩调节蛋白2(RCC2)是泛素连接酶CHIP的潜在底物。本实验旨在验证CHIP是否能介导RCC2的泛素化及降解,以期通过CHIP来泛素化调控RCC2的表达和功能。方法 首先构建CHIP及其突变体质粒,验证CHIP与RCC2是否有相互作用;然后构建pLVX-RCC2-FLAG重组质粒并转染进CHIP敲减细胞株(shCHIP)、HEK293细胞株、CHIP过表达细胞株(OE CHIP),通过免疫共沉淀下拉富集RCC2-FLAG并检测其泛素化水平;接下来在HEK293细胞中转染不同量的CHIP,以及设置CHX chase蛋白稳定性实验,检测RCC2的蛋白水平变化;最后利用泛素突变体K48R-Ub及K11R-Ub进行CHIP介导RCC2上形成泛素链的实验检测。结果 在HEK293细胞中,CHIP能够介导RCC2的泛素化,并在RCC2上形成K48和K11多聚泛素链,促进其通过蛋白酶体发生降解。本课题组前期构建了一种正交泛素传递方法,并发现染色体浓缩调节蛋白2(RCC2)是泛素连接酶CHIP的潜在底物。本实验旨在验证CHIP是否能介导RCC2的泛素化及降解,以期通过CHIP来泛素化调控RCC2的表达和功能。 方法 首先构建CHIP及其突变体质粒,验证CHIP与RCC2是否有相互作用;然后构建pLVX-RCC2-FLAG重组质粒并转染进CHIP敲减细胞株(shCHIP)、HEK293细胞株、CHIP过表达细胞株(OE CHIP),通过免疫共沉淀下拉富集RCC2-FLAG并检测其泛素化水平;接下来在HEK293细胞中转染不同量的CHIP,以及设置CHX chase蛋白稳定性实验,检测RCC2的蛋白水平变化;最后利用泛素突变体K48R-Ub及K11R-Ub进行CHIP介导RCC2上形成泛素链的实验检测。 结果 在HEK293细胞中,CHIP能够介导RCC2的泛素化,并在RCC2上形成K48和K11多聚泛素链,促进其通过蛋白酶体发生降解。 结论 泛素连接酶CHIP能够介导RCC2的泛素化及降解,为实现通过CHIP来泛素化调控RCC2提供了理论基础。
关键词:泛素化;泛素连接酶CHIP;染色体浓缩调节蛋白2;降解
中图分类号:中图分类号R346文献标志码:A文献标识码
E3 ligase CHIP mediates the ubiquitination and degradation of RCC2
LI Bei,FAN Yuchen,ZHAO Bo*
(School of Pharmacy, Shanghai Jiao Tong University,Shanghai 200240, China)
Abstract: Objective Through the OUT (orthogonal ubiquitin transfer) pathway, we identified RCC2 (regulatory of chromosome condensation 2) as a potential substrate of E3 ubiquitin ligase CHIP. Here, we verified that CHIP can mediate the ubiquitination and degradation of RCC2 and provided a new direction for pharmacology research targeting RCC2. Methods We verified the interaction between CHIP and RCC2 by co-immunoprecipitation. We then examined RCC2 ubiquitination levels in HEK293 cells with knockdown or overexpression of CHIP. To determine if CHIP regulates the degradation of RCC2 by ubiquitination, we transiently transfected CHIP plasmids with titration into HEK293 cells and measured the steady-state levels of RCC2. We also conducted a CHX chase assay to investigate whether CHIP could induce the degradation of RCC2. Furthermore, we validated that CHIP can form K48- and K11- linked polyubiquitin chains on RCC2 by Ub mutants K48R-Ub and K11R-Ub. Conclusions Overall, our work uncovers an important mechanism underlying the regulation of RCC2 through CHIP-mediated ubiquitination and degradation in HEK293 cells.
Through the OUT (orthogonal ubiquitin transfer) pathway, we identified RCC2 (regulatory of chromosome condensation 2) as a potential substrate of E3 ubiquitin ligase CHIP. Here, we verified that CHIP can mediate the ubiquitination and degradation of RCC2 and provided a new direction for pharmacology research targeting RCC2. Methods We verified the interaction between CHIP and RCC2 by co-immunoprecipitation. We then examined RCC2 ubiquitination levels in HEK293 cells with knockdown or overexpression of CHIP. To determine if CHIP regulates the degradation of RCC2 by ubiquitination, we transiently transfected CHIP plasmids with titration into HEK293 cells and measured the steady-state levels of RCC2. We also conducted a CHX chase assay to investigate whether CHIP could induce the degradation of RCC2. Furthermore, we validated that CHIP can form K48- and K11- linked polyubiquitin chains on RCC2 by Ub mutants K48R-Ub and K11R-Ub. Results In HEK293 cells, CHIP can mediate the ubiquitination of RCC2. CHIP can form K48- and K11- linked polyubiquitin chains on RCC2 and promote its degradation. Conclusions Overall, our work uncovers an important mechanism underlying the regulation of RCC2 through CHIP-mediated ubiquitination and degradation.
Key words: ubiquitination;ubiquitin ligase CHIP;RCC2;degradation
泛素化是真核生物中一种广泛存在且非常重要的蛋白质翻译后修饰过程,是在泛素活化酶E1、泛素结合酶E2、泛素连接酶E3的参与下,发生的连续多步的级联反应[1]。首先在ATP的参与下,被活化的泛素Ub C末端的甘氨酸残基与泛素活化酶E1的半胱氨酸残基形成高能硫脂键,然后泛素结合酶E2的半胱氨酸残基进攻高能硫脂键从而将泛素转移到E2上,最后泛素连接酶E3将泛素传递到底物蛋白上,使底物蛋白泛素化[2]。泛素化能够参与调控很多重要的生理过程,包括蛋白质质量调控、DNA损伤修复、细胞信号转导等[1-2]。
迄今为止,在人类细胞中已有2种E1、50多种E2以及600多种E3被鉴定[3]。同一个E3能够接收来自不同E2的泛素并与不同的底物结合,同一个底物也能被不同的E3泛素化调控。作为泛素化级联过程的最后一个反应关键酶,E3与细胞中成千上万个底物有着错综复杂的对应关系。本实验室前期构建了一种正交泛素传递途径(Orthogonal Ubiquitin Transfer, OUT),能够寻找细胞中特定E3的底物[4]。在这种正交泛素传递途径中,人工构建的泛素(xUb)仅能通过人工构建的xE1、xE2、xE3依次传递到特定E3的底物蛋白上。xUb上带有可纯化检测的标签,后续可用来进行质谱及蛋白组学分析等实验,来检测特定E3的潜在的底物蛋白。
泛素连接酶CHIP(carboxyl terminus of Hsc70/Hsp70-interacting protein,CHIP)又名STUB1,是U-box家族泛素连接酶的重要成员[5]。在结构上,CHIP主要的活性结构域是N端的四肽重复结构域TPR结构域和C端的U-box结构域[6]。TPR结构域主要发挥分子伴侣结合蛋白的功能,帮助CHIP与Hsp70和Hsp90等分子伴侣相互作用,C末端的U-box序列发挥泛素化连接酶E3功能。在功能上,CHIP與多种生理过程有关,大量临床数据表明,CHIP与乳腺癌[7]、非小细胞肺癌[8]、胃癌[9]等癌症相关,并且在很多时候扮演着抑癌因子。同时,CHIP通过调节蛋白质质量控制过程,参与了很多蛋白质错误聚集和折叠过程,因此CHIP在一些神经退行性疾病中也具有重要作用[10-11]。
实验室前期研究表明,染色体浓缩调节蛋白2(Regulator of chromosome condensation 2,RCC2)可能是CHIP的潜在底物[12]。CHIP可能与RCC2有相互作用,并通过泛素化调控RCC2。因此,本文探究了在HEK293细胞中CHIP对RCC2的泛素化作用。首先验证了CHIP与RCC2的相互作用,然后通过CHIP敲减细胞株(shCHIP)、HEK293细胞株、CHIP过表达细胞株(OE CHIP)3组细胞系来检测CHIP表达量是否与RCC2的泛素化水平相关。接下来通过CHX-chase稳定性实验、泛素链类型研究等系列实验来证明CHIP与RCC2的泛素化作用。我们的实验结果表明在HEK293细胞中,CHIP可以在RCC2上形成K48和K11泛素链,并介导了RCC2的降解。
1 材料与方法
1.1 材料
人肾胚细胞HEK293细胞株购自中国科学院细胞库,稳定敲减CHIP的HEK293细胞株shCHIP由本课题组构建保存;慢病毒载体pLVX-IRES-3FLAG由本课题组保存,DH5α感受态细胞由本课题组自制保存;胎牛血清、0.25%胰蛋白酶、DMEM高糖培养基、Opti-MEM基础培养基购自Gibco公司;anti-FLAG(M2)抗体(F1804)购自Sigma-Aldrich公司、anti-CHIP抗体、anti-GAPDH抗体、anti-Ub抗体、anti-HA标签抗体、鼠源荧光二抗M800及兔源荧光二抗M800均购自Abcam公司;anti-FLAG(M2) affinity gel(A2220) 购自Sigma-Aldrich公司。转染试剂PEI购自上海翌圣生物科技有限公司、RIPA裂解液(P0013J)购自上海碧云天生物技术有限公司、蛋白酶抑制剂PMSF(HY-B0496)和PIC(HY-K0010)、蛋白酶体抑制剂MG132(HY-13259)、蛋白合成抑制剂放线菌酮CHX(HY-12320)均购自MCE公司。Gel/PCR纯化提取试剂盒、质粒小提试剂盒均购自天根生化科技有限公司。
1.2 方法
1.2.1 细胞复苏及培养
从液氮罐中取出两支冻存的HEK293细胞和稳定敲减CHIP的稳转株(shCHIP),迅速放入37 ℃水浴锅中加热,约1~2 min后,绝大部分冰晶融化,迅速将冻存管进行消毒处理后拿入生物安全柜,将细胞悬液吸出,加入一个有3~5 mL新鲜完全培养基的15 mL离心管中,800 rpm离心3 min。去除上清,加入2 mL新鲜完全培养基到离心管中重悬细胞沉淀,将细胞悬液加入到培养皿中,加入适量完全培养基,十字法交叉法混匀细胞,放入CO2培养箱中培养,后续观察细胞状态。待细胞生长状态良好,汇合度约90%时,可进行传代操作。
1.2.2 HEK293细胞cDNA的获取
取一个6 cm皿生长状态良好,汇合度约80~90%的HEK293细胞,去除培养基,用预冷的PBS润洗几次,洗去残存的培养基。加入500 μL Trizol试剂,置于冰上孵育3~5 min,待细胞完全裂解后,加入100 μL氯仿,上下颠倒使其完全混匀,孵育2~3 min后,离心(4℃,12000 g,15 min),然后小心吸取上面的无色上清层至一个全新EP管中,加入250 μL异丙醇,孵育2~3min后,离心(4℃,12000 g,10 min)。去除上面的液体,加入500 μL 新鲜配制的75%乙醇,涡旋样品,离心(4℃,7500 g,5 min)。弃掉上清,风干5~10 min使RNA完全风干,加入50 μL DEPC水溶解RNA。提取的RNA进行测浓度、琼脂糖电泳检测其质量。用反转录试剂盒进行反转录得到cDNA样品。
1.2.3 目的基因的获取
根据NCBI数据库检索得到的目的基因RCC2的序列,结合载体pLVX-IRES-3FLAG的多克隆酶切位点信息,选择两个酶切位点NdeI和NotI,设计两条引物,上游引物RCC2-F序列为:TACCTTCATATGCCCAGGAAGAAGGCGGC,下游引物RCC2-R序列为:ATCTTAAAGCGGCCGCGAGGGTTCGGGGGTTGTATT。PCR扩增得到目的基因RCC2,通过Gel回收试剂盒回收目的基因。
1.2.4 载体和目的基因PCR产物的双酶切及酶连
根据载体pLVX-IRES-3 FLAG和目的基因PCR产物的浓度,取出约1 μg的载体和约300 ng的PCR产物,用NdeI和NotI两种限制性内切酶进行双酶切,双酶切后的PCR产物和载体进行胶回收。将回收得到的两个酶切产物设置酶连反应,然后用感受态细胞DH5α将酶连后的产物进行化学转化,取适量的菌液涂布在具有氨苄抗性的平板上,放入37℃细菌培养箱中进行过夜培养。第二天挑取平板上长势良好的单克隆进行测序,最后得到序列正确的pLVX-RCC2-3 FLAG质粒。
1.2.5 细胞铺板及转染
待生长状态良好的细胞密度达到80%以上时可进行下一步的铺板操作。首先用血球计数板进行细胞计数,根据培养皿的大小和所需的细胞密度计算铺板量。12~16 h后观察到铺板的细胞均匀分布且密度达到70%~80%左右,可进行细胞转染操作。对于HEK293细胞可使用PEI转染试剂进行转染,去除旧培养基,用PBS润洗2次,确保洗去大部分血清,更换为新鲜的Opti-MEM无血清培养基。
配制PEI-DNA转染混合物。A管加入一定量的质粒,然后加入Opti-MEM培养基,B管加入3倍质粒质量的PEI,然后加入Opti-MEM培养基,两管分别混匀后静置5 min,将B管液体全部慢慢加入A管中,轻柔吹吸几次混匀,静置20~30 min后将全部液体缓慢滴加入培养皿中,转染12~18 h后更換为完全培养基,转染48 h后收样,收样前加入10 μmol·L-1蛋白酶体抑制剂MG132处理4 h。
1.2.6 细胞裂解液及样品的制备
转染48 h后,收取细胞。先用预冷的PBS润洗几次,洗去旧培养基,然后新鲜配制适量的RIPA裂解液(按照1∶100的比例加入PIC、PMSF抑制剂),根据细胞密度加入适量的RIPA 裂解液。加入裂解液后,将培养皿放在冰上静置2~5 min,观察到有细胞碎片脱落时用细胞刮刀刮取,刮取充分后将裂解液吸入EP管中,将EP管放入冰盒中充分振荡使其充分裂解。然后将EP管放入预冷的4 ℃离心机中离心20~30 min,离心后小心将上面的无色上清转移至一个全新的EP管中。检测样品蛋白浓度后,将细胞裂解液制备成1~2 μg·μL-1的样品,于99 ℃煮沸10 min,后续可进行Western Blot检测。
1.2.7 CHIP和RCC2的相互作用
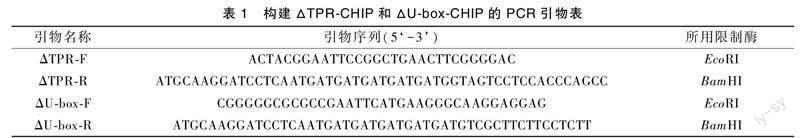
为了证明CHIP与RCC2是否有相互作用,用PCR的方式构建了两个CHIP的突变体:截短了TPR结构域的突变体ΔTPR-CHIP和截短U-box结构域的突变体ΔU-box-CHIP。并且在两个突变体的C末端添加了His标签序列,便于后续的检测。野生型CHIP 采用同样的方法由实验室前期构建。
在HEK293细胞中分别共转RCC2-FLAG和野生型CHIP及两个突变体CHIP,然后通过免疫共沉淀实验下拉RCC2-FLAG,用anti-His进行检测,观察能否检测到His信号,从而判断CHIP与RCC2是否有相互作用。
1.2.8 免疫共沉淀实验检测CHIP对RCC2的泛素化作用
为了检测在HEK293中CHIP对RCC2是否有泛素化作用,设置稳定CHIP敲减细胞株(shCHIP)、HEK293细胞株、CHIP过表达细胞株(OE CHIP)3组,3组转染相同量的RCC2-FLAG质粒,转染后48h收样,收样前用10 μmol·L-1 MG132处理4h。收集细胞裂解液制备样品进行Western Blot检测CHIP、RCC2及GAPDH表达量,确保RCC2表达量一致后,进行免疫共沉淀实验。根据蛋白浓度,每组配制总蛋白1 mg的样品,通过anti-FLAG(M2) affinity gel进行免疫共沉淀实验,一般1个样品需要10~15 μL总beads。取出beads后轻轻摇晃使其混匀,将枪头减去尖端,吸取所需体积到EP管中,加入预冷的PBS,上下混匀后,离心(4 ℃、6 000 r·min-1,1 min),重复洗涤4次。每组样品加入相同体积的beads,加好beads的样品放入摩天轮摇床中,置于4 ℃结合4~6 h。结合好后每组样品中加入预冷的TBS-T溶液洗涤beads,上下颠倒EP管以洗脱杂蛋白,离心(4 ℃、6 000 r·min-1,1 min),重复洗涤5次。最后加入PBS溶液洗涤,离心(4 ℃、6 000 r·min-1,1 min),小心吸去上清,防止吸到EP管底的beads,留40~60 μL液体,加入10~15 μL 5×loading配制样品,置于99 ℃煮沸15 min,待样品冷却后离心,进行Western Blot检测通过免疫共沉淀实验下拉富集蛋白的泛素化水平。
1.2.9 CHIP介导RCC2的降解及CHX-chase稳定性实验
为了进一步证明CHIP介导RCC2的泛素化是否是降解作用,我们进行了降解实验。在HEK293细胞中转染相同量的RCC2-FLAG及不同量的CHIP质粒,CHIP的转染量从0~2 μg梯度增加,检测细胞中RCC2-FLAG的量。同时,使用放线菌酮CHX进行蛋白质稳定性实验,放线菌酮CHX是一种抗真菌抗生素,能够抑制真核生物中新蛋白质合成,便于检测细胞中已合成蛋白质的去向。CHIP敲减细胞株(shCHIP)、HEK293细胞株、CHIP过表达细胞株(OE CHIP)3组细胞中转染相同量的RCC2-FLAG,其余操作均相同,同时加入等量的放线菌酮CHX处理,检测不同时间梯度的RCC2-FLAG的量。
[8]KIM J, CHUNG J Y, PARK Y S, et al. Prognostic significance of CHIP and RIPK3 in Non-small cell lung cancer[J]. Cancers (Basel), 2020, 12(6):1496.
[9]DAI H, CHEN H, XU J, et al. The ubiquitin ligase CHIP modulates cellular behaviors of gastric cancer cells by regulating TRAF2[J]. Cancer Cell Int, 2019, 19: 132.
[10]RUSMINI P, CORTESE K, CRIPPA V, et al. Trehalose induces autophagy via lysosomal-mediated TFEB activation in models of motoneuron degeneration[J]. Autophagy, 2019, 15(4): 631-651.
[11]MYLVAGANAM S, EARNSHAW R, HEYMANN G, et al. C-terminus of Hsp70 interacting protein (CHIP) and neurodegeneration: lessons from the bench and bedside[J]. Curr Neuropharmacol, 2021, 19(7): 1038-1068.
[12]BHURIPANYO K, WANG Y, LIU X, et al. Identifying the substrate proteins of U-box E3s E4B and CHIP by orthogonal ubiquitin transfer[J]. Sci Adv, 2018, 4(1): e1701393.
[13]CHEN R H, CHEN Y H, HUANG T Y. Ubiquitin-mediated regulation of autophagy[J]. J Biomed Sci, 2019, 26(1): 80.
[14]YAU R, RAPE M. The increasing complexity of the ubiquitin code[J]. Nat Cell Biol, 2016, 18(6): 579-586.
[15]CARMENA M, WHEELOCK M, FUNABIKI H, et al. The chromosomal passenger complex (CPC): from easy rider to the godfather of mitosis[J]. Nat Rev Mol Cell Biol, 2012, 13(12): 789-803.
[16]CALDERON-APARICIO A, BODE A M. Roles of regulator of chromosome condensation 2 in cancer: Beyond its regulatory function in cell cycle[J]. Oncology Reviews, 2021, 15(1):525.
[17]WU N, REN D, LI S, et al. RCC2 over-expression in tumor cells alters apoptosis and drug sensitivity by regulating Rac1 activation[J]. BMC Cancer, 2018, 18(1): 67.
[18]FUJII K, MIYATA Y, TAKAHASHI I, et al. Differential proteomic analysis between small cell lung carcinoma (SCLC) and pulmonary carcinoid tumors reveals molecular signatures for malignancy in lung cancer[J]. Proteomics Clin Appl, 2018, 12(6): e1800015.
[19]CHEN Z, WU W, HUANG Y, et al. RCC2 promotes breast cancer progression through regulation of Wnt signaling and inducing EMT[J]. J Cancer, 2019, 10(27): 6837-6847.
[20]YU H, ZHANG S, IBRAHIM A N, et al. RCC2 promotes proliferation and radio-resistance in glioblastoma via activating transcription of DNMT1[J]. Biochem Biophys Res Commun, 2019, 516(3): 999-1006.
[21]PANG B, WU N, GUAN R W, et al. Overexpression of RCC2 enhances cell motility and promotes tumor metastasis in lung adenocarcinoma by inducing epithelial-mesenchymal transition[J]. Clinical Cancer Research, 2017, 23(18): 5598-5610.
[22]CHANUKUPPA V, PAUL D, TAUNK K, et al. XPO1 is a critical player for bortezomib resistance in multiple myeloma: A quantitative proteomic approach[J]. J Proteomics, 2019, 209: 103504.
[23]ZHANG L, LI Q, XU J, et al. Cimetidine promotes STUB1-mediated degradation of tumoral FOXP3 by activating PI3K-Akt pathway in gastric cancer[J]. Ann Transl Med, 2020, 8(20): 1304.
[24]LIAO J, SU X, WANG M, et al. The E3 ubiquitin ligase CHIP protects against sepsis-induced myocardial dysfunction by inhibiting NF-κB-mediated inflammation via promoting ubiquitination and degradation of karyopherin-α 2[J]. Transl Res, 2023,255:50-65.
(責任编辑:编辑唐慧)
收稿日期:中文收稿日期2023-02-07
基金项目:国家自然科学基金项目(31971187),上海市科委基础研究领域项目(20JC1411200)
作者简介:李贝(1998—),女,硕士研究生,专业方向为泛素化机理研究。
*通信作者:赵博(1980—),男,研究员,博士生导师,从事泛素化机理以及肿瘤免疫疗法研究,e-mail:bozhao@sjtu.edu.cn。

