基于正交实验设计补阳还五汤水提液对高糖培养视网膜微血管内皮细胞活性影响
曹俊昌,石 颖,胡艳红,胡 俊,陈 胜
(福建中医药大学附属第二人民医院,福建 福州 350003)
随着城市化、人口老龄化以及生活方式的改变,全球糖尿病发病率逐年快速增长。根据2021 年国际糖尿病联盟统计,目前全球20~79 岁人群中有糖尿病患者5.37 亿,预计2045 年将增长至7.83 亿[1]。糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最常见、最严重的眼部并发症,是导致工作年龄人群失明的主要原因,其发病率及致盲率也逐年增长。一项综合了1980 年—2008 年全球35 项DR 患病相关研究的荟萃分析表明,全球范围内糖尿病患者中DR 的患病率达34.6%[2];另一项纳入全球59 项研究的荟萃分析结果表明,2020 年全世界成年DR患者人数估计为1.031 亿;2045 年,这一数字预计将增加至1.605 亿[3]。在我国糖尿病患者中DR 的患病率为22.4%,也已成为一个严重的公共卫生问题[4]。课题组前期研究发现补阳还五汤在治疗DR上有较好的临床增效作用,可改善患者视力和中医证候等[5],但其潜在的作用机制还有待于进一步研究。近年来,高糖培养的视网膜微血管内皮细胞研究逐渐成为探讨DR 机制的主要研究模型[6-8],在不同研究中,高糖造模的浓度存在差异,在高糖诱导下视网膜微血管内皮细胞可表现为细胞损伤和增殖活性降低。因此,本研究通过正交实验设计方法,以视网膜微血管内皮细胞活性为主要指标,筛选高糖损伤模型的最佳葡萄糖干预浓度、补阳还五汤水提液保护高糖诱导视网膜微血管内皮细胞损伤的最佳浓度及最佳作用时间,以期为进一步的机制研究提供基础依据。
1 实验材料
1.1 实验细胞 人视网膜微血管内皮细胞(HRCECs)购自深圳豪地华拓生物科技有限公司。
1.2 实验药物 补阳还五汤由黄芪125 g,当归6 g,赤芍5 g,地龙3 g,川芎3 g,焯山桃仁3 g,红花3 g组成,均购自福建中医药大学附属第二人民医院中药房。采用水提醇沉法制备补阳还五汤水提液(BYHWT):称取4 倍量的各味药,浸泡0.5 h,加水煎煮2 次。第1 次15 倍量水,煎煮1.5 h;第2 次加10 倍量水,煎煮1 h,分别用滤布滤过,合并滤液,补水,得质量浓度为0.1 g/mL 的补阳还五汤水提液,快速搅拌并缓慢加入乙醇使乙醇体积分数为60%,冷藏,静置14 h,滤过,挥发至无醇味后,用水补足减失的质量,备用。
1.3 实验试剂 高糖DMEM 培养基(批号:D5796)、DMEM/F-12 培养基(批号:D6570)均购自北京索莱宝科技有限公司;优级胎牛血清(FBS,美国Sigma公司,批号:F8318);PBS 溶液(美国Hyclone 公司,批号:ABA212278);0.25%胰蛋白酶(美国Gbico 公司,批号:25200-056);5%葡萄糖注射液(中国湖南科伦制药有限公司,批号:H43022082);CCK8 细胞计数试剂盒(全式金生物公司,批号:FP101-02)。
1.4 实验仪器 酶标仪(中国北京普朗新技术有限公司,型号:DNM-9602);细胞培养箱(日本Sanyo公司,型号:VMCMMCO-5ACMMO)。
2 实验方法
2.1 细胞培养 用含10%FBS 和1%双抗的高糖培养基(葡萄糖浓度为4.5 mg/mL),于37 ℃、5% CO2饱和湿度条件下培养。待细胞贴壁长满后,弃去培养液,用PBS 清洗3 次。加适量0.25%胰蛋白酶消化,按1∶3的比例传代,取对数生长期细胞用于实验。
2.2 不同葡萄糖浓度和BYHWT 浓度对细胞增殖的影响 将细胞以每孔1×104个接种于96 孔培养板,待细胞单层贴壁生长至50%左右,分别加入含4.5、5、10、15、20、25 mg/mL 葡萄糖浓度的培养基和含0、5、10、15.625、31.25、62.5、125、250 mg/mL BYHWT 浓度的高糖培养基各200 µL,在37 ℃、5% CO2饱和湿度条件下分别培养24、48、72 h,倒置显微镜下观察细胞形态后,每孔加入10 µL 的CCK8 溶液,继续培养4 h,于酶标仪450 nm 波长处测定OD 值。
2.3 正交实验优选HRCECs 细胞培养条件 以葡萄糖浓度(A)、BYHWT 浓度(B)及孵育时间(C)为3 个实验影响因素,每个因素设定3 个水平,根据“2.2”项下结果,选择相应的葡萄糖浓度和BYHWT浓度,按照L9(34)正交表进行实验,优选出BYHWT防护高糖损伤HRCECs 的最佳浓度及最佳作用时间。以HRCECs 细胞OD 值为评价指标,OD 值高者为佳。
将细胞以每孔5×104个接种于3 个24 孔培养板,3 个培养板对应3 个孵育时间(24、48、72 h),待细胞单层贴壁生长至50%左右时,按正交实验表加新配制相应浓度的GS、BYHWT 培养液。37 ℃、5%CO2饱和湿度条件下培养,次日换相同条件培养液1 次。培养至预定时间,每孔加入10 µL 的CCK8溶液,继续培养4 h 后,用酶标仪测定450 nm 处的OD 值。
2.4 BYHWT 干预时间筛选 根据正交实验优选出的葡萄糖浓度和BYHWT 浓度,将HRCECs 细胞分为正常组、模型组(优选葡萄糖浓度)与干预组(优选葡萄糖浓度+优选BYHWT 浓度),培养24、48、72 h,每日换液1 次,CCK8 法测定3 组细胞不同干预时间的OD 值。
2.5 统计学方法 采用SPSS 21.0 软件进行数据分析。计量资料符合正态分布以(±s)表示,组间比较采用单因素方差分析,两两比较采用Dunnett-t检验。P<0.05 为差异有统计学意义。
3 结 果
3.1 不同葡萄糖浓度干预HRCECs 细胞OD 值比较 与4.5 mg/mL 组比较,随着葡萄糖浓度增高,HRCECs 细胞OD 值在不同时间均大致为先升高后降低趋势。干预24 h 时,20、25 mg/mL 葡萄糖浓度下细胞OD 值明显降低;干预48、72 h 后,葡萄糖浓度>15 mg/mL 时,OD 值开始出现下降趋势,其中25 mg/mL葡萄糖浓度干预后OD 值均明显降低(P<0.05),提示该浓度可引起细胞损伤。见表1。
表1 不同糖浓度干预HRCECs 细胞OD 值比较(±s)
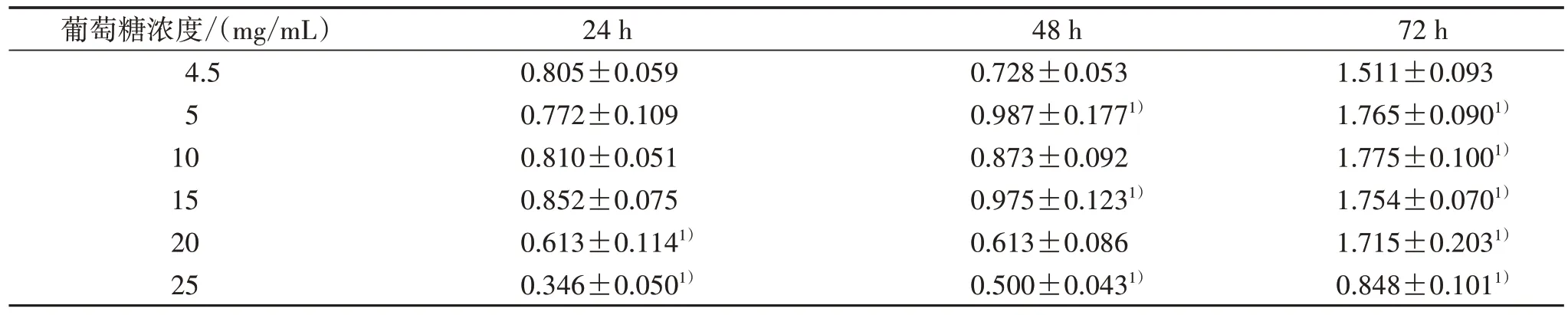
表1 不同糖浓度干预HRCECs 细胞OD 值比较(±s)
注:与4.5 mg/mL 组比较,1) P<0.05。
72 h 1.511±0.093 1.765±0.0901)1.775±0.1001)1.754±0.0701)1.715±0.2031)0.848±0.1011)葡萄糖浓度/(mg/mL)4.5 5 10 15 20 25 24 h 0.805±0.059 0.772±0.109 0.810±0.051 0.852±0.075 0.613±0.1141)0.346±0.0501)48 h 0.728±0.053 0.987±0.1771)0.873±0.092 0.975±0.1231)0.613±0.086 0.500±0.0431)
3.2 不同BYHWT 浓度干预HRCECs 细胞OD 值比较 与0 mg/mL组比较,5 mg/mL BYHWT干预24 h,10、15.625 mg/mL BYHWT干预48、72 h后OD值均明显提高(P<0.05),提示该浓度可促进增殖。见表2。
表2 不同BYHWT浓度干预HRCECs细胞OD值比较(±s)
注:与0 mg/mL 组比较,1) P<0.05。
72 h 1.700±0.121 1.798±0.0601)1.912±0.4191)1.976±0.1531)1.700±0.142 0.848±0.1121)0.763±0.0811)0.660±0.0041)BYHWT浓度/(mg/mL)05 10 15.625 31.25 62.5 125 250 24 h 0.850±0.024 1.178±0.0481)0.875±0.106 0.901±0.073 0.881±0.007 0.867±0.018 0.841±0.042 0.708±0.0051)48 h 1.035±0.055 1.406±0.1021)1.339±0.1431)1.281±0.1261)1.149±0.040 0.826±0.0661)0.712±0.0201)0.656±0.0021)
3.3 正交实验结果 由表1 可知,当葡萄糖浓度>15 mg/mL 时,葡萄糖培养促进HRCECs 细胞增殖的作用开始减弱,因此,选择筛选15、20、25 mg/mL 葡萄糖浓度作为正交实验条件。由表2 可知,当BYHWT 浓度在5~15.625 mg/mL 时,HRCECs 细胞OD值增强,提示该浓度对HRCECs 细胞具有保护作用。正交实验因素水平设计见表3,正交实验设计结果见表4,方差结果分析见表5。由表4 极差(R)可知,影响细胞增殖活性的主次因素是C>A>B,即孵育时间>葡萄糖浓度>BYHWT 浓度。经方差分析和显著性检验结果表明,孵育时间对细胞增殖活性有显著性影响,而葡萄糖浓度和BYHWT 浓度对细胞增殖活性无明显影响。因此,选择25 mg/mL葡萄糖浓度建立高糖损伤模型,选择5 mg/mL BYHWT 浓度干预细胞,观察细胞增殖活性,筛选干预时间。

表3 正交实验因素水平表

表4 正交实验设计结果
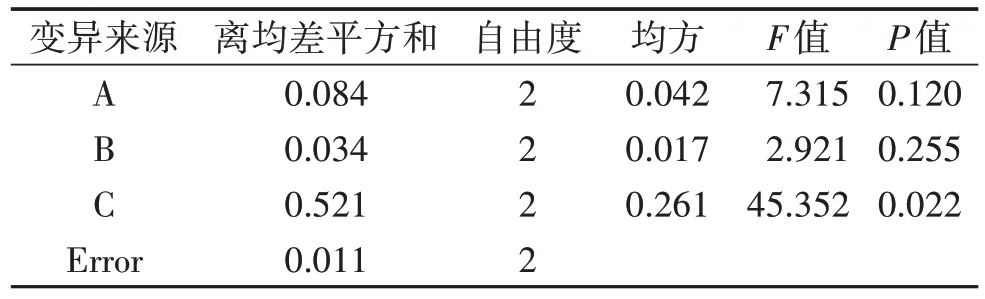
表5 方差结果分析
3.4 3组不同时间干预HRCECs细胞OD值比较 与正常组比较,模型组干预24、48、72 h 后OD 值明显降低(P<0.05);干预组干预24、48 h 后OD 值明显升高(P<0.05),干预72 h 后明显降低(P<0.05)。与模型组比较,干预组干预24、48、72 h 后OD 值明显升高(P<0.05)。见表6。
表6 3 组不同时间干预HRCECs 细胞OD 值比较(±s)

表6 3 组不同时间干预HRCECs 细胞OD 值比较(±s)
注:与正常组比较,1) P<0.05;与模型组比较,2) P<0.05。
组别正常组模型组干预组72 h 1.621±0.110 0.848±0.1011)1.320±0.1241)2)24 h 0.860±0.053 0.346±0.0501)0.991±0.1031)2)48 h 0.890±0.099 0.500±0.0431)1.007±0.0782)
4 讨 论
补阳还五汤出自《医林改错》,现临床上被应用于治疗糖尿病周围神经病变、糖尿病视网膜病变、糖尿病下肢血管病变、糖尿病心血管病变等糖尿病并发症[8-9]。视网膜微血管是糖尿病视网膜病变主要的病变部位,在高血糖情况下微血管内皮细胞会出现慢性炎症及渗透性损伤[10]。大多数HRCECs细胞高糖损伤的模型研究,正常培养HRCECs 细胞的培养基葡萄糖浓度为1.0~5.5 mg/mL[11-12],而本研究HRCECs细胞正常的培养条件要求4.5 mg/mL葡萄糖浓度的培养基,因此为了进一步观察高糖对该细胞的损伤作用,本研究探讨了5、10、15、20、25 mg/mL葡萄糖浓度对HRCECs 细胞活性的影响,结果发现HRCECs 细胞OD 值在不同时间均大致为先升高后降低趋势。干预24 h 时,20、25 mg/mL 葡萄糖浓度下细胞OD 值明显降低;干预48、72 h 后,葡萄糖浓度>15 mg/mL 时,OD 值开始出现下降趋势,当葡萄糖浓度为20 mg/mL 以上时,培养液对HRCECs细胞表现出损伤作用。其中25 mg/mL GS 培养液条件下孵育的HRCECs 细胞24~72 h OD 值均低于正常组,说明增大葡萄糖浓度可以成功制备高糖损伤HRCECs 模型。
在常规的细胞实验中,建立细胞模型多采用不同梯度浓度的药物干预细胞,根据细胞增殖活性筛选出造模浓度;治疗药物的浓度筛选,也多采用不同梯度浓度干预细胞进而获得最佳的药物干预浓度,造模浓度和药物干预浓度在组合条件下可能出现不同的规律[13-14]。本文筛选葡萄糖浓度时提示葡萄糖浓度>25 mg/mL 干预48 h 出现细胞损伤,而筛选BYHWT浓度时提示BYHWT浓度≤15.625 mg/mL便可以减少细胞损伤,且随着浓度降低,损伤减少。理论上用保护作用最强浓度的药物干预损伤最重的细胞,与保护作用最弱的药物干预损伤最轻的细胞,此两者效果应该一致,但通过正交实验发现:25 mg/mL 葡萄糖联合5 mg/mL BYHWT 的OD 值为0.653 3,而15 mg/mL 葡萄糖联合15.625 mg/mL BYHWT 的OD 值为1.1025,有明显的差异。因此,筛选最佳的损伤模型和保护性药物的最佳干预浓度以及干预时间,需要采用正交设计分析进行多次实验。
为了明确补阳还五汤水提液对高糖诱导HRCECs的保护作用,通过正交设计的验证实验,结果表明:在25 mg/mL 葡萄糖浓度下孵育24 h,即可导致HRCECs 细胞损伤,而5 mg/mL BYHWT 可保持HRCECs活性。25 mg/mL葡萄糖浓度培养的HRCECs细胞可以作为高糖损伤模型,5 mg/mL BYHWT 干预24 h 可用于探讨BYHWT 对高糖诱导HRCECs 细胞的保护作用。这为进一步探讨BYHWT 对高糖诱导HRCECs 细胞的保护机制研究提供了前期参考依据。

