钙钛矿量子点-分子印迹荧光探针制备及在恩诺沙星检测的应用

摘 要: 恩诺沙星是一种喹诺酮类抗生素,长期食用恩诺沙星超标的食品会对人体健康造成危害。采用热注入法合成钙钛矿量子点(PQDs),以恩诺沙星为模板分子,结合分子印迹技术,制备了基于钙钛矿量子点-分子印迹复合材料(Perovskite quantum dots-molecularly imprinted polymer, PQDs@MIP)荧光探针。运用透射电子显微镜、傅里叶变换红外光谱和氮气吸附-脱附实验对材料形貌、官能团和孔径特性进行考察。探究了孵育时间、恩诺沙星浓度以及类似物对两者荧光响应行为的影响。结果表明:恩诺沙星可显著猝灭PQDs@MIP在514 nm处的荧光,具有较快的猝灭动力学(15 min)和较高的饱和浓度(150 mg·L−1),且恩诺沙星浓度为0.05~40.0 mg·L−1时,猝灭程度和浓度之间呈现良好的线性关系,基于此构建了恩诺沙星荧光传感检测方法,该方法的检出限为0.02 mg·L−1。对三种水产品的添加回收率为93.6%~106.5%,相对标准偏差为1.9%~4.9%,证明其良好的实际应用潜力。
关键词: 恩诺沙星;荧光探针;钙钛矿量子点;分子印迹
中图法分类号: TS201.6 文献标识码: A 文章编号: 1000-2324(2024)06-0895-07
恩诺沙星(Enrofloxacin, ENR)是第三代喹诺酮抗生素[1],对革兰氏阴性和某些革兰氏阳性微生物具有良好的杀菌活性。然而,滥用和过度使用这些抗生素可能会使其通过食物链进入人体导致严重的健康问题[2,3],如腹泻、肝损伤、中枢神经系统损伤[4]以及导致细菌产生耐药性[5]。因此,开发一种食品中恩诺沙星简单、快速、高灵敏检测方法至关重要。
目前,毛细管电泳、表面增强拉曼光谱、高效液相色谱等方法被用于检测恩诺沙星[6-8]。这些方法通常需要大型仪器设备且对操作人员的技能要求相对较高等,不适合快速定量分析。荧光检测法具有高效、高灵敏、操作简单等优点,被广泛应用于有害物质的分析检测[9]。
钙钛矿量子点(PQDs)光致发光量子产率高、发射光谱光谱半峰宽窄,荧光波长可调[10,11],被视为理想的荧光信号物质[12]。然而,通常情况下,PQDs稳定性差,对温度、湿度、金属离子和溶剂等环境因素敏感,限制了它在实际检测中的应用[13]。分子印迹聚合物(MIP)具有高的热稳定性、化学稳定性和抗干扰能力[14],因此,用MIP包封量子点是构建高稳定性荧光探针的有效策略,同时MIP 能解决单独使用PQDs 时选择性不足的问题。
本研究拟以钙钛矿量子点为荧光信号物质,以分子印迹聚合物为识别单元,构建了集信号识别和传导为一体的钙钛矿量子点分子印迹(PQDs@MIP)荧光探针,测试了复合材料的荧光稳定性,研究了PQDs@MIP 对恩诺沙星的荧光响应行为,探究荧光猝灭的机理,实现对恩诺沙星的定量检测,并将该方法应用到了水产品中恩诺沙星的检测,为食品中恩诺沙星检测提供了新思路。
1 材料与方法
1.1 材料与试剂
恩诺沙星、环丙沙星、氧氟沙星、左氧氟沙星、诺氟沙星、氟罗沙星(98%,上海麦克林生化科技有限公司);碳酸铯、溴化铅、四甲氧基硅烷、油酸(分析纯,阿拉丁试剂上海有限公司);APTES(98%,阿拉丁试剂上海有限公司);十八烯(gt;90%,阿拉丁试剂上海有限公司);无水乙醇、二氯甲烷(分析纯,天津凯通化学试剂有限公司)。
1.2 实验设备
LUMINA LF-1701009 荧光分光光度计、NICOLET iS10 傅里叶变换红外光谱仪(美国Thermo 公司);TALOS F200S 透射电子显微镜(美国FEI 公司);ZNCL-TS 500 智能磁力搅拌器(巩义市予华仪器有限责任公司);TG16-WS 台式高速离心机(湖南湘仪实验室仪器开发有限公司);真空干燥箱(上海一恒科学仪器有限公司)。
1.3 实验方法
1.3.1 PQDs@MIP探针制备和表征
1.3.1.1 PQDs@MIP 探针合成 根据文献报道[15],采用热注入法合成PQDs 并进行包硅处理。以合成的PQDs 为荧光信号物质,以分子印迹聚合物为识别单元,结合分子印迹溶胶-凝胶过程,构建复合探针,具体方法如下:将0.1 mmol恩诺沙星溶解在10.0 mL 二氯甲烷中。继续加入10.0 mg PQDs,0.4 mmol APTES,25 ℃下搅拌30 min进行预聚合,接着加入1.6 mmol四甲氧基硅烷,在25 ℃下搅拌15 h,8 000 r/min 离心8 min收集得到聚合物。聚合物用无水乙醇洗涤5 次,60 ℃下进行真空干燥得到PQDs@MIP。按照上述步骤,不加模板分子恩诺沙星,得到非印迹聚合物PQDs@NIP。
1.3.1.2 PQDs@MIP 探针表征 运用TEM、FTIR和氮气吸附-脱附法表征纳米复合材料的形貌,官能团、比表面积及孔径。
1.3.2 荧光稳定性研究 将PQDs@MIP置于自然光下一周,每天测试荧光发射光谱,记录其在514 nm 处的荧光强度,通过材料在自然光条件下一周的荧光强度变化分析其稳定性。
1.3.3 PQDs@MIP 对恩诺沙星荧光响应行为研究
1.3.3.1 PQDs@MIP 对恩诺沙星动态和静态荧光响应实验 测试复合材料在加入5.0 mg·L−1恩诺沙星不同时间后的荧光光谱,计算F0/F-1(F0为PQDs@MIP 的荧光峰值,F 为PQDs@MIP 添加恩诺沙星后的荧光峰值)。以时间为横坐标,F0/F-1 为纵坐标绘制动态响应曲线。测试其达到饱和吸附的时间。测试PQDs@MIP在不同浓度恩诺沙星溶液中的荧光光谱,以恩诺沙星浓度为横坐标,F0/F-1为纵坐标绘制静态响应曲线。测试其对恩诺沙星的饱和浓度。
1.3.3.2 选择性实验 测试PQDs@MIP 和PQDs@NIP对恩诺沙星及类似物氧氟沙星、环丙沙星、左氧氟沙星、诺氟沙星、氟罗沙星(浓度均为20 mg·L−1)的荧光响应情况,验证PQDs@MIP对恩诺沙星的选择性。
1.3.3.3 荧光响应机理探讨 测试添加恩诺沙星前后PQDsMIP 的荧光寿命;判断荧光响应类型,使用紫外可见分光光度计对PQDs@MIP 及恩诺沙星的吸收峰进行表征。分析猝灭机制。
1.3.4 PQDs@MIP 对恩诺沙星传感方法建立取2.0 mg PQDs@MIP 放置于5.0 mL离心管中,分别向其中加入2.0 mL 不同浓度的恩诺沙星标准溶液。测试其荧光发射光谱,并计算F0/F-1。以恩诺沙星浓度为横坐标,F0/F-1 为纵坐标绘制标准曲线,并根据3 倍信噪比计算得出检出限。
荧光检测条件为:Ex=365 nm,Em=514 nm,狭缝宽度为5 nm,光电倍增管电压为550 V。
1.3.5 实际样品中恩诺沙星的检测 选取海虾、鲳鱼、鲈鱼三种样品,参考国家标准《GB31656.3-2021》对样品进行前处理并测试样品本底值。分别在50.0 μg·kg−1、250.0 μg·kg−1、500.0 μg·kg−1三个水平下进行添加回收实验,经提取和净化后,使用无水乙醇复溶,按照1.3.4 方法进行荧光检测。
2 结果与分析
2.1 PQDs@MIP表征
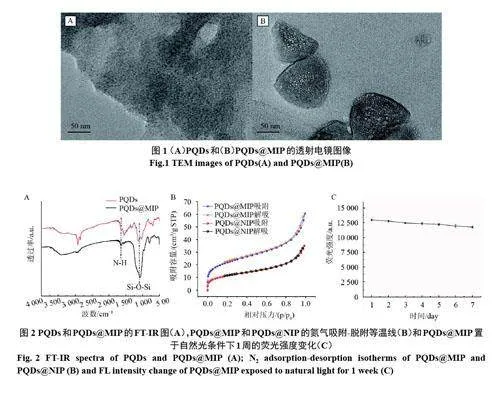
由图1(A)可知,PQDs 呈现出分布均匀、尺寸均匀的颗粒状态。由于在合成PQDs 过程中加入了APTES,经APTES 水解后的PQDs 聚集并嵌入到SiO2材料中。由图1(B)可知,溶胶凝胶过程为PQDs@MIP 表面包裹了一层印迹层,PQDs成功嵌入到分子印迹聚合物当中。
从图2(A)可以看出,复合材料有着许多与PQDs 相同的特征峰,证实了PQDs 的嵌入。Si-O-Si 的伸缩振动峰位于1 056 cm−1处,这意味着APTES 及TMOS成功水解包覆硅层,1 700 cm−1显示了N-H的拉伸振动,这主要来源于APTES。
氮气吸附-脱附法表征的结果如图2(B)所示,PQDs@MIP 和PQDs@NIP 显示出相似的吸附类型。PQDs@MIP的比表面积为77.5 m2·g,明显高于PQDs@NIP 的比表面积(21.3 m2·g)。这是因为在PQDs@MIP 合成过程中,模板分子恩诺沙星经过洗脱之后,在材料表面形成了生成孔穴。
2.2 荧光稳定性实验
结果如图2(C)所示,PQDs@MIP 的荧光强度仍保持初始荧光强度的90.7%。证明复合材料的荧光稳定性良好。这得益于在PQDs 合成的过程中使用APTES 作为封端剂,有效地钝化PQDs 表面缺陷,并通过APTES 水解对PQDs 表面包覆硅层,提高PQDs 的稳定性。进一步通过溶胶-凝胶法将PQDs 封装到聚合物中,借助其优秀的稳定性进一步实现了对PQDs 的保护作用。
2.3 PQDs@MIP 对恩诺沙星荧光响应行为研究
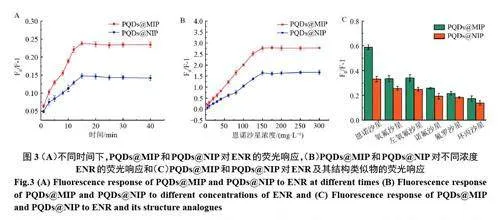
2.3.1 动态荧光响应和静态荧光响应 当恩诺沙星与PQDs@MIP 混合时,恩诺沙星进入聚合物的孔隙需要一定的时间来平衡。研究了PQDs@MIP达到饱和吸附所需要的时间。结果如图3(A)所示,在前15 min 内,荧光猝灭程度F0/F-1 的值迅速升高并于15 min 达到最大值并保持稳定,表明在15 min时该复合材料对恩诺沙星的吸附达到饱和,因此确定最佳孵育时间为15 min。
探究了PQDs@MIP和PQDs@NIP对恩诺沙星的饱和吸附能力。如图3(B)所示,随着恩诺沙星浓度的增加,荧光猝灭程度逐渐增大,到150 mg·L−1时,达到最大值并保持稳定。表明在150 mg·L−1 时大多数特异性位点与恩诺沙星结合,达到了吸附平衡。PQDs@MIP 对恩诺沙星的最大响应浓度为150 mg·L−1。
在实验达到吸附平衡时,PQDs@MIP 响应值均明显大于PQDs@NIP,并且MIP的吸附能力明显高于NIP,这一现象是因为在MIP制备过程中模板分子恩诺沙星经乙醇洗脱后,使得PQDs@MIP较PQDs@NIP有着更大比表面积和孔体积。
2.3.2 选择性实验 如图3(C)所示,恩诺沙星对PQDs@MIP 的猝灭程度F0/F-1 值为0.59 大于对PQDs@NIP 的0.33,并且结构类似物中对PQDs@MIP的猝灭较强的氧氟沙星和左氧氟沙星的猝灭程度分别为0.33 和0.34 均远小于0.59。这是因为在PQDs@MIP 的合成以及洗脱过程中,恩诺沙星作为模板分子在PQDs@MIP 的印迹层中留下了特定的印迹位点,其他结构类似物因与恩诺沙星的分子结构存在差异而不能进入印记位点,只能通过非特异性吸附产生较微弱的荧光响应。非印迹材料的制备过程中没有恩诺沙星的加入,而没有形成特定的孔穴结构,因此对恩诺沙星没有特异性识别的作用。
2.3.3 荧光响应机理分析 荧光的猝灭机理包括动态猝灭效应和静态猝灭效应[16]。由图4(A)所示,加入恩诺沙星后,PQDs@MIP位于514 nm荧光寿命明显降低,这证明恩诺沙星对PQDs@MIP猝灭行为是动态荧光猝灭。
考虑到本方法合成的PQDs@MIP表面有着许多氨基,能与恩诺沙星表面丰富的基团之间存在氢键相互作用,导致二者间的电子转移然后发生荧光猝灭。如图4(B)所示,恩诺沙星与PQDs@MIP的紫外吸收峰发生重叠。这满足电子转移的条件。因此推测电子转移是导致PQDs@MIP荧光猝灭的主要原因。
2.4 PQDs@MIP 荧光传感检测恩诺沙星方法建立
将PQDs@MIP 用于恩诺沙星的检测,如图5(A)所示恩诺沙星可以有效猝灭PQDs@MIP位于514 nm 处的荧光强度。如图5(B)所示,F0/F-1 和恩诺沙星浓度在0.05~40.0 mg·L−1 浓度范围有着良好的线性关系。PQDs@MIP 的线性方程为:y=0.022 4x+0.111 8(R2=0.9954)、PQDs@NIP 的线性方程为:y=0.011 3x+0.035 7(R2=0.991 9)。该方法的LOD 为0.02 mg·L−1。并基于此建立了恩诺沙星的检测方法。
2.5 实际样品中恩诺沙星的检测
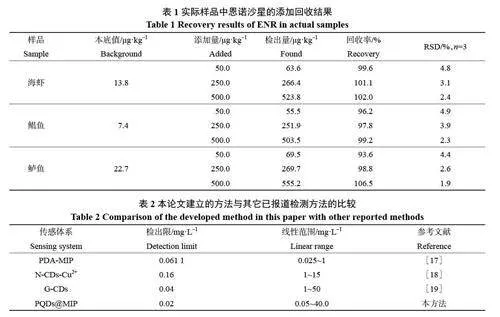
选取海虾、鲳鱼、鲈鱼三种实际样品,通过添加回收实验验证PQDs@MIP荧光探针用于检测水产中的恩诺沙星的可行性。结果如表1 所示,样品添加回收率在93.6%~106.5%之间,且相对标准偏差(RSD)在1.9%~4.9%之间。说明该方法具有较高的准确性。可用于水产品中恩诺沙星的检测。
3 讨论
恩诺沙星残留检测对于保障食品安全至关重要。荧光检测法因其高灵敏度、低检测限、简便操作和微量检测能力备受青睐,但荧光探针存在选择性不足的缺点,将PQDs 封装在分子印迹聚合物网络中,提高PQDs 了探针的稳定性和选择性。将本研究建立的方法与其他报道的方法进行比较(表2),本方法有着较低的检出限和较宽的线性范围。
4 结论
采用热注入法制备PQDs,结合分子印迹溶胶-凝胶技术,构建了集信号识别和传导为一体的PQDs@MIP荧光探针。对恩诺沙星的饱和吸附时间为15 min,饱和吸附量为150 mg·L−1。基于电子转移动态猝灭机制,实现了对恩诺沙星定量荧光检测。该检测方法线性范围为0.05~40.0 mg·L−1,检出限为0.02 mg·L−1。将方法应用在了实际样品中,对三种水产品的添加回收率为93.6%~106.5%,相对标准偏差在1.9%~4.9% 之间。为食品中恩诺沙星的快速检测提供了新方法,进一步助推了钙钛矿量子点在安全检测中的应用研究。
参考文献
[1] Zhang B, Lv L, Ma X, et al. Au@ZnNi-MOF labeled
electrochemical aptasensor for detection of enrofloxacin
based on AuPt@h-CeO2/MoS2 and DNAzyme-driven
DNA walker triple amplification signal strategy[J].
Biosensors and Bioelectronics, 2022, 210: 114296.
[2] Van DX, Dewulf J, Van LH, et al. Fluoroquinolone
antibiotics: an emerging class of environmental micropollutants[
J]. Science of The Total Environment,
2014, 500: 250-269.
[3] Zhang Z, Liu Q, Zhang M, et al. Simultaneous detection
of enrofloxacin and ciprofloxacin in milk using
a bias potentials controlling-based photoelectrochemical
aptasensor[J]. Journal of Hazardous Materials,
2021, 416: 125988.
[4] Aymard C, Kanso H, Serrano MJ, et al. Development
of a new dual electrochemical immunosensor for a
rapid and sensitive detection of enrofloxacin in meat
samples[J]. Food Chemistry, 2022, 370: 131016.
[5] Jiang D, Wei M, Du X, et al. Ultrasensitive nearinfrared
aptasensor for enrofloxacin detection based
on wavelength tunable AgBr nanocrystals electrochemiluminescence
emission triggered by O-terminated
Ti3C2 MXene[J]. Biosensors and Bioelectronics,
2022, 200: 113917.
[6] Xu X, Liu L, Jia Z, et al. Determination of
enrofloxacin and ciprofloxacin in foods of animal
origin by capillary electrophoresis with field amplified
sample stacking-sweeping technique[J]. Food Chemistry,
2015, 176: 219-225.
[7] Girmatsion M, Mahmud A, Abraha B, et al. Rapid
detection of antibiotic residues in animal products
using surface-enhanced Raman Spectroscopy: A
review[J]. Food Control, 2021, 126: 108019.
[8] Aufartová J, Brabcová I, Torres-Padrón ME, et al.
Determination of fluoroquinolones in fishes using
microwave-assisted extraction combined with ultrahigh
performance liquid chromatography and fluorescence
detection[J]. Journal of Food Composition and
analysis, 2017, 56: 140-146.
[9] Ansari S, Masoum S. Recent advances and future
trends on molecularly imprinted polymer-based
fluorescence sensors with luminescent carbon dots[J].
Talanta, 2021, 223: 121411.
[10] Nedelcu G, Protesescu L, Yakunin S, et al. Fast
anion-exchange in highly luminescent nanocrystals
of cesium lead halide perovskites (CsPbX3, X= Cl,
Br, I)[J]. Nano Letters, 2015, 15(8): 5635-5640.
[11] Li X, Cao F, Yu D, et al. All inorganic halide
perovskites nanosystem: synthesis, structural features,
optical properties and optoelectronic applications[J].
Small, 2017, 13(9): 1603996.
[12] Shellaiah M, Sun KW. Review on sensing applications
of perovskite nanomaterials[J]. Chemosensors,
2020, 8(3): 55.
[13] Wang H, Sui N, Bai X, et al. Emission recovery and
stability enhancement of inorganic perovskite
quantum dots[J]. Journal of Physical Chemistry
Letters, 2018, 9(15): 4166-4173.
[14] Ding X, Heiden PA. Recent developments in
molecularly imprinted nanoparticles by surface
imprinting techniques[J]. Macromolecular Materials
and Engineering, 2014, 299(3): 268-282.
[15] Sun C, Zhang Y, Ruan C, et al. Efficient and stable
white LEDs with silica ‐ coated inorganic perovskite
quantum dots[J]. Advanced Materials, 2016, 28(45):
10088-10094.
[16] Dong X, Qi H, Zhai Z, et al. Probing the
fluorescence quenching mechanism of N-doped
carbon quantum dots by inorganic ions[J].
Microchemical Journal, 2024, 197: 109854.
[17] Wang W, Wang R, Liao M, et al. Rapid detection of
enrofloxacin using a localized surface plasmon
resonance sensor based on polydopamine molecular
imprinted recognition polymer[J]. Journal of Food
Measurement and Characterization, 2021, 15: 3376-
3386.
[18] Guo X, Zhang L, Wang Z, et al. Fluorescent carbon
dots based sensing system for detection of enrofloxacin
in water solutions[J]. Spectrochimica Acta Part
A: Molecular and Biomolecular Spectroscopy, 2019,
219: 15-22.
[19] Xu J, Qi Q, Sun L, et al. Green fluorescent carbon
dots from chitosan as selective and sensitive \"off-on\"
probes for nitrite and \"on-off-on\" probes for
enrofloxacin detection[J]. Journal of Alloys and
Compounds, 2022, 908: 164519.

