分子印迹电化学发光传感检测预制菜中的恩诺沙星



摘 要: 本文基于石墨相氮化碳纳米片(g-C3N4 NSs)和分子印迹聚合物制备了一种分子印迹电化学发光(MIP-ECL)传感器用于特异性检测恩诺沙星(ENR)。采用出色电化学发光性能的g-C3N4 NSs作为发光体,以ENR为模板分子,邻苯二胺为功能单体,在修饰电极表面通过循环伏安法制备分子印迹聚合物膜。在最优条件下,该MIP-ECL传感器对ENR的线性响应范围为5×10−9~1×10−5 mol/L,最低检出限为9.6×10−10 mol/L。此外,传感器在实际样品中加标回收率为98.30%~106.20%。研究表明,该传感器具有成本低、灵敏度高、选择性好等优点,非常适合用于预制菜等食品中恩诺沙星的快速筛查。
关键词: 电化学发光;分子印迹聚合物;恩诺沙星;石墨相氮化碳纳米片;预制菜
中图法分类号: O657.1 文献标识码: A 文章编号: 1000-2324(2024)06-0961-07
预制菜是以一种或多种农产品为主要原料,运用标准化流水作业,经预加工(如分切、搅拌、腌制、滚揉、成型、调味等)或预烹调(如炒、炸、烤、煮、蒸等)制成,并进行预包装的成品或半成品菜肴[1]。在预制菜生产过程中,农兽药残留物、食源性致病菌、环境污染物是危害公众健康的重要因素。恩诺沙星(ENR)作为一种广谱氟喹诺酮类抗生素,因其良好的抗菌效果被广泛用于畜禽养殖领域[2],导致其在动物源性食品,尤其是禽肉预制菜中残留,对人类健康造成威胁[3-5]。许多国家和组织明确了ENR在不同动物产品中的最大残留限量标准。中国农业部和欧盟委员会规定,ENR 在动物组织中的最大残留限量为0.1 mg/kg[6]。为保障人类健康,对食品中ENR的含量进行快速筛查至关重要。目前已经报道了多种检测ENR 的方法,包括高效液相色谱法(HPLC)[7]、液相色谱串联质谱法(LCMS)[8]、毛细管电泳法(CE)[9]和酶联免疫吸附法(ELISA)[10]等,这些方法存在价格昂贵、耗费时间长、成本高等不足。因此,开发一种成本低、操作简单的ENR检测新方法至关重要。
近年来,电化学发光(ECL)因其具有优越的可控性、低背景噪声、高灵敏度等特点而备受关注[11,12]。然而,食品中复杂基质容易造成干扰而影响测定结果[13]。分子印迹聚合物(MIP)具有高选择性、稳定性、可重复使用性等优点[14],是一种理想的识别元件。因此,将分子印迹技术与ECL相结合有望实现ENR的高灵敏、准确检测。
本文以具有出色ECL性能的石墨相氮化碳纳米片(g-C3N4 NSs)作为ECL 信号探针。以ENR为模板分子,邻苯二胺(O-PD)为功能单体,在修饰电极表面电聚合制备MIP膜,该膜能够特异性识别ENR。基于此,研发了一种选择性好、灵敏度高的MIP-ECL 传感器,实现了预制菜中痕量ENR的快速检测。
1 实验部分
1.1 试剂与仪器
过硫酸钾(K2S2O8)购于上海沃凯生物技术有限公司;石墨相氮化碳(g-C3N4)购于江苏先丰纳米材料科技有限公司;恩诺沙星(ENR)和邻苯二胺均购于上海麦克林生化科技有限公司;磷酸盐缓冲液是由磷酸二氢钠和磷酸氢二钠配制而成。所有药品均为分析纯,溶液以超纯水配置。预制菜样品(无骨鸡柳、雪花鸡柳和小酥肉)购于泰安永辉超市。
电化学工作站(上海辰华仪器有限公司);MPI-E 型电化学发光分析仪(西安瑞迈分析仪器有限公司)。
1.2 MIP/g-C3N4 NSs/GCE的制备
将玻碳电极(GCE)用0.5 μm 和0.03 μm 的Al2O3进行抛光处理,然后用无水乙醇、去离子水分别超声5 min,晾干。随后,将8 μL g-C3N4 NSs溶液(参照文献[15]方法合成)滴涂到GCE 表面,晾干,得到g-C3N4 NSs/GCE 电极。将得到的电极置于一定浓度比例的ENR 和邻苯二胺的0.1 mol/L HAc-NaAc 缓冲溶液中(pH=5.2),CV法在0 ~ 0.8 V电压范围内,以50 mV/s 的扫描速率连续扫描若干圈。最后,将修饰电极浸入0.1 mol/L NaOH的乙醇和水(V/V=3∶1)溶液中,磁力搅拌一段时间除去模板分子,晾干,得到MIP/g-C3N4 NSs/GCE工作电极。
1.3 MIP-ECL传感检测方法
ECL 测试和电化学分析均采用传统的三电极体系。MIP/g-C3N4 NSs/GCE为工作电极,铂丝电极为辅助电极,Ag/AgCl 电极为参比电极。将洗脱后的MIP/g-C3N4 NSs/GCE 工作电极浸入到不同浓度的ENR的溶液中孵育14 min。然后,将洗脱后的MIP/g-C3N4 NSs/GCE和孵育后的MIP/g-C3N4 NSs/GCE 分别置于含有0.1 mol/L K2S2O8的PBS(pH=7.4)检测底液中,在电压为0~−1.2 V范围内,以100 mV/s 扫描速率、−600 V光电倍增压进行ECL 测试,记录相应的ECL 信号差值ΔECL(ΔECL=F0−F,F0为模板分子洗脱后传感器的ECL信号,F为目标物孵育后的ECL信号)。
1.4 实际样品检测
为了评价MIP-ECL 传感器检测实际样品的性能,采用标准加入法测定无骨鸡柳样品中ENR 的回收率。样品制备流程:准确称取无骨鸡柳样品5 g,加入不同浓度的ENR 标准溶液,孵育24 h 后,加20 mL酸化乙腈溶液,无水硫酸钠10 g,高速均质,离心,将得到的上清液置于分液漏斗中。用酸化乙腈溶液20 mL溶解下层沉淀,重复提取2 次,合并得到的上清液。随后,在分液漏斗加入60 mL 乙腈饱和正己烷溶液,振荡、静置,待分层后取乙腈层旋蒸至干。最后,用5 mL PBS 复溶,0.22 μm 微孔滤膜过滤后测定ENR含量。
雪花鸡柳和小酥肉样品的制备流程除不添加ENR标准溶液孵育外,其余步骤同上。
2 结果与讨论
2.1 MIP-ECL传感器表征
采用电化学阻抗谱(EIS)法和ECL 法表征不同修饰电极。如图1A所示,EIS图中的半圆对应的是电子传递电阻(Rct),半圆半径与Rct 呈正相关。与裸GCE(曲线a)相比,g-C3N4 NSs/GCE的Rct 略有增加(曲线b)。当电聚合MIP 膜后,Rct 显著增加,这是由于MIP 膜不导电(曲线c)。模板分子洗脱后,形成了许多印迹空腔,促进电子转移,导致Rct 下降(曲线d)。重新孵育模板分子后(曲线e),印迹空腔被堵住,阻碍电子转移,Rct再次增加。
研究了不同修饰电极的ECL响应信号,结果如图1B 所示,裸GCE 没有明显的ECL 信号(曲线a)。电极被g-C3N4 NSs修饰后,其ECL信号明显高于裸GCE(曲线b)。当MIP膜电聚合到电极表面后,传感器的ECL信号明显降低(曲线c),这可能是因为印迹膜阻碍了电子转移。洗脱去除模板分子后,ECL信号明显恢复(曲线d),这是因为洗脱后产生印迹空腔,促进电子转移。重新孵育模板分子后,ECL 信号显著降低(曲线e)。以上结果证明MIP-ECL传感器成功构建。
2.2 MIP-ECL传感器构建条件的优化
为了改善MIP-ECL 传感器的检测性能,获得稳定、准确的ECL响应,我们对不同的实验条件进行了优化。
2.2.1 检测底液的pH 值优化 从图2A 可以看出,随着pH值的增加,ECL响应信号先升高后降低。当pH值为7.4 时,ECL信号达到最大。这可能是由于在较低pH 值下,质子在负电位易被还原,阻碍对g-C3N4 NSs 的还原。而在较高的pH值下,溶液中的OH−会与共反应剂的还原物质SO*− 4 发生反应,消耗SO*− 4 ,导致ECL 响应信号降低。因此,最佳pH值为7.4。
2.2.2 功能单体与模板分子的比例优化 从图2B可以看出,ECL 猝灭值随着模板分子与功能单体比例的改变而变化,当比例为1∶5 时,ECL猝灭值达到最大。这可能是由于功能单体浓度过高时,形成的聚合物交联程度大,从而造成对模板分子的识别能力降低。功能单体浓度过低时,产生的印迹识别位点少,也会造成对模板分子的识别能力降低。因此,选择1∶5 为最佳功能单体与模板分子的比例。
2.2.3 聚合圈数优化 从图2C 可以看出,ECL猝灭值在扫描5 圈时最大。随着扫描圈数的增多,ECL 猝灭值逐渐减小。这可能因为扫描周期变长,导致电聚合形成的印迹膜较厚,会阻碍电子转移。因此,电聚合的最佳聚合圈数为5 圈。
2.2.4 模板分子的洗脱时间优化 洗脱时间是形成印迹空腔的重要条件。如图2D所示,随着洗脱时间的增加,ECL信号逐渐增强。洗脱16 min后,ECL信号基本保持不变,说明模板分子完全被去除。因此,模板分子的最佳洗脱时间为16 min。
2.2.5 孵育时间优化 孵育时间也是影响传感器性能的关键因素。如图2E 所示,随着孵育时间的增加,ECL信号呈现逐渐降低的趋势,当孵育时间达到14 min后,ECL信号基本保持不变。因此,确定最佳孵育时间为14 min。
2.3 MIP-ECL传感检测方法的建立
如图3A所示,随着ENR浓度的增加ECL信号逐渐减小。在最优条件下,ECL 信号差值与ENR 浓度(5×10−9~1×10−5 mol/L)之间具有良好的线性关系(图3B)。线性回归方程为ΔECL=2 089 lg CENR+19 552,相关系数R2 为0.994 8。经计算该传感方法的最低检出限(LOD)为9.6×10−10 mol/L(S/N=3)。表1 是本方法与其他检测ENR 方法的比较。由此可知,与其他方法相比,本方法具有较宽的线性范围和较低的检出限。
2.4 MIP-ECL 传感器的选择性、重现性和稳定性
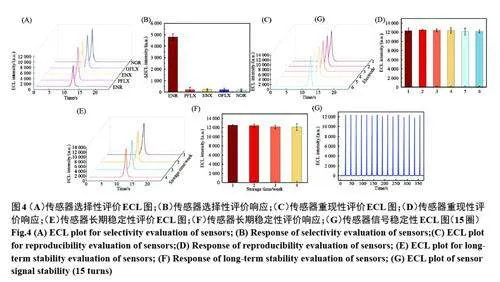
为了评价MIP-ECL 传感器的选择性,我们选择结构类似物氧氟沙星(OFLX)、诺氟沙星(NOR)、培氟沙星(PFLX)和依诺沙星(ENX)进行ECL 测定。如图4A、4B 所示,该传感器对ENR 有明显的猝灭,但对其他结构类物没有明显的响应,证明传感器对ENR 具有良好的选择性。
此外,我们还对MIP-ECL 传感器的重现性和稳定性进行了评价。如图4C、4D所示,测定了相同条件下6 根MIP/g-C3N4 NSs/GCE 的ECL响应,ECL 强度的相对标准偏差(RSD)低于1.2%,证明该传感器重现性良好。由图4E、4F可知,同一根MIP/g-C3N4 NSs/GCE 4°C下保存四周后,ECL响应依然保持原始ECL响应的96%,证明该传感器具有优异的稳定性。图4G 可以看出,MIP/g-C3N4 NSs/GCE 连续扫描续15 个循环的ECL 强度变化不明显(RSD 为1.5%),说明该传感器具有良好的稳定性。
2.5 实际样品检测
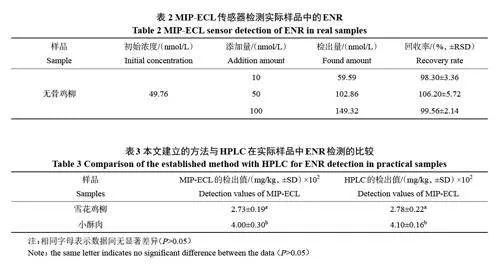
为了考察该传感器的实用性和可行性,将该方法用于无骨鸡柳中ENR的测定。如表2 所示,加标回收率为98.30%~106.20%。
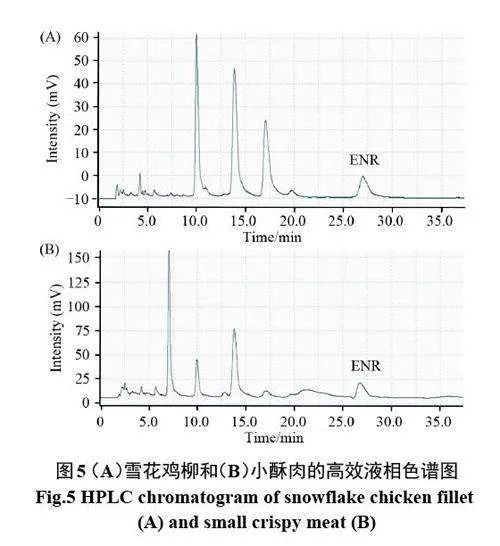
此外,将该方法用于雪花鸡柳和小酥肉中ENR含量的测定,同时采用高效液相色谱法验证分析结果的准确性。如表3 所示,雪花鸡柳和小酥肉中均检测出ENR。虽然残留量小,但是其对人类健康和环境的危害是不可忽视的。因此,需要加强对抗生素的监管。通过计算可知两种方法的检测结果无显著差异,说明MIP-ECL传感器对预制菜中ENR的检测具有较好的准确性。
3 结论
本文基于g-C3N4 NSs优良发光性能和分子印迹聚合物的特异性识别研发了一种MIP-ECL 传感器,其中,g-C3N4 NSs 作为发光材料,分子印迹聚合物作为识别原件,检出限为9.6×10−10 mol/L,添加回收率在98.30%~106.20%之间。该传感器具有良好的选择性、稳定性,较高的灵敏度和实际应用性。该研究为食品或预制菜中ENR的快速筛查提供了新思路。
参考文献
[1] 赵超凡,陈树俊,李文兵,等. 预制菜产业发展问题分
析[J]. 现代食品科技,2023,39(02):104-109.
[2] Zhu X, Tang J, Ouyang X, et al. Hollow NiCo@C
nanozyme-embedded paper-based colorimetric
aptasensor for highly sensitive antibiotic detection
on a smartphone platform[J]. Analytical Chemistry,
2022, 94(48):16768-16777.
[3] 尹青春,陈小妹,陈春泉,等.UPLC-MS/MS法测定虾
中恩诺沙星含量的不确定度评估[J]. 广东化
工.2023,50(04):203-206.
[4] Shen G, Ma Y, Zhang H, et al. Novel fluorescence
strategy based on G-quadruplex structure-switching
aptamer for enrofloxacin detection in food and
environmental samples[J]. Food Chemistry, 2024,
441:138393.
[5] 陈苏蒙,薛 毅,赵程祥,等. 恩诺沙星和环丙沙星在
肉鸡体内残留与代谢研究进展[J]. 中国兽药杂志,
2022,56(03):72-79.
[6] Huang X, Aguilar ZP, Li H, et al. Fluorescent Ru
(phen)3
2+-doped silica nanoparticles-based ICTS
sensor for quantitative detection of enrofloxacin
residues in chicken meat[J]. Analytical Chemistry,
2013, 85(10):5120-5128.
[7] Cinquina AL, Roberti P, Giannetti L, et al.
Determination of enrofloxacin and its metabolite
ciprofloxacin in goat milk by high-performance
liquid chromatography with diode-array detection:
Optimization and validation[J]. Journal of
Chromatography A, 2003, 987(1-2):221-226.
[8] Blasco C, Picó Y, Torres CM. Progress in analysis of
residual antibacterials in food[J]. TrAC Trends in
Analytical Chemistry, 2007, 26(9):895-913.
[9] Xu X, Liu L, Jia Z, et al. Determination of
enrofloxacin and ciprofloxacin in foods of animal
origin by capillary electrophoresis with field
amplified sample stacking-sweeping technique[J].
Food Chemistry, 2015, 176:219-225.
[10] 李 坚. 基于金纳米颗粒信号放大ELISA 检测食品
中恩诺沙星[D]. 河北:河北农业大学,2022.
[11] Xiao S, Yang YT, Chen YF, et al. Polymerized
carbon dots with high electrochemiluminescence
efficiency and long wavelength ECL emission for
ultrasensitive detection of MicroRNA-222[J].
Biosensors and Bioelectronics, 2024, 254:116193.
[12] Liu H, Jiang F, Dong J, et al. Highly efficient
electrochemiluminescence based on Lu@Ov-ZMO as
an ECL emitter for ultrasensitive detection of
CA242[J]. Microchemical Journal, 2024, 200:110482.
[13] Fang Y, Li Y, Zang X, et al. Gold-copper-doped
lanthanide luminescent metal-organic backbone
induced self-enhanced molecularly imprinted ECL
sensors for ultra-sensitive detection of chlorpyrifos[J].
Food Chemistry, 2024, 443:138533.
[14] Zhong Z, Tang Y, Chen Y, et al. Molecularly
imprinted poly(o-phenylenediamine) coated ZIF-5-
Ru(bpy)3
2+ composite for the sensitive and selective
ECL detection of tetracycline[J]. Microchemical
Journal, 2023, 195:109494.
[15] Liu Y, Wang Q, Lei J, et al. Anodic
electrochemiluminescence of graphitic-phase C3N4
nanosheets for sensitive biosensing[J]. Talanta, 2014,
122:130-134.
[16] Yang F, Yang B, Gu X, et al. Detection of
enrofloxacin residues in dairy products based on their
fluorescence quenching effect on AgInS2 QDs[J].
Spectrochimica Acta Part A: Molecular and
Biomolecular Spectroscopy, 2023, 301:122985.
[17] Esouza MJ, Bittencourt CF, Morsch LM. LC
determination of enrofloxacin[J]. Journal of
Pharmaceutical and Biomedical Analysis, 2002, 28
(6):1195-1199.
[18] Hernández M, Aguilar C, Borrull F, et al.
Determination of ciprofloxacin, enrofloxacin and
flumequine in pig plasma samples by capillary
isotachophoresis-capillary zone electrophoresis[J].
Journal of Chromatography B, 2002, 772(1):163-172.
[19] Lu S, Wang S, Wu P, et al. A composite prepared
from covalent organic framework and gold
nanoparticles for the electrochemical determination
of enrofloxacin[J]. Advanced Powder Technology,
2021, 32(6):2106-2115.

