红蓝光配比对黄瓜幼苗光合特性的影响



摘要:以‘津优365’黄瓜品种为试材,设置白光(W)、单色红光(R)、单色蓝光(B)以及不同比例的红蓝复合光(9R1B、7R3B、5R5B、3R7B、1R9B)8 个光质处理,研究了红蓝光对黄瓜幼苗稳态光合作用与动态光合作用的影响,以期为提高黄瓜幼苗在不同环境条件下的光合能力提供理论基础。结果表明,与红光相比,蓝光在提高黄瓜幼苗最大光合能力(Pmax)方面发挥重要作用,其主要通过提高表观量子利用效率(AQE)、Rubisco 最大羧化效率(Vcmax)、最大电子传递速率(Jmax)、磷酸丙糖利用效率(TPU)与气孔导度(Gs)提高Pmax。在红蓝复合光处理下,AQE、Vcmax、Jmax、TPU与Pmax随着蓝光比例的上升而提高,但1R9B处理与5R5B和3R7B处理之间无明显差异。此外,适宜比例的蓝光(30%-70%)可以提高净光合速率(A)的诱导速度,降低光合速率升高90%所需时间(T90%A)。1R9B 处理下T90%A 显著高于7R3B、5R5B 与3R7B处理,说明过量的蓝光会降低光合诱导速度。综上所述,适宜的蓝光比例不仅可以提高黄瓜幼苗的最大光合能力,还可以加快光合诱导速度,5R5B与3R7B处理下黄瓜幼苗最大光合能力与动态光合能力最佳。
关键词:黄瓜;红蓝光;稳态光合作用;动态光合作用
中图法分类号: S642.2 文献标识码: A 文章编号: 1000-2324(2024)06-0859-08
黄瓜(Cucumis sativus L.)具有产量高、营养丰富、经济效益高等优点[1],在世界范围内被广泛种植[2,3]。在生产过程中,为了提高黄瓜产量、品质与生长速度,经常采用工厂化育苗的方式培养壮苗[4]。在工厂化育苗中,使用环境条件高度可控的植物工厂进行育苗是工厂化育苗最高级的方式,且在植物工厂中,常使用全人工光源替代自然光提供植物生长所需的光能[5]。与自然光相比,人工光具有更高的可控性,可以根据幼苗生长的需求精准调控光强、光质、光周期等光环境特征,因此有必要深入研究光强、光质、光周期等重要光环境特征对植物幼苗的影响,为提高幼苗生长速度与品质提供理论基础[6]。作为光环境的重要组成部分,光质会显著影响植物的生长发育与光合特征[7,8]。其中,红蓝光是维持光合作用正常进行的重要光质,在育苗过程中一般以红蓝复合光作为光源[9,10]。
植物在某一特定环境条件下的光合作用被称为稳态光合,如植物在饱和光强下的光合速率被称为最大光合能力,目前已得到广泛研究[11,12]。有研究表明,红蓝光在维持光合作用正常进行,提高植物光合能力方面发挥更重要的作用[13,14]。与红光相比,蓝光在维持光合作用正常进行方面发挥更重要的作用[15,16]。单色红光往往会导致红光综合症,表现为光系统发育受阻、气孔发育不良且气孔导度降低,从而严重降低植物的光合速率[17,18]。在红光基础上添加少量蓝光可以有效缓解红光综合征。有研究发现在红光基础上添加蓝光可以促进番茄叶绿素合成与电子传递,从而提高其光合能力[19]。但也有研究发现,蓝光强度过高会对光合作用产生不利影响。如与红光相比,蓝光造成的番茄光系统Ⅱ处的光抑制现象更加严重,且在更低的光强下就会发生[16];在红蓝复合光处理下蓝光比例超过66%后会抑制生菜生长[20]。综上所述,适宜强度的蓝光可以提高植物的最大光合能力[21]。
受昼夜节律与云层遮挡影响,自然界中的光强往往处于波动状态,而光强的波动会影响植物的光合作用[22]。近些年,有研究发现影响植物生长的因素不仅是特定光强下的光合能力,还包括光合作用响应光强波动的能力,即动态光合作用[23]。有研究发现,波动光下限制拟南芥与烟草光合作用的因素主要是气孔导度,通过加快气孔开放与关闭可以显著提高拟南芥与烟草的动态光合能力[24]。提高植物的动态光合能力可以促进波动光条件下植物的生长,有研究发现提高油菜单位叶面积上的氮含量可以加速油菜的光诱导,并提高干物质积累量[25];对比不同品种水稻的气孔特征与光诱导特性后发现,气孔密度大且气孔面积较小的水稻气孔导度升高更快,从而加速光合诱导,以提高波动光下水稻的生长量[26]。关于光质对植物动态光合作用的影响,不同研究得出了不同的结论,有研究发现红蓝比对番茄稳态光合作用影响较大,但对动态光合作用影响较小[27]。而有研究则发现蓝光在提高黄瓜幼苗最大光合能力与气孔导度的同时,还会加快光合速率和气孔导度的诱导速度[28]。
本试验通过对比红光、蓝光以及不同比例的红蓝复合光对黄瓜幼苗稳态光合作用与动态光合作用的影响,将进一步探明红蓝光在调控黄瓜幼苗稳态光合作用与动态光合作用中发挥的作用,为提高动态光环境下黄瓜幼苗的光合能力提供新方法。
1 材料与方法
1.1 试验材料
以黄瓜(Cucumis sativus L.)品种‘津优365’为试材,采用穴盘育苗的方式获得供试黄瓜幼苗,育苗方法如下:将种子浸泡在去离子水中使其充分吸水,于28 ℃恒温培养箱中催芽至种子露白后,点播于72 孔穴盘中,穴盘中填充混合基质(草炭:蛭石:珍珠岩=3∶1∶1)。育苗在人工气候室中进行,温度为25±2 ℃,空气湿度为60%,光照强度为200 μmol·m−2·s−1,光质为白光,光周期为10 h·d−1。待幼苗子叶完全展平时,挑选长势一致的幼苗移栽到含15 L营养液的黑色不透明塑料盆中,每盆种植16棵黄瓜幼苗。水培时使用二分之一剂量的日本山崎(Yamazaki)营养液(NH4H2PO4浓度为0.5 mmol·L−1, Ca(NO3)2·4H2O浓度为2.0 mmol·L−1,KNO3浓度为3.2 mmol·L−1,MgSO4·7H2O浓度为1.0 mmol·L−1,并添加全剂量的微量元素),并用充氧泵为黄瓜根系供氧。营养液每3 d 更换一次。
1.2 试验设计
设置白光(W)、单色红光(R)、90%红光与10% 蓝光(9R1B)、70% 红光与30% 蓝光(7R3B)、50%红光与50%蓝光(5R5B)、30%红光与70% 蓝光(3R7B)、10% 红光与90% 蓝光(1R9B)以及单色蓝光(B)8 个处理,光质处理9 d后测定相关指标。红光波峰为660 nm,蓝光波峰为450 nm。环境条件为:温度25±3 ℃,空气湿度60%,光强100 μmol·m−2·s−1,光周期14 h·d−1。使用Heliospectra DYNA LED 灯(Heliospectra,Sweden)作为光源。
1.3 试验方法
(1)光响应曲线:使用LI-6800 光合仪测定光响应曲线,测定时气体流速为500 μmol·s−1,叶室内空气湿度为60%,二氧化碳浓度为400 μmol·mol−1,风扇转速为10 000 rpm,叶片温度为25 ℃,光源为红蓝复合光,红蓝比为8∶2。测定前,叶片在光强1 500 μmol·m−2·s−1下充分光适应。光强梯度为1 500、1 200、1 000、800、600、400、200、150、100、50、0 μmol·m−2·s−1;每个光强下等待3-5 min。根据直角双曲线模型拟合光响应曲线[29]。
(2)二氧化碳响应曲线:传统二氧化碳响应曲线(A-Ci)测定时,环境参数的设置与光响应曲线一致,在测定开始前同样需进行充分的光适应。二氧化碳浓度梯度为:400、300、200、100、50、400、600、800、1 000、1 200、1 500 μmol·mol−1,每个二氧化碳浓度下等待时间为3-5 min,测定一条传统二氧化碳响应曲线所需的时间为33-55 min。
除测定传统二氧化碳响应曲线外,还进行了快速二氧化碳响应曲线(RACiR)的测定[30,31]。测定时设定起始二氧化碳浓度为10 μmol·mol−1,最高二氧化碳浓度为1 500 μmol·mol−1,二氧化碳浓度变化速率为100 μmol·mol−1·min−1,计数间隔为2 s。测定一条快速二氧化碳响应曲线所需时间为16 min,与传统二氧化碳响应曲线相比节约了50%左右的时间。通过对比两种测定方法得出的结果,可以提高测量结果的可靠性。使用“msuRACiFit”拟合工具拟合二氧化碳响应曲线[32]。
(3)弱光-强光转换过程中的光合参数:环境参数与光响应曲线测定一致。使用一步光强变化法评价黄瓜幼苗的动态光合能力[26]。首先,在100 μmol·m−2·s−(1 生长光强)下测定3 min,之后光强升高至1 500 μmol·m−2·s−(1 饱和光强)测定20 min,数据记录间隔为10 s。可以得到以下参数:黄瓜幼苗在光强为100 μmol·m−2·s−1时的光合速率(A100)和气孔导度(Gs100)、在光强为1 500 μmol·m−2·s−1时的光合速率(A1500)和气孔导度(Gs1500)。并计算光合速率在特定时间的诱导状态(ISt)[26]:
1.4 数据处理
使用Microsoft Excel 2016 (MicrosoftCorporation,USA)计算平均值与标准差;使用SPSS 16.0(IBM,USA)对数据进行数据正态性检验与方差齐性检验。使用Duncan 法比较不同处理组之间的差异(Plt;0.05),并使用Origin 2021(OriginLab Corporation,USA)绘图。
2 结果与分析
2.1 红蓝光处理对光响应曲线相关拟合参数的影响
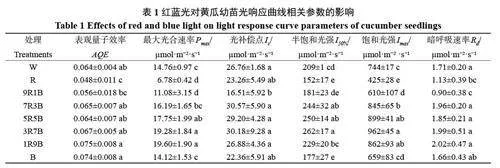
如表1 所示,R 与9R1B 处理下黄瓜幼苗表观量子效率(AQE)较低,与W处理相比分别降低了24.79% 与12.40%,而1R9B 与B 处理下AQE较高,与W处理相比分别提高了17.22%与16.78%。R 处理显著降低了Pmax,B 对Pmax 影响较小。红蓝复合光处理下,9R1B处理Pmax最低,而当蓝光比例超过50%后,Pmax显著升高,并在1R9B 处理下达到最高。光补偿点(Ic)仅在9R1B 处理下显著降低,其它处理下无显著差异。不同光质对半饱和光强(I50%)与饱和光强(Imax)的影响基本相同,与W处理相比,R与B处理降低了I50%与Imax,且R 处理下降幅更大,与W处理相比分别降低了27.25%与42.87%。红蓝复合光处理下,随着蓝光比例的上升,I50%与Imax呈上升趋势,在3R7B处理下达到最大。不同光质对暗呼吸速率(Rd)的影响较小,仅在R 与9R1B处理下显著降低。综上所述,红光会降低黄瓜幼苗的光合能力、光量子利用效率、半饱和光强、饱和光强与暗呼吸速率,而蓝光的作用则相反。
2.2 红蓝光处理对二氧化碳响应曲线相关拟合参数的影响
如图1 所示,与W处理相比,R 处理显著降低了Vcmax、Jmax与TPU,B处理的作用于R处理相似,但下降幅度要小于R处理。在红蓝复合光处理下,Vcmax、Jmax与TPU随着蓝光比例的上升而上升,在9R1B 处理下较低,但与W处理相比无显著差异;在1R9B 处理下达到最高,显著高于W处理。Vcmax、Jmax与TPU在R处理下达到最低,在1R9B处理下达到最高。综上所述,单色红光或单色蓝光都会降低Vcmax、Jmax与TPU,蓝光在提高最大光合能力方面发挥更重要的作用,在红蓝复合光处理下,Vcmax、Jmax与TPU着蓝光比例的上升而上升。
2.3 红蓝光处理对弱光-强光转换过程中黄瓜幼苗气体交换参数的影响
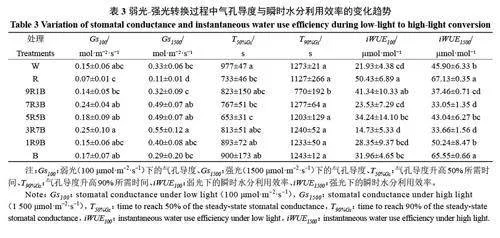
如表2所示,黄瓜幼苗在弱光(100 μmol·m−2·s−1)下的光合速率(A100)在R处理下较低,与W处理相比下降了20.95%,但差异并未达到显著水平。与W 处理相比,R 处理下A1500 显著下降了51.46%,而B处理下A1500与W处理无显著差异;在红蓝复合光处理下,A1500随着蓝光比例的上升而上升,7R3B、5R5B、3R7B 与1R9B 处理下A1500显著升高,并在3R7B处理下达到最高。计算光合速率在光强升高后第60 s 时的诱导状态(IS60s)和第300 s 时的诱导状态(IS300s)后发现,与W处理相比,IS60s与IS300s在R处理下显著降低,分别降低了31.04%和37.79%,而在B 处理下变化不明显。在红蓝复合光处理下,与W处理相比,9R1B处理下IS60s下降不明显,但IS300s显著下降,与W处理相比下降了23.59%,整体来看,7R3B 与3R7B 处理下IS60s 与IS600s 较高,1R9B 处理下较低,但都高于9R1B处理。R处理显著提高了光合速率升高50%需要的时间(T50%A),但对光合速率升高90%所需时间(T90%A)的提升较小。在红蓝复合光处理下,9R1B 与1R9B 处理下T50%A 与T90%A较高,但与W处理相比无显著差异。综上所述,红光会降低黄瓜幼苗的光合速率与光合诱导速度;而适当比例的蓝光可以提高强光下黄瓜幼苗的光合速率并加快光合诱导速度。
如表3 所示,弱光下的气孔导度(Gs100)在3R7B 处理下达到最高,与W处理相比提高了62.29%,显著高于W处理;在R处理下达到最低,与W处理相比下降了55.55%,显著低于W处理。在其它处理下,Gs100无显著差异。强光下的气孔导度(Gs1500)在R处理下显著降低,与W处理相比下降了68.49%,在3R7B处理下显著升高,与W处理相比升高了65.92%。在红蓝复合光下,除9R1B与1R9B处理下Gs1500较低外,其它处理下Gs1500无显著差异。红蓝复合光下,Gs1500在9R1B处理下达到最低,与B处理无差异,但显著高于R处理。计算光强升高后气孔导度升高50%(T50%Gs)与90%所需时间(T90%Gs)后发现,与W处理相比,R、7R3B与5R5B处理下T50%Gs显著降低,与W处理相比分别下降了24.91%、21.50%与33.11%,其它处理下T50%Gs与白光相比无显著差异。T90%Gs仅在9R1B处理下显著降低,与W处理相比下降了39.53%。弱光下的瞬时水分利用效率(iWUE100)在R处理与9R1B 处理下较高,与W处理相比分别提高了129.94%与88.48%,差异达到显著水平;在3R7B处理下较低,但与W处理的差异并未达到显著水平;在其他处理下iWUE100与W处理无显著差异。强光下的瞬时水分利用效率(iWUE1500)在R与B处理下显著高于W处理,与W处理相比分别提高了46.25%与42.82%,在9R1B、7R3B与3R7B处理下显著低于W处理,分别降低了18.38%、28.00%与26.67%。综上所述,红光会降低气孔导度,但会提高气孔导度的上升速度及瞬时水分利用效率。红蓝复合光处理下,蓝光比例上升在提高气孔导度的同时并未显著提高气孔导度的上升速度。
3 讨论
不同光质对黄瓜幼苗的稳态光合作用产生了显著影响。整体来看,单色红光处理下黄瓜幼苗稳态光合能力较差,主要通过降低表观量子效率(AQE)、最大光合速率(Pmax)、最大羧化速率(Vcmax)、最大电子传递速率(Jmax)以及磷酸丙糖利用效率(TPU)显著降低了黄瓜幼苗的最大光合能力(表1,图1)。AQE 是通过计算光响应曲线在弱光阶段的斜率得出的,AQE较低代表植物利用光能的能力较弱,而Pmax与Imax的降低则说明植物的光合潜能以及抵抗强光的能力降低,导致光合速率在低光强下达到最高,无法利用更多的光能,这一般是由于光合机构发育不良导致的[33]。Vcmax是在二氧化碳响应曲线初始阶段,即低二氧化碳浓度下限制光合能力提高的主要因素。此时叶绿体羧化位点处的二氧化碳浓度较低,限制光合能力上升的原因主要是卡尔文循环关键酶Rubisco 的羧化活性[34]。而随着二氧化碳浓度的升高,限制因素开始转变为羧化反应底物RuBP再生速率的限制,RuBP 的再生又要依靠光合电子传递过程中产生的ATP 与NADPH,所以最大电子传递速率Jmax在一定程度上代表RuBP 的再生速率,提高Jmax是提高光合速率的重要手段[35]。在二氧化碳响应曲线的最后一个阶段,即二氧化碳浓度过高后,限制光合速率上升的主要因素转变为光合产物的利用效率,即TPU。TPU高代表植物可以将光合产物快速运离羧化位点,防止光合产物过分积累抑制光合作用[32]。单色红光下AQE、Pmax、Vcmax、Jmax与TPU显著下降(表1,图1),说明单色红光通过降低光能利用率、Rubisco 活性、电子传递以及磷酸丙糖利用效率降低黄瓜幼苗的最大光合能力。而蓝光在促进光合机构发育,提高黄瓜最大光合能力方面发挥更重要的作用,这与蓝光在弱光下促进黄瓜叶片叶绿体与光系统发育从而提高黄瓜幼苗光合能力的结果相同[36]。同时Miao 等也发现与红光相比蓝光可以提高黄瓜光系统活性、气孔导度、Vcmax与Jmax从而提高最大光合能力[37]。在红蓝复合光下,随着蓝光比例的上升,AQE、Pmax、Imax、Vcmax、Jmax与TPU呈上升趋势,证明了蓝光在提高黄瓜幼苗最大光合能力方面发挥重要作用,且蓝光比例达到90%后并未降低黄瓜幼苗的最大光合能力,说明在红蓝复合光下,蓝光比例过高并不会对黄瓜幼苗的最大光合能力产生不利影响,与之前研究得出的红蓝复合光下提高蓝光比例可以提高黄瓜幼苗最大光合能力的结论相同[38]。综上所述,与红光相比蓝光在提高黄瓜幼苗最大光合能力方面发挥更大的作用,但红光完全缺失同样会降低最大光合能力,在蓝光基础上添加少量(10%)红光即可最大限度地提高黄瓜幼苗的最大光合能力,进一步证明了红蓝光可以协同提高植物的最大光合能力。
自然界中的光强度往往处于不断的变化中,因此植物在某一特定光强度下的光合能力很难与生长量对应,因此有必要研究光合作用对光强变化的响应[39,40]。本研究通过研究弱光-强光转换过程中光合参数的变化趋势发现:弱光下的光合速率与气孔导度变化较小,仅在单色红光下小幅度下降;在红蓝复合光下,蓝光比例的上升提高了强光下的光合速率与气孔导度,但蓝光比例过高(90%)会引起光合速率与气孔导度发生不明显的下降,红光则显著降低了强光下的光合速率与气孔导度,但瞬时水分利用效率最高(表2-3)。以上结果说明红光对最大光合能力的负面影响更大,但可以提高水分利用效率,而蓝光可以促进气孔开放从而提高植物的光合能力,但气孔导度的升高会导致水分利用效率的降低,这与之前的结论相似[38]。蓝光比例过高会影响气孔开放与光合作用,这与之前在大豆幼苗上得出的结论一致,主要是由于蓝光的光量子利用效率低于红光,从而影响光合电子传递过程导致的[41]。对比光合速率在不同时间的诱导状态以及光合速率和气孔导度到达特定诱导状态所需时间后发现:单色红光显著降低了弱光-强光转换过程中光合速率的诱导速度,而单色蓝光下光合诱导速度与白光相似;在红蓝复合光处理下,9R1B与1R9B降低了光合速率的诱导速度,其它复合光处理下诱导速度较快(表2)。这说明虽然蓝光可以加快光合速率的诱导速度,但蓝光比例太高会对光合诱导速度产生不利影响,证明相比于最大光合能力,黄瓜幼苗的动态光合能力更容易受到高比例蓝光的抑制。对比气孔导度的诱导速度后发现,在红蓝复合光下蓝光比例的上升并没有提高气孔导度的诱导速度;虽然9R1B处理可以提高气孔的诱导速度(表3),但这很可能是由于最大气孔导度降低导致的。这与Li 等得出的蓝光可以提高黑暗-强光转换过程中黄瓜幼苗气孔开放速度的结果不同[28],可能是由于测定方法不同,以及初始气孔导度不同导致的,说明植物的初始气孔导度很可能会影响之后的光诱导进程。
4 结论
单色红光通过降低AQE、Vcmax、Jmax、TPU与Gs降低黄瓜幼苗的最大光合能力,但对弱光下的光合速率影响较小,同时可以通过降低最大气孔导度加快弱光-强光转换过程中气孔导度的诱导速度。蓝光不仅可以提高黄瓜幼苗的最大光合能力,还会提高弱光-强光转换过程中光合速率的上升速度。蓝光比例过高对黄瓜幼苗最大光合能力的影响较小,但会降低弱光-强光转换过程中光合速率的诱导速度,蓝光比例在50%-70%之间可以有效提高黄瓜幼苗的最大光合能力与动态光合能力。
参考文献
[1] 王 新. 浅析北方蔬菜营养价值与栽培模式[J]. 农业
开发与装备,2022(04):177-179.
[2] 李艾潼,张晨阳,王思惠,等. 黄瓜国内外分级标准对
比及发展现状分析[J]. 食品安全导刊,2020(09):
24-26.
[3] 李怀智. 我国黄瓜栽培的现状及其发展趋势[J]. 蔬
菜,2003(08):3-4.
[4] 魏云鹏. 目前我国黄瓜栽培茬口及播种时间[J]. 吉
林蔬菜,2004(04):39.
[5] 杨 凡,蔡毓新,田昭然,等. 黄瓜双断根嫁接工厂化
育苗关键技术[J]. 中国瓜菜,2020,33(05):90-92.
[6] 李 光. 人工光源对黄瓜幼苗生长发育的影响[J]. 上
海蔬菜,2020(03):55-56.
[7] 何伟明,刘庞源,武占会,等. 基于不同温度的不同光
质处理对黄瓜幼苗生长的影响[J]. 北方园艺,2017
(09):30-33.
[8] Jeong HW, Lee HR, Kim HM, et al. Using light
quality for growth control of cucumber seedlings in
closed-type plant production system[J]. Plants, 2020,
9(5):639.
[9] 谭杰挥,刘厚诚. 植物工厂蔬菜育苗光调控技术研
究进展[J]. 农业工程技术,2022,42(01):24-29.
[10] 汪 颖,杨新琴,徐 沛,等. 不同红蓝光配比LED光源
对蔬菜育苗的影响[J]. 浙江农业科学,2020,61(04):
649-653.
[11] 叶子飘. 光合作用对光和CO2响应模型的研究进展
[J]. 植物生态学报,2010,34(06):727-740.
[12] 叶子飘,于 强. 光合作用对胞间和大气CO2响应曲
线的比较[J]. 生态学杂志,2009,28(11):2233-2238.
[13] Gonçalves VD, Fagundes-Klen MR, Trigueros DEG,
et al. Combination of Light Emitting Diodes (LEDs)
for photostimulation of carotenoids and chlorophylls
synthesis in Tetradesmus sp[J].Algal Research, 2019,
43:101649.
[14] Liu J, Van Iersel MW. Photosynthetic physiology of
blue, green, and red light: light intensity effects and
underlying mechanisms[J]. Frontiers in Plant
Science, 2021,12:619987.
[15] 张 欢,徐志刚,崔 瑾,等. 光质对番茄和莴苣幼苗生
长及叶绿体超微结构的影响[J]. 应用生态学报,
2010,21(04):959-965.
[16] 谢 鑫,王俊玲,段立肖,等. 光质对番茄叶片叶绿素
荧光动力学参数的影响[J]. 河北农业大学学报,
2013,36(06):48-51+88.
[17] Miao Y, Chen Q, Qu M, et al. Blue light alleviates 'red
light syndrome' by regulating chloroplast ultrastructure,
photosynthetic traits and nutrient accumulation in
cucumber plants[J]. Scientia Horticulturae, 2019, 257:
108680.
[18] Chen XL, Li YL, Wang LC, et al. Red and blue
wavelengths affect the morphology, energy use
efficiency and nutritional content of lettuce (Lactuca
sativa L.)[J].Scientific Reports, 2021(1),11:8374.
[19] 杨俊伟,鲍恩财,张珂嘉,等. 不同红蓝光比例对番茄
幼苗叶片结构及光合特性的影响[J]. 西北农业学
报,2018,27(05):716-726.
[20] Clavijo-Herrera J, Van Santen E, Gómez C. Growth,
water-use efficiency, stomatal conductance, and
nitrogen uptake of two lettuce cultivars grown under
different percentages of blue and red light[J].
Horticulturae, 2018,4(3):16-29.
[21] Hogewoning SW, Wientjes E, Douwstra P, et al.
Photosynthetic quantum yield dynamics: from
photosystems to leaves[J].Plant Cell, 2012,24(5):1921-
1935.
[22] Matsuda R, Ito H, Fujiwara K. Effects of artificially
reproduced fluctuations in sunlight spectral distribution
on the net photosynthetic rate of cucumber leaves[J].
Frontiers in Plant Science, 2021,12:675810.
[23] Qu M, Hamdani S, Li W, et al. Rapid stomatal response
to fluctuating light: an under-explored mechanism to
improve drought tolerance in rice[J]. Function Plant
Biology, 2016,43(8):727-738.
[24] Sakoda K, Yamori W, Groszmann M, et al. Stomatal,
mesophyll conductance, and biochemical limitations to
photosynthesis during induction[J]. Plant Physiology,
2021,185(1):146-160.
[25] Liu J, Zhang J, Estavillo GM, et al. Leaf N content
regulates the speed of photosynthetic induction under
fluctuating light among canola genotypes (Brassica
napus L.) [J]. Physiologia Plantarum, 2021, 172(4):
1844-1852.
[26] Xiong Z, Xiong D, Cai D, et al. Effect of stomatal
morphology on leaf photosynthetic induction under
fluctuating light across diploid and tetraploid rice[J].
Environmental and Experimental Botany, 2022, 194:
104757.
[27] Zhang Y, Kaiser E, Zhang Y, et al. Red/blue light
ratio strongly affects steady-state photosynthesis, but
hardly affects photosynthetic induction in tomato
(Solanum lycopersicum) [J]. Physiologia Plantarum,
2019,167(2):144-158.
[28] Li X, Zhao S, Lin A, et al. Effect of different ratios of
red and blue light on maximum stomatal conductance
and response rate of cucumber seedling leaves[J].
Agronomy, 2023,13(7):1941-1954.
[29] Lobo FDA, Barros MP, Dalmagro HJ, et al. Fitting net
photosynthetic light-response curves with Microsoft
Excel - a critical look at the models[J].Photosynthetica,
2013,51(3):445-456.
[30] Stinziano JR, Morgan PB, Lynch DJ, et al. The rapid
A-Ci response: photosynthesis in the phenomic era[J].
Plant Cell and Environment, 2017,40(8):1256-1262.
[31] Saathoff AJ, Welles J. Gas exchange measurements
in the unsteady state[J]. Plant Cell and Environment,
2021,44(11):3509-3523.
[32] Gregory LM, McClain AM, Kramer DM, et al. The
triose phosphate utilization limitation of photosynthetic
rate: Out of global models but important for leaf
models[J]. Plant Cell and Environment, 2021, 44(10):
3223-3226.
[33] 刘福霞,刘乃森. 不同光质对黄瓜幼苗生理生化特
性的影响[J]. 湖北农业科学,2016,55(07):1722-1725.
[34] Sun JL, Sui XL, Huang HY, et al. Low light stress
down-regulated rubisco gene expression and
photosynthetic capacity during cucumber (Cucumis
sativus L.) leaf development[J].Journal of Integrative
Agriculture, 2014,13(5):997-1007.
[35] Raines CA. Improving plant productivity by re-tuning
the regeneration of RuBP in the Calvin-Benson-
Bassham cycle[J]. New Phytologist, 2022, 236(2):
350-356.
[36] Wang XY, Xu XM, Cui J. The importance of blue light
for leaf area expansion, development of photosynthetic
apparatus, and chloroplast ultrastructure of Cucumis
sativus grown under weak light[J]. Photosynthetica,
2015,53(2):213-222.
[37] Miao YX, Wang XZ, Gao LH, et al. Blue light is
more essential than red light for maintaining the
activities of photosystem Ⅱ and Ⅰ and photosynthetic
electron transport capacity in cucumber leaves[J].
Journal of Integrative Agriculture, 2016,15(1):87-100.
[38] Hogewoning SW, Trouwborst G, Maljaars H, et al.
Blue light dose-responses of leaf photosynthesis,
morphology, and chemical composition of Cucumis
sativus grown under different combinations of red
and blue light[J]. Journal of Experimental Botany,
2010,61(11):3107-3117.
[39] Zhang Y, Kaiser E, Marcelis LFM, et al. Salt stress and
fluctuating light have separate effects on photosynthetic
acclimation, but interactively affect biomass[J]. Plant
Cell and Environment, 2020,43(9):2192-2206.
[40] Xu J, Guo Z, Jiang X, et al. Light regulation of
horticultural crop nutrient uptake and utilization[J].
Horticultural Plant Journal, 2021,7(5):367-379.
[41] Fang L, Ma Z, Wang Q, et al. Plant growth and
photosynthetic characteristics of soybean seedlings
under different led lighting quality conditions[J].Journal
of Plant Growth Regulation, 2020,40(2):668-678.

