胃食管反流病及抗反流药物靶基因与阻塞性睡眠呼吸暂停的关联孟德尔随机化研究*
严诏琦,徐义峰,李可可,刘良徛
(1.江西中医药大学研究生院,南昌 330006;2.江西中医药大学附属医院呼吸与危重症医学科,南昌 330006)
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是近年来受到广泛关注的多学科疾病,其特征为睡眠期间上呼吸道部分或完全塌陷的反复发作,导致间歇性缺氧和过度嗜睡[1],这对生活质量和预期寿命均产生严重的负面影响。目前,临床上对OSA多采取对症治疗,药物选择十分有限[2]。据估计,OSA影响全球近10亿成人,且年患病率还在持续增加[3],考虑到OSA的高患病率和危害,明确OSA的风险因素对促进OSA预防及治疗至关重要[4]。
胃食管反流病(gastroesophageal reflux disease,GERD)被定义为每周至少一次的烧心和(或)反流。GERD和OSA常合并出现,且两者均有共同的危险因素(similar pathogenetic features),例如年龄增长和肥胖等[5]。有文献表明GERD是OSA的一个危险因素,胃的反流内容物可能导致上气道炎症甚至阻塞促进OSA的发展[6]。此外,有系统评价指出GERD与OSA之间存在显著关联[7],相应地,有许多研究表明了治疗GERD的同时,也对OSA表现出治疗效果[8-10],这提示应用抗反流药物在OSA的治疗上或许是一个新的方向。
然而,尚不清楚GERD是否与OSA具有因果关系,抗GERD药物靶点对OSA的影响也需进一步评估。孟德尔随机化(mendelian randomization,MR)是一种分析方法,利用人类的遗传变异来研究可改变的疾病暴露的因果效应。由于单核苷酸多态性(single nucleotide polymorphism,SNP)的两个等位基因在孟德尔定律下是随机分离的,因此MR具有比其他研究方法更不容易受混杂因素影响的优点。因此,本研究进行了双样本孟德尔随机化(two-sample MR,2SMR)分析以解决以下问题:①GERD是否与OSA的风险增加有因果关系;②抗反流病的药物是否能作为OSA的候选治疗药物;③抗反流病的药物对OSA潜在的作用途径。
1 资料与方法
1.1资料 GERD的数据来自于欧洲人口研究中迄今公布的最新、最大的样本集,总样本量为602 604例,包括患病者129 080例和正常人群473 524例[11]。OSA的数据来自FinnGen集团G8项目,包括33 423例和307 648例对照。数据详情可在FinnGen网址下载(https://finngen.gitbook.io/documentation)。
1.2方法
1.2.1研究设计 用全基因组关联分析(genome wide association study,GWAS)的统计数据进行孟德尔随机化(MR)分析,以研究GERD与OSA的因果关系。MR分析使用SNP作为工具变量(instrumental variable,IV),并基于3个假设:①IV与暴露强烈相关(P<5×10-8);②IV与潜在混杂因素无关;③IV只通过暴露因素影响结局。
1.2.2遗传工具的构建 将GERD和OSA两种疾病的汇总数据限定于欧洲人群,以避免人口分层带来的潜在偏差。本研究进行了严格的SNPs过滤以此寻找代表GERD的遗传工具。首先,提取了显著的独立SNPs(P<5×10-8),及进行连锁不平衡(r2<0.001,kb>10 000)。其次,鉴于高血压、肥胖、吸烟是OSA的既定危险因素[12],通过查询PhenoscannerV2网站(http://www.phenoscanner.medschl.cam.ac.uk/),以识别并排除与既定危险因素相关的任何暴露SNP。随后,计算F统计量来评估遗传工具变量的强度[13]。最后,从OSA结果数据中提取暴露SNP,将暴露SNP与结果SNP协调,以排除回文SNP。经上述过滤步骤后留下的SNP最终用于MR分析。
1.2.3协调混杂因素 由于肥胖是公认的GERD和OSA的危险因素[14-15],因此从人体测量特征遗传调查(international consortium for anthropometric trait genetics,GIANT)联盟中选择了肥胖的汇总数据[16]作为进行多变量孟德尔随机化(multivariable mendelian randomization,MVMR)分析的工具变量,GIANT将肥胖表型分为3级:一级肥胖包括患者55 229例和健康对照104 894例;二级肥胖包括患者15 334例和健康对照97 858例;三级肥胖包括患者2 986例和健康对照67 010例,通过构建不同的肥胖分级模型以评估这一潜在危险因素在GERD对OSA因果关联中的影响。
1.2.4药物靶点及通路分析 受抗反流药物对OSA益处的启发,进一步对抗反流药靶点与OSA风险之间的因果关系进行了2SMR分析。首先,以“Gastroesophageal reflux disease”为关键词检索了DrugBank(https://go.drugbank.com)数据库中抗反流药物及其靶基因。根据所得的靶基因,从dbSNP(https://www.ncbi.nlm.nih.gov/dbvar)数据库中逐一寻找靶基因信息,摘录基因组上下文(包括注释的染色体位置和碱基位置信息区间段),使用R中‘TwoSampleMR'包来提取GERD中对应靶基因的碱基位置信息区间段,位置±100 kb,以此作为治疗GRED的抗反流药物靶基因的eQTL(expression quantitative trait loci,eQTL)(表达定量性状位点)。由于每种药物靶点基因中包含的SNP数量相对较小,因此选择更自由的阈值(P<5×10-5,等位基因频率>1%),并且不进行连锁不平衡。根据所得结果,提取了与OSA有显著关联的靶基因(P<0.05),最后通过DAVID数据库对所得靶点基因进行行京都基因(GO)和基因组百科全书(KEGG)途径富集分析,保留P<0.05的结果。
1.2.5统计分析 使用‘TwoSampleMR'包0.5.2版进行2SMR分析,以逆方差加权法(inverse-variance weighted,IVW)为主要的评估方法,并采用加权中位数(weighted median,WM)、加权模式(weighted method)和MR-Egger等多种方法来提高因果推理的可靠性。以P<0.05作为 2SMR 研究统计显著性的判别标准。采用MR-PRESSO和Leave-one-out法进行敏感度分析来检验是否存在对MR估计值影响过大的SNP;同时利用Cochran Q统计量的P值以探索结果异质性的大小;是否存在多效性由MR-Egger方法的截距项决定;对于不存在异质性的结果选择固定效应分析,反之选择随机效应。
2 结果
2.1总样本量 为602,604例,包括患病者129 080例和正常人群473 524例(详细汇总结果见表1)。
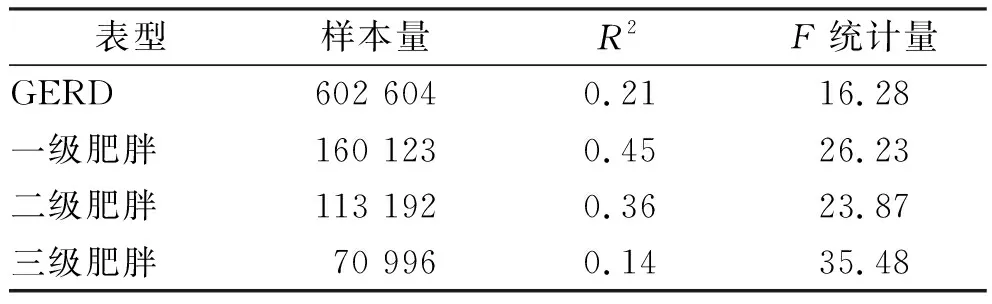
表1 全基因组关联研究总结Tab.1 Summary of genome-wide association studies
2.2GERD可促进OSA风险 本研究确定了GERD对增加OSA发病风险存在显着因果关系,IVW分析显示[P=5.29×10-22,(OR):1.43,95%置信区间(confidence interval,CI):1.33-1.54],其他分析方法如MR Egger、Weighted median、Weighted mode、Simple mode均有统计学意义,且与IVW分析结果具有相同方向和幅度(图1)。此外,GERD和OSA的MR-Egger截距回归表明本次研究所纳入的SNP不存在水平多效性,同时Cochran的Q统计量显示两者之间几乎没有异质性的证据(P<0.05)。MR-PRESSO为0.06>0.05,且进一步的Leave-one-out分析提示没有SNP对结果有过大的影响(所有行都在0的右侧),漏斗图显示两侧散点大致均匀。见图2,3。
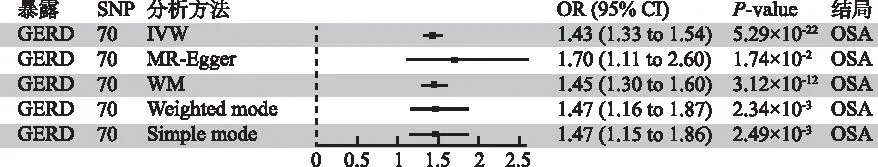
图1 GERD与OSA的MR分析结果森林图-基于5种分析方法Fig.1 Forest plot of MR analysis results for GERD and OSA-based on five analysis methods
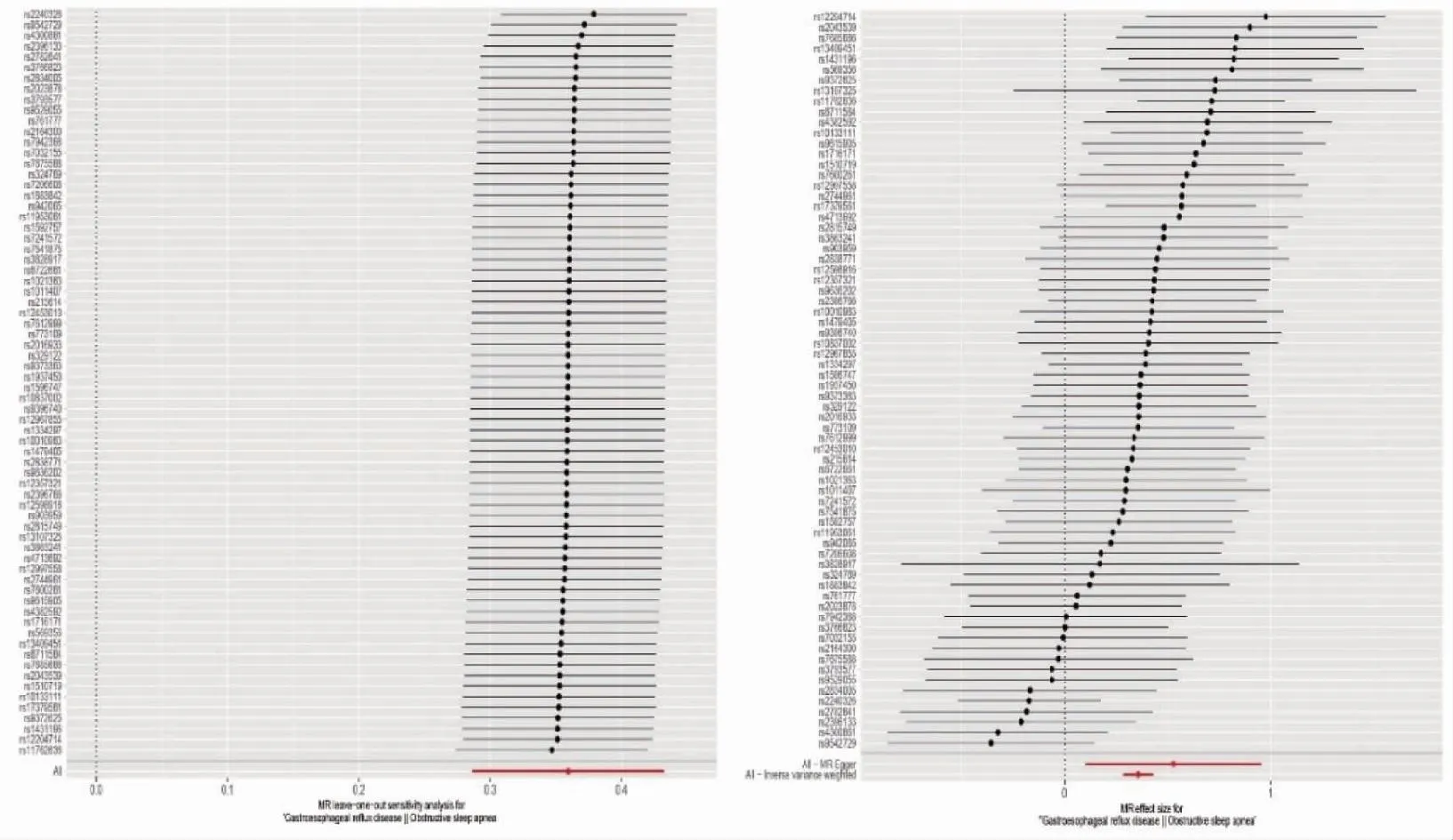
图2 GERD与OSA因果关联的Leave-one-out分析(左)和森林图(右)Fig.2 Leave-one-out analysis(left) and forest map(right) of the causal association between GERD and OSA
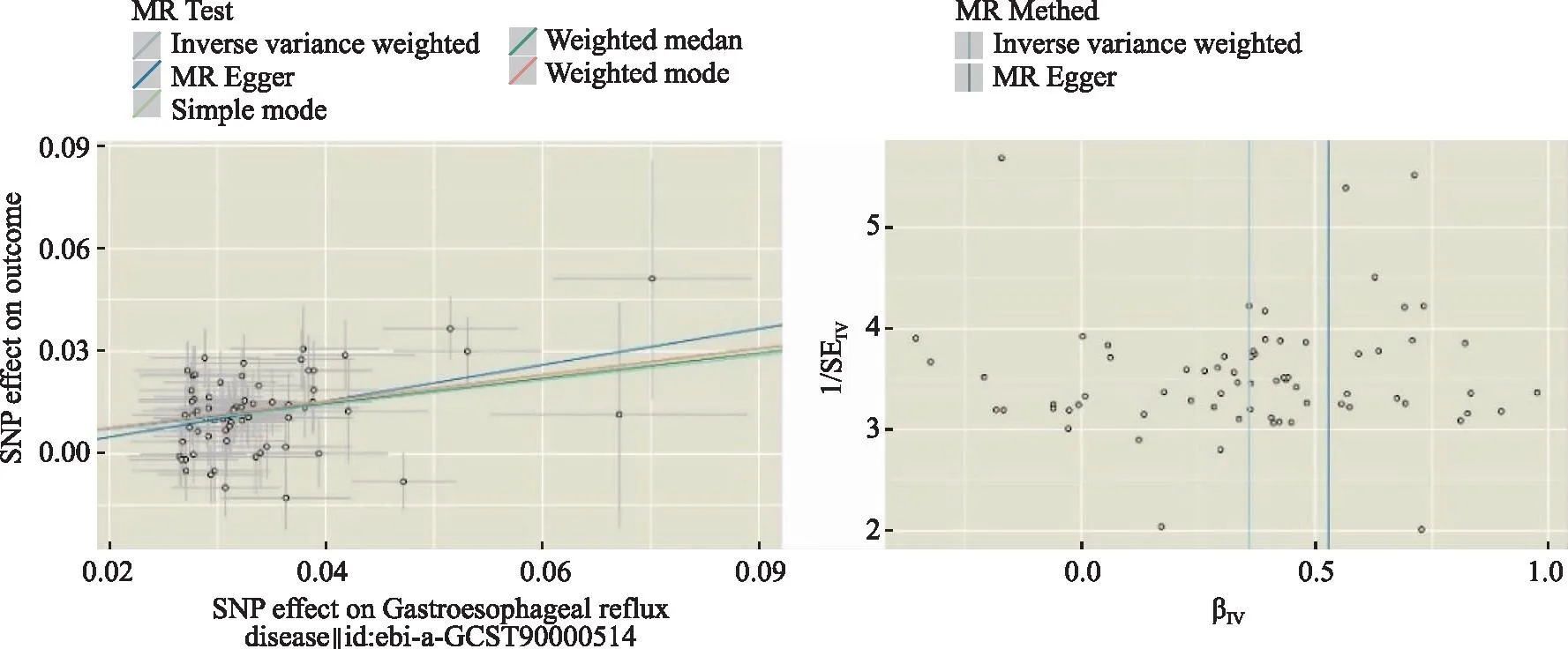
图3 GERD与OSA因果关联的散点图(左)和漏斗图(右)Fig.3 Scatter plot(left) and funnel plot(right) of the causal association between GERD and OSA
补充说明:F=[R2(N-K-1)/K(1-R2)],N表示暴露因子的样本量,k表示每种仪器中的SNP数量,R2表示工具解释的方差。1级肥胖,30≤BMI<35 kg·(m2)-1;2级肥胖,35≤BMI<40 kg·(m2)-1;3级肥胖,BMI≥40 kg·(m2)-1。
2.3MVMR模型 通过协调肥胖分级的工具变量,共进行了7次模型分析,在多次调整混杂暴露效应后,GERD与OSA的因果关联仍旧稳定(P<0.05),GERD对OSA的风险OR值在1.28~1.38间波动(图4)。
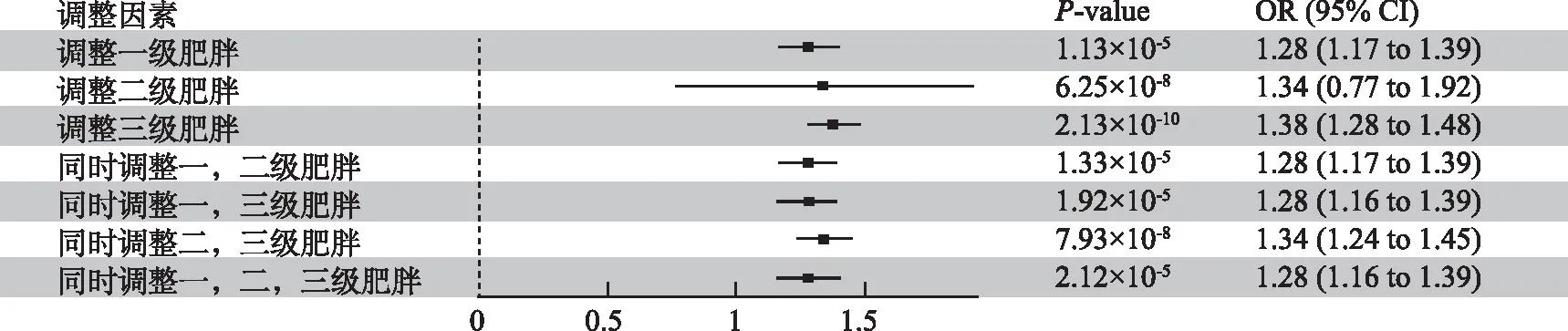
图4 多次协调肥胖因素后GERD对OSA因果影响的MR结果Fig.4 MR results of the causal effect of GERD on OSA after multiple coordinating of obesity factors
2.4抗反流药物和OSA 截至2023年2月,通过DrugBank数据库共获得了29种治疗GERD的抗反流药,涵盖了从相关药物中提取的69个靶基因、酶基因、载体蛋白和转运蛋白基因。使用与抗反流药物靶基因相关的SNP(P<5×10-5)作为工具变量,对治疗GERD药物靶基因与OSA风险之间的因果关系进行了2SMR分析。结果表明,BCHE[IVW,(OR):2.59,95%CI=(1.33,5.02)]、DRD2[IVW,(OR):1.50,95%CI=(1.20,1.89)]、GRM5[IVW,(OR):1.83,95%CI=(1.14,2.94)]、PTGER3[IVW,(OR):2.21,95%CI=(1.70,2.78)]与OSA风险增加有因果关系。见表2。涉及药物包括尼扎替丁,溴必利,ADX10059,米索前列醇。
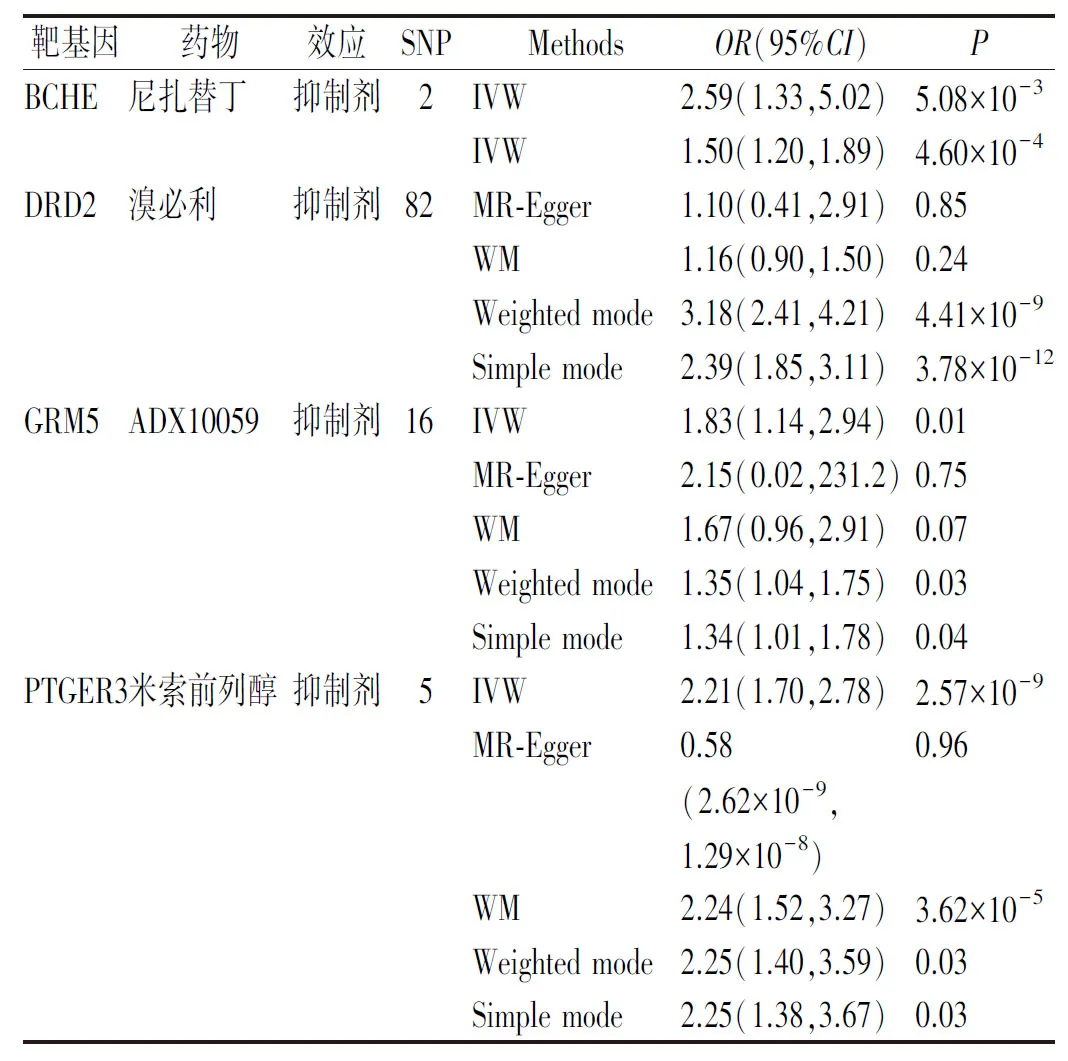
表2 抗反流药物靶基因和OSA的MR分析结果Tab.2 MR analysis results for target genes of anti-reflux drugs and OSA
2.5富集结果 基于GO和KEGG的富集分析;KEGG通路显示与Neuroactive ligand-receptor interaction和Gap junction等通路有关;GO分析结果显示,主要参与regulation of long-term neuronal synaptic plasticity、learning等生物过程(图5)。
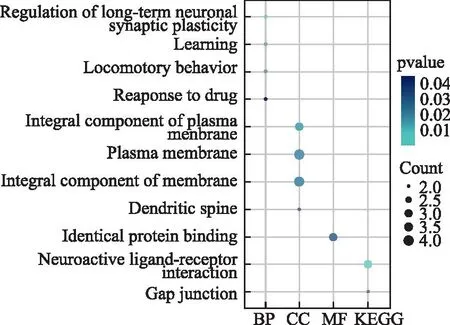
图5 靶点基因的GO分析图Fig.5 GO analysis of target genes
京都基因和基因组百科全书(KEGG)的气泡图富集和抗反流药物靶点基因的基因本体论(GO)分析。BCHE、DRD2、GRM5和PTGER3共享差异基因的KEGG富集和GO分析。颜色表示P值(从上到下颜色越浅,P值越小),气泡大小表示基因数量。丰富因子代表基因总数的比例。
3 讨论
食管与呼吸系统的关系非常密切,从胚胎发育开始到生理功能上两者都存在许多共通之处。解剖上食管和气管、支气管及肺都起源于前肠后部,共始于管腔-咽腔。生理上食管内食团的输送及其蠕动波也对肺功能造成影响,同样地,胸膜腔内的压力改变可传递到食管内[16-17]。目前主流学术观点认为GERD导致OSA有以下方面:患GERD者食管下端括约肌功能不全,导致食管未能迅速清除反流物,继而通过迷走神经反射性引起气管收缩,或者反流到咽部的胃酸等物质直接刺激咽部和气管,引起咽部炎症渗出、水肿,导致上呼吸道阻力增加,从而加重气道阻塞,最终发展为呼吸暂停和低通气[6,8]。KIM等[18]也曾报道经过胃镜证实胃反流性食管炎的严重程度与OSA严重程度的相关性;此外,非常频繁的反流事件可能通过中枢神经系而加重或导致呼吸暂停[19];最后,若食管内的酸性反流物长期缓慢微量吸入到气管导致气管壁层厚、狭窄、弹性下降而加重OSA。VELA等[20]也报道过GERD最主要症状中的反酸和烧心是OSA发生的独立危险因素。统觉醒、迷走神经刺激的慢性下食管炎症以及伴上气道动力学变化的喉部炎症导致气道收缩进而发展为呼吸暂停[21];有学者认为食团反流入食管引起了迷走神经反射,通过目前暂未明确的化学受体使声门关闭,从本研究通过2SMR分析,发现了GERD对OSA风险增加有因果关系,各项敏感性分析也加强了结果的可靠性,同时,还通过MVMR方法建立了7个模型进行分析对可能存在的混杂因素(肥胖)进行矫正,结果显示GERD对OSA的因果关系仍稳健。至OSA概念提出的这些时间里,其治疗的新药理论和实验研究引起了人们的广泛关注[22]。通过2SMR分析,本文确定了抗反流药物中的4个靶基因(BCHE、DRD2、GRM5、PTGER3),其高表达对OSA风险增加有因果效应,即抑制这4个靶基因的表达那在一定程度上有利于OSA的治疗。值得注意的是,基于DrugBank数据库中获得的药理作用,与4个靶点治疗相关的GERD药物,包括尼扎替丁、溴必利、ADX10059和米索前列醇是上述靶点的相应抑制剂,这表明确定的靶点可能为了解所选抗反流药物治疗OSA作用提供有用的遗传线索。其中ADX10059[23]一种选择性mGluR5负变构调节剂,是近年来治疗GERD的新兴药物,通过改善食管下括约肌短暂松弛(TLOSR)起到抑酸和抗反流的效果;溴必利[24]通过拮抗多巴胺能的中央D2受体从而减缓胃肠道蠕动,而米索前列醇[25]的靶点PTGER3和尼扎替丁[26-27]的靶点BCHE基因都能调节中枢和外周神经元中神经递质释放从而减少反流风险,这些证据都指向抗反流疗法是改善OSA的一个潜在方向[9]。如ING等[9]就曾使用“尼扎替丁”改善了OSA的夜间觉醒症状,有研究也提示非神经元胆碱能系统的抑制在缓解OSA的相关症状中起到一定作用[28]。KEGG富集分析获得了2条信号通路,分别是Neuroactive ligand-receptor interaction和Gap junction,其中Neuroactive ligand-receptor interaction通络与嗅觉转导有关,而有研究指出OSA和GERD患者确实有存在着嗅觉障碍现象[29-30],目前暂未发现另外1条通路与GERD和OSA的关联,但结合此次研究,为2条通路的未来研究奠定更广的研究方向。
本次2SMR结果揭示了GERD和OSA之间的因果关联,还通过MVMR在一定程度上消除了混杂因素给我们结果带来的影响。此外,用于治疗GERD药物的4个靶点被确定为与OSA有因果关系,KEGG富集分析获得了2个信号通络,这些均可能为新药的研发及相关作用机制提供启示。当然,本研究也存在若干局限性。在2SMR分析中,通过在所涉及的研究中筛选欧洲血统,虽然避免人口分层带来的潜在偏差,但我们的发现可能不适用于其他种族。此外,由于代理药物靶基因的SNP较少,缩小了阈值,且没有进行连锁不平衡是这些分析的局限性。这些因素可能会干扰结论的稳定性。

