骨化三醇通过B细胞受体/PI3K/AKT/NF-κB通路抑制大鼠高原肺水肿的发生*
戴重阳 林 雪 王雅轩 吕中奎 朱梦婷 邓章昌 蒲小燕
(青海大学医学院基础医学部组织学与胚胎学教研室,西宁 810016)
高原肺水肿(high altitude pulmonary edema)是由于急性暴露于高海拔缺氧环境而导致肺部液体积聚的一种高原疾病,通常在海拔上升到2 500~3 000米以上的2~4 d内发生。高原肺水肿可导致呼吸困难、运动不耐受、疲劳、咳嗽和发绀,如果不及时治疗,可能会危及生命[1-2]。目前对高原肺水肿的治疗包括乙酰唑胺、红景天等抗高原反应药物,但其治疗仍然有很大的局限性[3]。针对高原肺水肿的防治药物亟待开发。骨化三醇即1,25二羟基维生素D3[1,25-(OH)2-D3]能抑制平滑肌细胞的增殖,通过调节气道平滑肌相关基因的转录,使气道重塑和炎症反应减轻[4]。此外,笔者前期测序研究发现骨化三醇改善高原肺水肿与补体和凝血级联通路相关[5]。研究表明,补体和凝血级联通路的下游通路是B细胞受体(B cell receptor,BCR)信号通路。磷脂酰肌醇3激酶(phosphatidylinositol-3-kinase,PI3K)是BCR信号通路下游的重要效应因子,可导致早期基因的表达,并进一步激活参与B细胞增殖、分化及其他过程的其他基因表达[6]。因此,笔者推测骨化三醇改善高原肺水肿可能与B细胞受体/PI3K/蛋白激酶B(protein kinase B,AKT)/核因子-κB(nuclear factor-κB,NF-κB)通路相关。本研究旨在探讨骨化三醇对高原肺水肿发生的抑制作用及机制,为骨化三醇防治高原肺水肿提供参考依据。
1 材料和方法
1.1 实验动物
健康SD雄性大鼠30只,体质量200~300 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2021-0011。大鼠饲养于青海大学实验动物房,饲养条件为温度 25℃±2℃,湿度50%~60%,自由饮食、饮水,定期更换垫料、清理消毒鼠笼。本研究经青海大学医学院实验动物伦理委员会批准,所有实验操作均严格按照还原、细化、替代的3R原则进行。
1.2 主要试剂
骨化三醇软胶囊(国药准字:H20143142)购自正大制药(青岛)有限公司;TUNEL试剂盒购自瑞士罗氏公司;B细胞活化因子(B cell activating factor belonging to the TNF family,BAFF)、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白介素-6(interleukin 6,IL-6)、干扰素-γ(interferon-γ,IFN-γ)、白介素-4(interleukin 4,IL-4)、白介素-10(interleukin 10,IL-10)ELISA试剂盒购自上海茁彩生物科技有限公司;一抗CD21购自英国Abcam;一抗人核因子κB抑制蛋白α(NF-kappa-B inhibitor α,IkBα)购自北京博奥森;HRP标记山羊抗兔IgG二抗、FITC-Tyramide购自武汉塞维尔生物科技有限公司;PI3K兔克隆抗体、AKT兔克隆抗体、p-AKT兔克隆抗体、IkBα兔克隆抗体、p-IkBα兔克隆抗体购自武汉Abclonal;p-PI3K兔克隆抗体购自英国Abcam。
1.3 高原肺水肿大鼠模型构建及分组
大鼠适应性饲养1周后,随机将大鼠分为常氧组、低氧组、低氧+骨化三醇组,每组10只。常氧组和低氧组灌胃等体积生理盐水;低氧+骨化三醇组灌胃骨化三醇(骨化三醇软胶囊以体积比60∶10∶30溶解于丙二醇、乙醇和水的混合溶剂中,最终配置成浓度为0.252 μg/kg的骨化三醇溶剂),各组均每日灌胃1次,连续5 d。第6天常氧组大鼠继续饲养在实验动物房,低氧组、低氧+骨化三醇组大鼠置于模拟海拔6 000 m低氧环境的低压氧舱内(大鼠进舱后以10 m/s速度减压上升,10 min达到海拔6 000 m,氧含量9.8%),之后维持氧含量在9.7%~9.9%之间,舱内大气压维持在46.57~49.02 kPa范围内,湿度维持在49%~55%之间。室内温度由中央空调统一控制,白天保持在22℃~24℃,夜晚保持在16℃~18℃饲养48 h。饲养结束后,将低压氧舱内的海拔降至3 500 m,并在实验舱进行大鼠样本取材。
1.4 样本采集
低氧组大鼠低氧胁迫48 h后,以断颈法迅速处死大鼠,摘取完整肺组织,左肺上叶用于测定肺含水量,左肺下叶-80℃保存,右肺组织采用10%中性甲醛溶液固定;常氧组同一时间按上述方法在常氧条件下取材,并进行后续检测。
1.5 肺含水量测定
采用干湿比重法测定肺含水量,左肺上叶称重后放入55℃烘箱中,直至干重的称重误差在0.000 2 g以内。肺含水量(%)=(湿重-干重)/湿重×100%。
1.6 H-E染色观察肺组织病理变化
取经10%中性甲醛固定的肺组织,石蜡包埋制作病理切片(5 μm),H-E染色,光学显微镜下观察肺组织病理改变情况。根据肺组织炎症判断标准进行炎症评分[7]:0分为无炎症反应;1分为轻度炎症,支气管或血管壁及肺泡间隔内有炎症细胞灶;2分为中度炎症,支气管或血管壁及肺泡间隔内有片状炎症或局限性炎症,面积<1/ 3;3分为重度炎症,支气管或血管壁及肺泡间隔内有弥漫性炎症细胞,面积在1/3~2/3之间。
1.7 TUNEL法检测肺组织细胞凋亡
取经10%中性甲醛固定的肺组织,石蜡包埋,切片(5 μm),柠檬酸盐缓冲液微波修复,荧光TUNEL孵育液37℃孵育,DAPI衬染,甘油明胶封片。采用Pannoramic 250数字切片扫描仪进行扫描采集图像,再根据组织大小采集3个区域9张图像,进行凋亡细胞分析。
1.8 免疫荧光染色观察肺组织CD21和IκBα的表达
取经10%中性甲醛固定的肺组织,石蜡包埋,切片(5 μm),将切片浸入柠檬酸盐缓冲液微波修复,3%双氧水阻断内源性过氧化物酶,山羊血清封闭液封闭,滴加一抗CD21(1∶100)4℃过夜,滴加HRP标记的二抗(1∶100)室温孵育30 min,加入FITC-Tyramide(1∶500)室温孵育10 min;将切片浸入柠檬酸盐缓冲液微波修复,滴加一抗IκBα(1∶100)4℃过夜,滴加荧光二抗(1∶100)室温孵育30 min,滴加DAPI室温孵育10 min,使用抗荧光衰减封片剂封片。显微摄像系统对切片进行图像采集,采用Image-J图像分析系统测定所采集全部图像的荧光强度。
1.9 ELISA检测肺组织BAFF、TNF-α、IL-6、IFN-γ、IL-4、IL-10含量
取-80℃保存的肺组织,匀浆,10 000 r/min离心10 min后取上清液,采用ELISA试剂盒步骤检测肺组织BAFF、TNF-α、IL-6、IFN-γ、IL-4、IL-10含量。
1.10 免疫印迹检测肺组织PI3K、p-PI3K、AKT、p-AKT、IκBα、p-IκBα表达
取-80℃保存的肺组织,从样本中提取总蛋白,并测定蛋白浓度,用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDA-PAGE)分离等量的蛋白质,并转移到聚丙烯酰胺二氟(PVDF)膜上。将膜在室温下用5%的脱脂牛奶阻断2 h,用一抗PI3K、p-PI3K、AKT、p-AKT、IκBα、p-IκBα(1∶2 000)或β-actin(1∶50 000)孵育膜在4℃下摇晃过夜。第2天用生物素化山羊抗兔IgG(H+L)二抗(1∶5 000)室温孵育2 h,并使用增强化学发光试剂显影,检测所有条带的灰度值,结果以目的蛋白相对表达量表示。
1.11 统计学处理
使用SPSS 22.0软件进行数据统计分析。符合正态分布的计量数据以±s表示,采用单因素方差分析进行比较,两组间均数比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 骨化三醇对高原肺水肿大鼠肺质量、肺含水量的影响
与常氧组比较,低氧组肺组织湿重、干重及含水量均明显升高(P<0.05);与低氧组比较,低氧+骨化三醇组肺组织湿重、干重差异无统计学意义(P>0.05),但肺组织含水量明显降低(P<0.01)(表1)。
表1 各组大鼠肺质量、肺含水量变化(n=10,±s)

表1 各组大鼠肺质量、肺含水量变化(n=10,±s)
*P<0.05,**P<0.01 vs常氧组;△△P<0.01 vs低氧组
组别肺组织湿重(g)肺组织干重(g)肺组织含水量(%)常氧组0.16±0.020.12±0.0274.18±0.91低氧组0.21±0.03*0.16±0.03**77.82±0.95**低氧+骨化三醇组0.19±0.030.14±0.0274.73±0.66△△
2.2 骨化三醇对高原肺水肿大鼠肺组织病理变化的影响
常氧组大鼠肺组织表面被覆浆膜,未见明显水肿、炎症细胞浸润或纤维结缔组织增生。低氧组大鼠肺组织见轻微肺泡隔增宽,细胞成分增多,可见少量肺泡上皮细胞增生,间质内少量炎症细胞浸润及少量纤维组织增生,肺泡腔轻度扩张,可见肺泡间隔变窄,细胞成分减少,肺泡上皮细胞水肿。低氧+骨化三醇组大鼠肺组织少量肺泡上皮细胞水肿,细胞质淡染,细胞体积增大,且少量肺泡上皮细胞脱落于肺泡腔内,间质内少量炎症细胞浸润(图1A~1C,见封二)。与常氧组比较,低氧组肺组织炎症评分及细胞凋亡率明显增加(P<0.01);与低氧组比较,低氧+骨化三醇组肺组织炎症评分及细胞凋亡率明显降低(P<0.01)(图2A~2C,图4A、4B)。
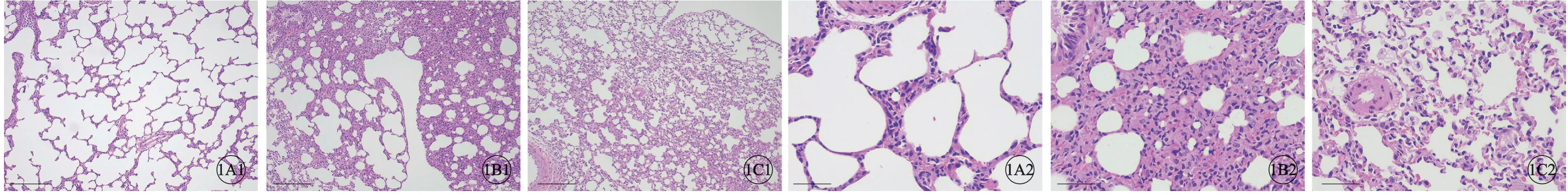
图1 各组大鼠肺组织病理变化,H-E染色,A1~C1:×100,标尺=200 µm;A2~C3:×400,标尺=50 µm。A:常氧组;B:低氧组;C:低氧+骨化三醇组.

图2 各组大鼠肺组织TUNEL染色,×400,标尺=20 µm。A:常氧组;B:低氧组;C:低氧+骨化三醇组。A1~C1:Merged;A2~C2:DAPI;A3~C3:TUNEL.
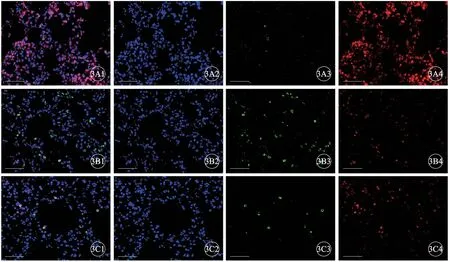
图3 各组大鼠肺组织CD21和IκBα免疫荧光染色,×400,标尺=20 µm。A:常氧组;B:低氧组;C:低氧+骨化三醇组。A1~C1:Merged;A2~C2:DAPI;A3~C3:CD21;A4~C4:IκBα.
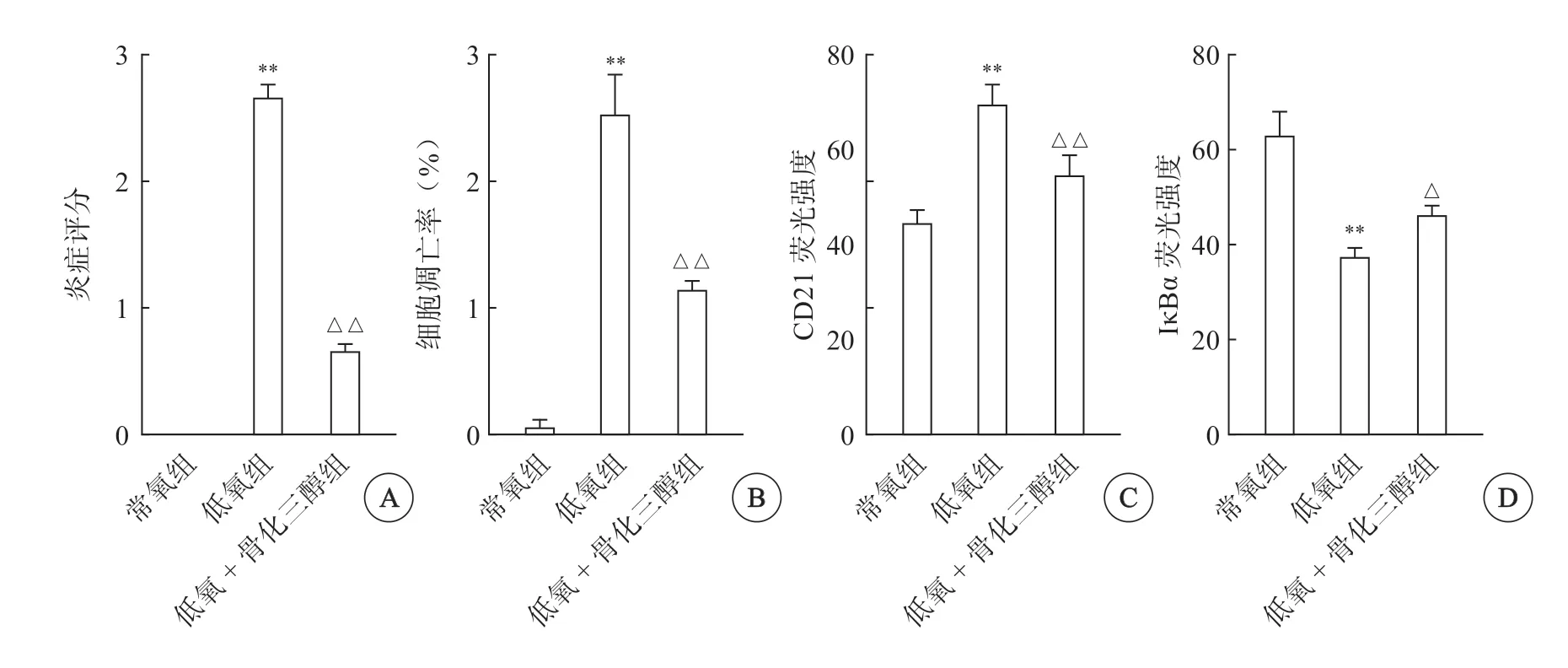
图4 各组大鼠肺组织病理炎症评分(A)、细胞凋亡率(B)、CD21荧光强度(C)及IκBα荧光强度(D)比较
2.3 骨化三醇对高原肺水肿大鼠肺组织B细胞活化及炎症细胞因子的影响
与常氧组相比,低氧组大鼠肺组织BAFF、TNF-α、IL-6、IFN-γ含量明显升高,IL-4、IL-10含量明显降低(P<0.01);与低氧组相比,低氧+骨化三醇组大鼠肺组织BAFF、TNF-α、IL-6、IFN-γ含量明显降低,IL-4、IL-10含量明显升高(P<0.01)(图5)。
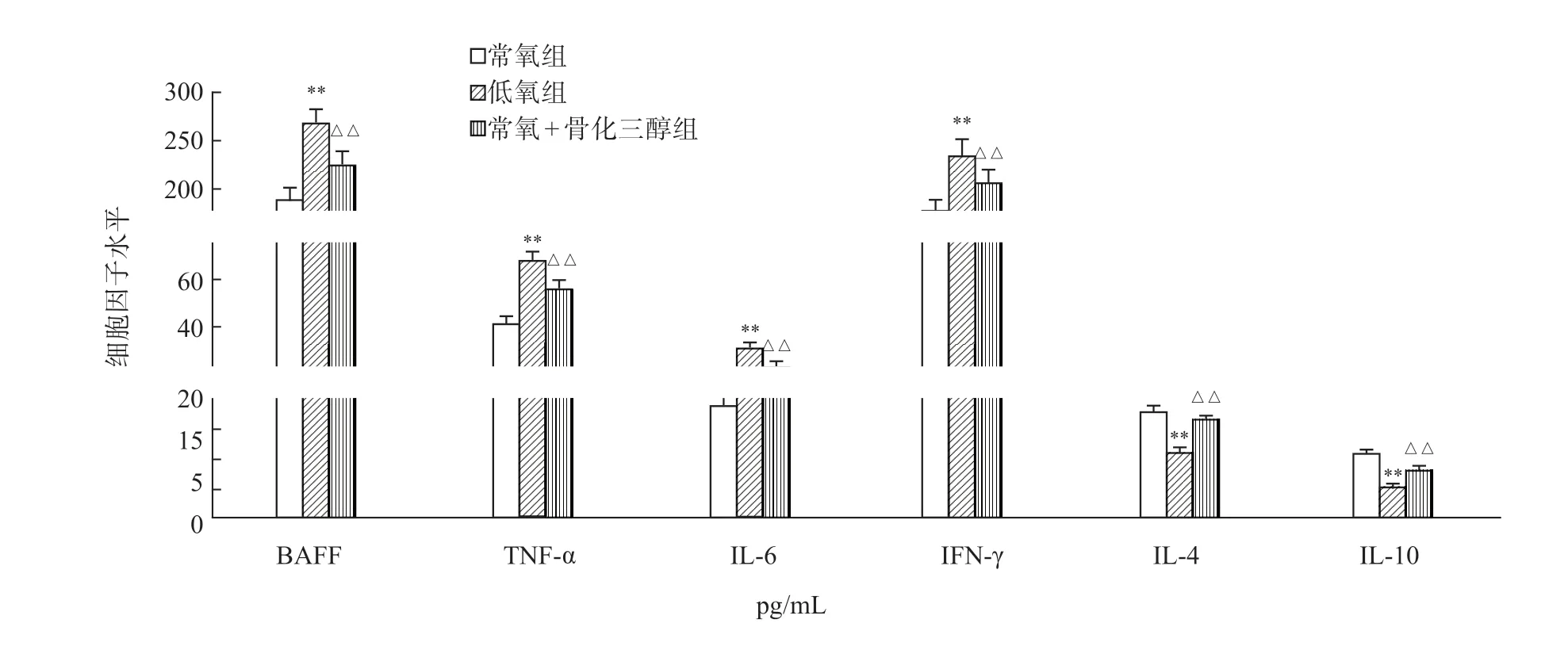
图5 各组大鼠肺组织B细胞活化因子及炎症细胞因子含量变化
2.4 骨化三醇对高原肺水肿大鼠组织PI3K/AKT/NF-κB信号通路的影响
免疫荧光共染结果显示,CD21蛋白表达呈现绿色,IκBα蛋白表达呈现红色,均定位于细胞核。与常氧组相比,低氧组CD21荧光强度明显升高,IκBα荧光强度明显降低(P<0.01);与低氧组相比,低氧+骨化三醇组CD21荧光强度明显降低,IκBα荧光强度明显升高(P<0.05)(图3,图4C、4D)。免疫印迹检测结果显示,与常氧组相比,低氧组p-PI3K、p-AKT蛋白表达明显升高,p-IκBα蛋白表达明显降低(P<0.01);与低氧组相比,低氧+骨化三醇组p-PI3K、p-AKT蛋白表达明显降低,p-IκBα蛋白表达明显升高(P<0.05);而各组间PI3K、AKT、IκBα蛋白表达差异无统计学意义(P>0.05)(图6)。
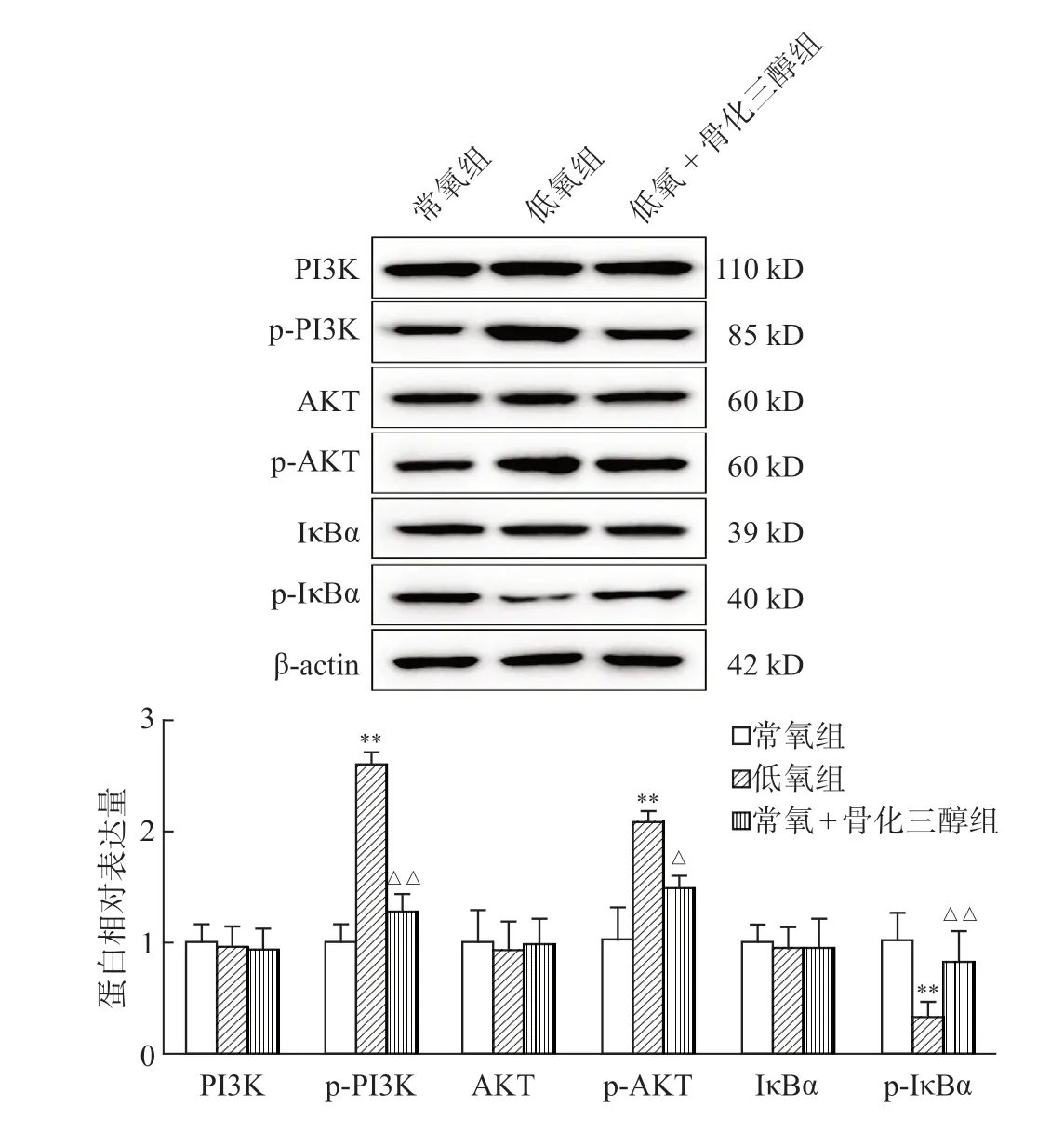
图6 各组大鼠肺组织PIK3/AKT/NF-κB信号通路相关因子变化
3 讨论
高原肺水肿的发生与缺氧及炎症有关[8]。研究表明,暴露在高海拔地区的受试者血清中IL-6的水平增加,在暴露的第2天达到峰值[9]。对暴露于低气压缺氧条件72 h大鼠的研究显示,其血清中IL-1β的水平增加[10]。此外,大鼠在急性低气压下(3 h、7 620 m)肺部促炎细胞因子(TNF-α、IL-6、IL-10)和中性粒细胞浸润水平增加[11]。研究显示高海拔或低气压缺氧可影响免疫平衡机制,可能导致与缺氧状况相关的疾病发生,TNF-α、IL-6、IL-10等促炎细胞因子在早期高原肺水肿中发挥作用,并可能与肺动脉高压相关[12]。一项研究表明,高原肺水肿大鼠在接受高压氧疗法后,表现出增加组织氧合、改变中性粒细胞功能和损害细菌复制等有益影响,并能特异性地抑制TNF-α和低氧诱导因子-1,从而有利于抗氧化及抗水肿作用[13]。同时,肺组织病理损伤、细胞凋亡率及肺含水量是评价肺水肿严重程度的指标[14]。本研究首先测定了骨化三醇对高原肺水肿大鼠肺组织含水量及病理变化的影响,结果显示骨化三醇减轻肺组织损伤,肺组织呈现少量肺泡上皮细胞水肿及少量炎症细胞浸润,且肺含水量明显降低,表明骨化三醇可以缓解高原肺水肿造成的肺组织损伤。同时,骨化三醇抑制了肺组织中TNF-α、IL-6、IFN-γ含量及肺组织细胞凋亡,增高了IL-4、IL-10含量,这一结果表明,骨化三醇减轻了高原肺水肿大鼠肺组织炎症反应,该结果与大多数高原肺水肿相关的基础研究和临床研究相一致[15-16]。
研究显示B细胞是适应性免疫的重要组成部分,其产生和分泌数百万种不同的抗体分子,每一种都能识别不同的外来抗原[17]。BCR是一种由2对膜结合的免疫球蛋白重链和轻链组成的细胞表面受体,由CD79A(Ig-α)和CD79B(Ig-β)组成的异二聚体与BCR形成复合物,并在细胞内信号转导中起至关重要的作用[18]。BCR信号转导集中参与了正常和恶性B细胞的激活、生存和增殖,在抗原刺激下,蛋白酪氨酸激酶(PTKs)-SRC家族激酶LYN、SYK及TEC家族激酶BTK被激活[19]。此外,被激活的SYK会使B细胞核心受体CD19和PI3K磷酸化,这种信号最终直接导致早期基因的表达,进一步激活参与B细胞增殖、分化以及其他过程的其他基因的表达[20]。此外,缺氧可通过刺激NF-κB基因转录和促炎细胞因子的产生引起机体的炎症反应,而BCR可以介导NF-κB途径的下游激活[21]。笔者前期测序研究显示骨化三醇改善高原肺水肿与补体和凝血级联通路相关,而BCR信号通路是补体和凝血级联通路的下游通路[5]。先前的研究表明,在急性高原肺水肿大鼠中PI3K/AKT途径被激活,而山柰酚可能通过下调PI3K/AKT信号通路预防低压低氧诱导的急性高原肺水肿的发生[22]。本研究结果显示,低氧组BAFF含量、CD21荧光强度、p-PI3K蛋白、p-AKT蛋白表达明显升高,p-IκBα蛋白表达明显降低,提示低压低氧诱导B细胞受体/PI3K/AKT/NF-κB通路激活。经骨化三醇干预后,BAFF含量、CD21荧光强度、p-PI3K蛋白、p-AKT蛋白表达明显降低,表明骨化三醇可以抑制B细胞受体/PI3K/AKT/NF-κB通路。因此,骨化三醇可能通过抑制B细胞受体/PI3K/AKT/NF-κB通路进而缓解高原肺水肿。
综上所述,骨化三醇通过抑制炎症反应可预防高原肺水肿的发生,这种保护作用机制可能与其抑制B细胞受体/PI3K/AKT/NF-κB信号通路有关,这为后续将骨化三醇开发成为防治高原肺水肿的药物奠定了理论基础。

