神经导航联合荧光素钠术中显影辅助切除脑转移瘤的应用分析
朱雷 雷奕 莫立根 凌国源 邓腾 黄乾荣 蒋骞 石柳
作者单位:530199 南宁1南宁市武鸣区中医医院脑病科;530021 南宁2广西医科大学附属肿瘤医院神经外科
脑转移瘤(brain metastasis,BM)是指原发于身体其他部位的恶性肿瘤转移至脑内,约40%的恶性肿瘤患者最终继发BM,BM 已成为成年人最常见的颅内恶性肿瘤[1]。目前,BM 的治疗方式主要有外科手术、放疗、化疗、靶向治疗及免疫治疗等。随着术中神经导航、超声、MRI、荧光显影等辅助技术较为广泛的应用,脑肿瘤手术的安全性大为提高,BM 全切可延长患者总体生存期,延缓肿瘤复发[2],神经导航能优化手术入路、精准定位BM[3],荧光素钠(fluorescein sodium,FLS)能实现BM 术中实时显影,提高肿瘤全切率[4]。既往研究已证实神经导航联合FLS术中显影辅助切除脑胶质瘤能提高肿瘤全切率、改善患者预后[5-6]。然而尽管将神经导航与FLS术中显影辅助技术联合应用于BM 的手术能提供多模态的术中定位、显影模式,但其效果尚不明确。为此,本研究探讨神经导航联合FLS术中荧光显影辅助显微切除BM的有效性及安全性。
1 临床资料与方法
1.1 一般资料
回顾性收集2019年1月至2022年10月广西医科大学附属肿瘤医院神经外科手术治疗的125 例BM 患者的临床资料,其中将2019年1月至2020年1月采用神经导航辅助手术切除的38 例BM 患者归为神经导航组,2020 年2 月至2022 年10 月采用神经导航联合FLS术中荧光显影辅助手术切除的87例BM患者归为神经导航联合荧光素钠组纳入研究。患者纳入标准:⑴年龄18~75岁,卡氏功能状态(karnofsky scale,KPS)评分>60 分,单发的实体肿瘤,最大直径3 cm 以上,占位效应明显,或多发的实体肿瘤,但有明确“责任病灶”导致严重临床症状;⑵病理确诊为BM,原发病灶稳定,且原发性肿瘤不在脑部,预计存活时间3~6 个月;⑶颅内病灶首次行神经导航(或)联合FLS 术中荧光显影辅助手术;⑷无手术禁忌证;⑸由同一手术组医师实施手术。排除标准:⑴合并脑干病变者;⑵除荧光素钠显影和神经导航技术外,切除手术过程中使用超声等其他辅助引导技术者;⑶BM 复发再次手术者;⑷严重心肺、肝肾功能及凝血功能障碍者;⑸伴有脑脓肿、脑部外伤、脑卒中等其他脑部病变者;⑹对FLS过敏者;⑺术后拒绝规范综合治疗及随访者。本研究经广西医科大学附属肿瘤医院伦理委员会批准(伦理编号:LW2023166),患者及(或)家属签署手术知情同意书。
1.2 方法
1.2.1 术前影像学检查 所有患者均使用3.0T 超导磁共振(美国GE 公司)行头颅MRI 检查,扫描序列包括:T1加权成像(T1-weighted imaging,T1WI)、T2加权成像(T2-weighted imaging,T2WI)、T2-液体衰减反转恢复序列(FLAIR)、动态增强磁共振成像(dynamic contrast enhanced MRI,DCE-MRI)、磁共振血管成像(MR angiography,MRA)、扩散张量成像(diffusion tensor imaging,DTI)。同时计算肿瘤体积,计算公式:肿瘤体积=长径×宽径2/2。
1.2.2 术前神经导航计划制定 所有患者术前均进行神经导航计划影像处理,即通过医院PACS 影像系统将头颅MRI 数据上传至软件工作站(德国Brainlab公司),以T1增强影像勾勒出肿瘤轮廓,并对DTI 图像进行后处理,以不同颜色标记不同种类的神经纤维束走形,将MRI 图像与预处理的DTI 图像进行融合,形成三维导航图像。术前将神经导航计划导入Brainlab神经导航系统(德国Brainlab 公司),并完成导航注册步骤。
1.2.3 手术方法 手术操作均由同一科室具有高级职称的医师完成。患者全身麻醉后,两组均根据术前MRI确定肿瘤部位、侵犯范围、最大直径,以及肿瘤与周围重要血管、神经的位置关系。使用神经导航确定最佳手术入路。神经导航组:切开硬脑膜后,术中采用神经导航引导,在德国蔡司手术显微镜(Carl Zeiss-Meditec Pentero 900)下依据术者经验及神经导航判断肿瘤主体及边界,然后对BM 进行切除;术后分别对肿瘤及瘤旁组织行病理常规及免疫组化检查。神经导航联合荧光素钠组:将0.5 mL 的FLS 注射液(3 mL:0.6 g,广州白云山明兴制药有限公司,国药准字号:H44023401)稀释至1%,静脉推注5 mL,观察15 min,生命体征平稳及无皮疹发生者为试敏阴性;如试敏阴性则将20% FLS 稀释至3%,切皮前30 min给予患者5 mg/kg 静脉推注。暴露肿瘤后将显微镜调至“YELLOW 560”荧光模式,在该模式下BM 呈现亮黄色或黄色,病灶边界、水肿带呈淡黄光,血管和出血呈红色,术者可以较长时间在荧光模式下切除肿瘤,尤其是血供丰富的肝癌脑转移病灶,无需反复切换显影模式,切除亮黄色及淡黄色区域,直至无黄染区。术中可灵活应用神经导航对肿瘤主体及边界进行定位,术后分别对肿瘤(亮黄色区域)及瘤旁组织(淡黄光区域)行病理常规及免疫组化检查。两组均常规止血、关颅,麻醉复苏平稳后转神经外科病房监护治疗。
1.2.4 术后处理 术后24 h 内复查头颅CT 平扫,了解术区是否有血肿形成。术后72 h 内复查头颅MRI平扫+增强,评价肿瘤切除程度。术后多学科联合会诊制定综合治疗方案。
1.3 疗效评价及随访
疗效评价指标包括肿瘤切除程度,分为全切除(切除100%或扩大切除)、次全切除(切除>90%)、大部分切除(切除60%~90%)及部分切除(切除<60%);手术时间、出血量、术后并发症以及术后1 个月生活质量等。通过门诊、住院复诊及电话随访,采用KPS评分评价患者生活质量。
1.4 统计学方法
采用SPSS 22.0 统计软件进行数据处理分析。正态分布的计量资料用(x±s)表示,组间比较采用两独立样本的t检验;非正态数据采用中位数(P25,P75)进行表述,组间比较采用非参数秩和检验;计数资料采用频数(%)进行表示,组间比较采用χ2检验。采用多重线性回归或logistic 回归分析组间差异分析,模型1未进行混杂因素调整;模型2 校正因素包括年龄、性别、肿瘤转移来源、脑转移瘤数量、手术肿瘤位置、肿瘤体积、首发症状、术前KPS 评分。以P<0.05 为差异有统计学意义。
2 结果
2.1 基线特征
共125 例患者符合标准纳入本研究,均顺利完成手术,其中神经导航联合荧光素钠组87 例,神经导航组38 例。神经导航联合荧光素钠组男性44 例,女性43 例,平均年龄(54.40±10.40)岁;神经导航组男性22 例,女性16 例,平均年龄(53.18±10.37)岁。两组患者首发症状、肿瘤转移来源、手术肿瘤部位、脑转移灶数量、肿瘤体积、术前KPS 评分等一般资料比较差异无统计学意义(均P>0.05),见表1。

表1 两组患者的基线特征Tab.1 Baseline characteristics of patients in the two groups
2.2 两组切除程度、手术时间和术中出血量的比较
神经导航联合荧光素钠组转移瘤术中荧光模式下显影率为100%。神经导航联合荧光素钠组的肿瘤全切率明显高于神经导航组(85.1%vs65.8%,P=0.028);神经导航联合荧光素钠组的平均手术时间、术中出血量均少于神经导航组(均P<0.05)。多因素回归校正年龄、性别、肿瘤转移来源、脑转移瘤数量、手术肿瘤位置、肿瘤体积、首发症状、术前KPS评分等潜在混杂因素后,神经导航联合荧光素钠组的全切率是神经导航组的1.849 倍(OR=1.849,95%CI:1.130~3.026,P=0.014),模型1和模型2均提示两组手术时间和术中出血量比较差异有统计学意义(均P<0.05),见表2。
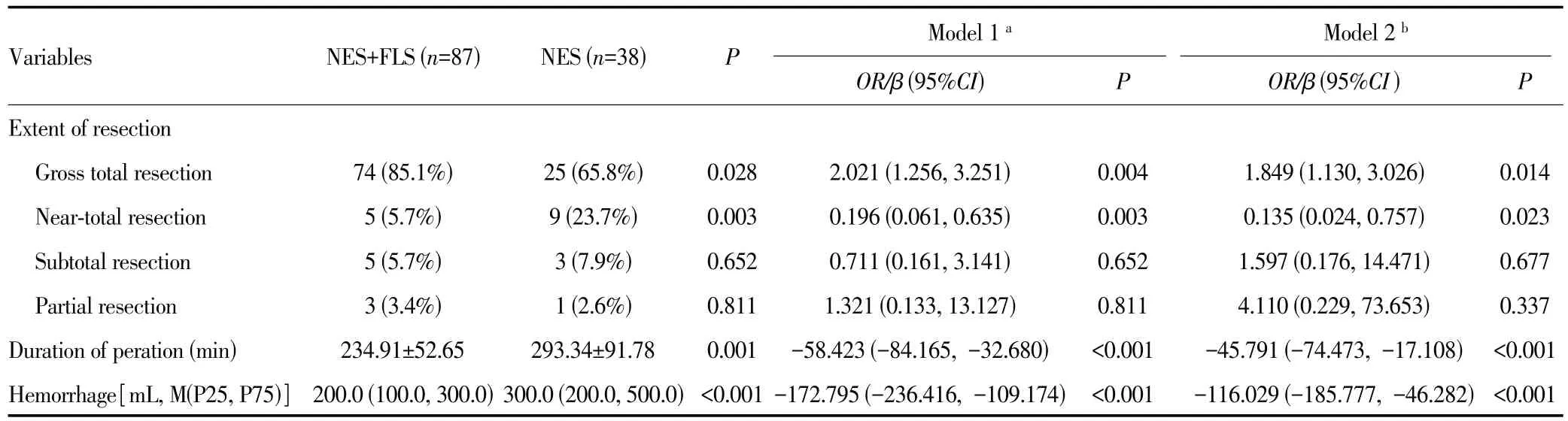
表2 两组切除程度、手术时间及术中出血量比较Tab.2 Comparison of resection degree, operative time and intraoperative blood bleeding between the two groups
2.3 两组患者术后并发症及术后1个月KPS评分比较
神经导航联合荧光素钠组和神经导航组术后并发症主要包括偏瘫、血肿、颅内感染、失语、癫痫及肺炎、应激性溃疡等,两组各项并发症发生率比较差异无统计学意义(P=0.893)。神经导航联合荧光素钠组的术后1 个月KPS 评分高于神经导航组(78.96±13.81vs65.00±18.56,P<0.001),多因素回归校正年龄、性别、肿瘤转移来源、脑转移瘤数量、手术肿瘤位置、肿瘤体积、首发症状、术前KPS评分等潜在混杂因素后,神经导航联合荧光素钠组的术后1 个月KPS 评分仍高于神经导航组(P<0.001),见表3。
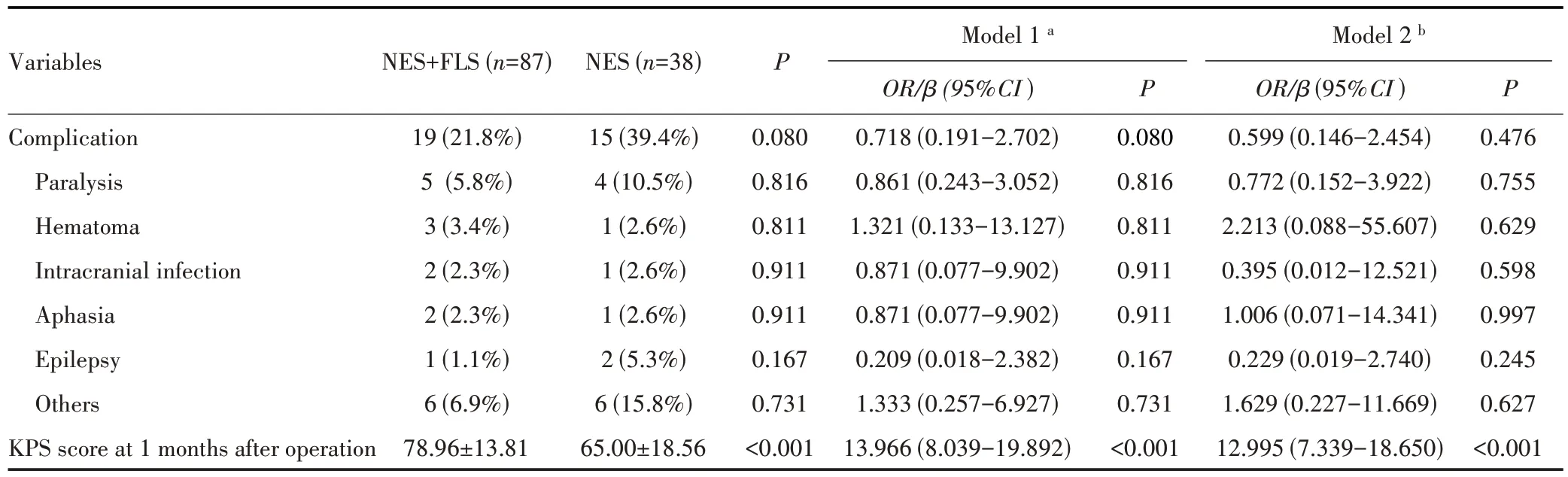
表3 两组患者术后并发症及术后1个月KPS评分比较Tab.3 Comparison of complications and KPS score at 1 month after operation between two groups
3 讨论
神经导航技术能够优化手术入路,术中快速定位病灶,准确地避开脑功能区,减少手术对脑功能区组织、血管和纤维束的破坏和损伤。然而,术中脑脊液流失、脑压板的使用以及重力作用等因素常导致导航出现漂移[7],尤其体现在分块切除脑肿瘤、脑压板牵拉脑组织暴露深部脑肿瘤时,神经导航不能提供术中的实时成像,不利于术中肿瘤边界的定位。FLS 是一种人工合成的具有强黄绿色荧光的染料非靶向示踪剂,脑胶质瘤或BM等恶性肿瘤呈浸润性生长,导致血管壁通透性改变及血-脑屏障受损,使静脉注射的FLS得以通过血-脑屏障并在肿瘤组织内蓄积。术中将专用的显微镜调至荧光模式,在蓝色背景下蓄积了FLS的肿瘤组织显示出独有的黄绿色荧光[8],而BM 在FLS 术中显影辅助技术中呈亮黄色或黄色,血管和出血呈红色。神经导航联合FLS 术中显影辅助具有优化手术入路、快速定位、提供实时的病变可视化等特点,术者可以在显微镜的白光、荧光两种模式灵活、方便地切换,有利于缩短手术时间减少出血量[9]。
ACERBI 等[10]于2011 年首次使用配备YELLOW 560 专用滤波器的Pentero 显微镜在FLS(5~10 mg/kg)显影辅助下手术切除12 例高级别胶质瘤,肿瘤全切除率高达75%。此后,更多的学者使用低剂量FLS(1~5 mg/kg)术中显影辅助切除脑胶质瘤,全切除率在72%~100%[11-12]。KOFOED 等[13]报道FLS 显影辅助下切除BM 全切率为71%。HÖHNE 等[14]使用FLS(5 mg/kg)术中显影辅助切除95 例BM,95%的BM 病灶有明亮的荧光染色,全切率为83%。本研究中神经导航联合荧光素钠组的BM 显影率为100%,全切率为85.1%,与上述报道相似,而且高于神经导航组的65.8%。此外,神经导航联合荧光素钠组的手术时间和出血量也均低于神经导航组。这可能是因为神经导航技术与术中实时FLS 显影技术联合应用可快速确定肿瘤边界,有助于克服神经导航不能提供术中实时成像的劣势,及时纠正术中脑组织移位而产生的误差,保证术中精确地切除病灶,从而提高了BM的全切率,缩短手术时间,减少手术出血量。
目前,国外还有术中使用大剂量(10~20 mg/kg)FLS 过敏反应的个例报道[15],但在1~5 mg/kg 剂量使用范围内未见严重过敏反应的报道,并且在国内至今尚未见脑肿瘤手术中使用FLS 过敏反应的报道,可见在脑肿瘤手术中使用非大剂量FLS 显影辅助有极高的安全性。本研究中,两组患者偏瘫、血肿、颅内感染、失语、癫痫及肺炎、应激性溃疡等各项并发症发生率比较差异无统计学意义,说明在安全剂量范围内使用FLS术中显影辅助并未增加并发症发生率。RAFFA等[16]报道神经导航联合FLS 术中显像辅助技术切除功能区脑胶质瘤,患者神经功能缺损的发生率由20%下降到11.4%。本研究中神经导航联合荧光素钠组术后1 个月的KPS 评分高于神经导航组,说明神经导航联合荧光素钠术中显影辅助可能对脑组织功能的保护起到了积极作用,从而改善了患者的术后生活质量。
综上所述,神经导航联合FLS 术中荧光辅助切除BM,能提高肿瘤全切率、改善患者短期生活质量,且该手术方法安全。但是本研究为回顾性资料,仅分析了神经导航联合荧光素钠术中显影辅助技术切除BM的短期疗效,尚未观察该治疗方案对BM 患者预后和生存时间的影响,而样本量偏少,可能存在一定偏倚,因此今后需要进一步通过前瞻性研究和收集更多的临床数据验证本研究结论。

