肿瘤应激的多面手:谷氨酸脱氢酶1(GLUD1)
段海波 刘雨航 王雄军
作者单位:510091 广州 广州大学精准编辑与健康研究中心
癌症是全世界的一个主要死因,给医疗保健系统和全球经济带来了沉重的负担。根据世界卫生组织国际癌症研究机构(IARC)发布的数据,2020 年全球新增癌症病例约1 930 万例、死亡人数约1 000 万人[1]。肿瘤的发生和发展是一个非常复杂的过程,目前临床上的治疗方案主要有手术、放疗、化疗、靶向治疗以及免疫治疗。肿瘤治疗效果与其分期和癌种有关,因此在已有治疗方案的基础上,寻找或开发普适性高、抑癌效果好的药物尤为重要。谷氨酸脱氢酶1(glutamate dehydrogenase 1,GLUD1)是谷氨酸代谢途径的脱氢酶,是连接氨基酸代谢和糖代谢两大关键代谢途径的枢纽,在许多不同类型的肿瘤细胞中高表达。越来越多的研究表明,GLUD1 与肿瘤增殖、迁移以及在不良环境胁迫下的应激水平有重要关联。本文通过回溯GLUD1 的研究历史,就GLUD1 代谢酶在肿瘤应激的系列研究等方面展开综述。
1 GLUD1的生物学功能和结构
1.1 GLUD1介导的酶学反应
GLUD1介导的核心生化反应如图1所示。GLUD1是利用烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)或烟酰胺腺嘌呤二核苷磷酸(nicotinamide adenine dinucleotide phosphate,NADP+)作为辅因子,可逆地催化L-谷氨酸(Glu)氧化脱氢生成α-酮戊二酸(α-KG)和氨的一种酶[2]。GLUD1结合NAD+或NADP+和谷氨酸,催化谷氨酸氧化脱氨形成GLUD1·NAD(P)+·α-KG 的过渡态复合物,在低谷氨酸浓度下,过渡态复合物迅速分解,释放NAD(P)+和α-KG,GLUD1可以重新结合底物开始下一轮催化;在高谷氨酸浓度下,过渡态复合物中的α-KG 被谷氨酸取代形成GLUD1·NAD(P)+·Glu 复合物,该复合物释放NAD(P)+和谷氨酸的速度极为缓慢,ADP 和GDP 通过减弱对GLUD1·NAD(P)+·Glu 复合物的结合亲和力,促进NAD(P)+和谷氨酸释放从而加快GLUD1的循环;相反,GTP和ATP通过增加结合亲和力,抑制NAD(P)+和谷氨酸释放从而减弱GLUD1 的循环[3]。精氨酸、谷氨酰胺、组氨酸和脯氨酸通过一系列反应转化为谷氨酸,它们的碳骨架在GLUD1的作用下以α-酮戊二酸的形式进入三羧酸循环,因此GLUD1在补充三羧酸循环的中间产物方面有重要作用[3]。

图1 GLUD1酶学反应式Fig.1 GLUD1 enzymatic reaction equation
因GLUD1催化反应的可逆性,GLUD1既可以生产氨,也可以消耗氨,因此在氮代谢中也有重要作用。在高氨条件下,GLUD1对氨具有高亲和力,是主要的氨同化酶; 但在高葡萄糖条件下,即使氨浓度很高,超过85%的氨也会被谷氨酰胺合成酶(GS)/谷氨酸合成酶(GOGAT)同化。因为葡萄糖促进GS 的乙酰化和腺苷化,从而激活GS 的酶活性,同时诱导GLUD1乙酰化,阻碍其催化中心使GLUD1 失活,GS 和GLUD1 在体内的氨同化,同时受到氮源和碳源信号的调控,氮与三羧酸循环中间体α-KG 结合生成谷氨酸是氨同化的关键步骤,可以直接通过GLUD1 或间接通过GOGAT 催化的谷氨酰胺产生所有的细胞含氮成分[4]。
1.2 GLUD1的定位和结构
GLUD1基因含有13 个外显子和12 个内含子,位于人类第10 条染色体上并广泛表达,被认为是“管家”基因[5]。GLUD1 在基因组上的定位如图2 所示。GLUD1 蛋白亚细胞定位于线粒体,部分位于细胞质。1938 年,VON EULER 和DEWAN 分别在肝脏的粗制剂中发现谷氨酸脱氢酶催化α-KG可逆还原氨化为谷氨酸[6]。随着蛋白纯化技术的发展,可以通过一系列的提取、纯化获得GLUD1 蛋白晶体。这些蛋白晶体可以用来测定GLUD1 蛋白作为酶的各种性质以及解析蛋白的结构。早期对于GLUD1 在酶学方面的研究,主要利用NADH 在260 nm 和340 nm 处各有一吸收峰,而NAD 只有260 nm 处有吸收峰的性质,以此区别两者。通过分光光度计测定反应体系中产物的含量,获得其在不同条件下的米氏常数Km 值等各种酶学参数。GLUD1 的蛋白晶体还可以通过X 射线解析结构,确定酶对底物或调节性辅因子的结合位点。
图2 GLUD家族编码基因在基因组中的定位Fig.2 GLUD localization of family coding genes in the genome
人的GLUD1 蛋白是一个同源六聚体[7],基本上由两个三聚体组成,每个亚单位由大约500 个氨基酸残基组成,并由以下3 个结构域组成:位于二聚体界面附近的六聚体核心、NAD 结合域和哺乳动物酶的调节区。调节区由50 个残基的天线构成,位于NAD结合域的上方。来自每个亚基的天线紧紧地位于相邻的、逆时针方向的三聚体相邻的后面。由于这些缠绕的天线只存在于动物和受别构调节的纤毛虫中,因此推测其可能发挥了重要作用[3]。GLUD1 的结构示意图如图3所示。
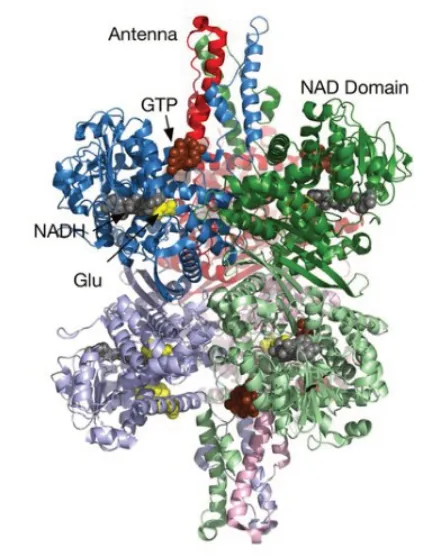
图3 GLUD1结构示意图[3]Fig.3 GLUD1 structural representation[3]
2 GLUD1在肿瘤应激中的作用
正常细胞可以通过多种途径转变为恶性细胞,包括抵抗细胞死亡信号、独立于外部生长信号、具备促进血管生成的能力、避免免疫系统的破坏,以及获取具有侵袭性特质而在适合的微环境中形成远处转移灶等。在肿瘤发生发展的关键时期,肿瘤应激可能会产生重要的影响[8]。GLUD1 在处理肿瘤应激反应方面扮演着复杂的角色。众所周知,两种主要的营养物质,即葡萄糖和谷氨酰胺,在哺乳动物细胞中发挥着关键作用。然而,在肿瘤微环境中,由于肿瘤细胞的快速增殖和高度代谢活性,常常出现营养物质不足的情况。在葡萄糖匮乏时,肿瘤细胞通过高表达GLUD1来加速其对葡萄糖的摄取和糖酵解,使其能在低葡萄糖环境中存活。而在氨基酸被剥夺时,GLUD1会从核糖体转运到胞质并被降解,进而抑制核糖体蛋白的表达以保存营养,这有助于肿瘤细胞的生存。此外,在肿瘤微环境中常常出现缺氧现象,GLUD1的存在可以保持氧化还原稳态,并通过稳定HIF1α适应缺氧应激,确保肿瘤细胞在缺氧条件下的存活和增殖。GLUD1 还可催化还原性氨化反应以吸收氨合成氨基酸,从而推动肿瘤细胞的增殖。总的来说,GLUD1 通过多种方式缓解应激带来的生存压力,促进肿瘤细胞的存活,如图4 所示。此外,GLUD1 抑制剂在处理肿瘤细胞时,能够有效地抑制其增殖能力,在体内和体外的联合用药实验中均显示出良好的效果,甚至可以使用GLUD1 抑制剂处理模拟谷氨酰胺剥夺的情况,这些都进一步证实了GLUD1 在肿瘤发展过程中的重要作用,以及使用GLUD1 抑制剂作为抗癌药物的可能性。
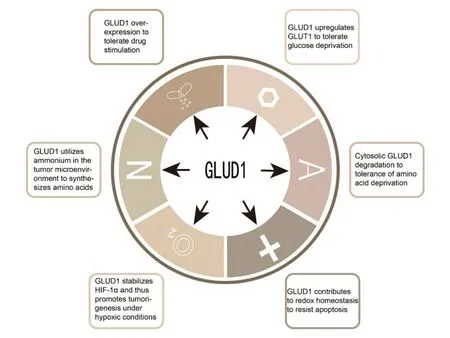
图4 GLUD1在肿瘤应激反应中的多维作用Fig.4 GLUD1 multidimensional role in tumor stress response
2.1 胶质母细胞瘤
胶质母细胞瘤是人类最常见的原发性恶性中枢神经系统肿瘤,约占所有胶质瘤的57%和所有原发性恶性中枢神经系统肿瘤的48%,是侵袭能力最强的胶质瘤[9-10]。胶质母细胞瘤总体生存期短,长期生存患者罕见,目前还没有较为有效的治疗方案,主要原因是其恶性程度高、进展快以及复发率高。目前胶质母细胞瘤主要的治疗方案是手术切除或诊断性活检,再辅以放化疗治疗,然而大多数患者还是在1~2 年内死亡[9]。WANG 等[11]发现在人胶质母细胞瘤细胞U87或U251中,经低葡萄糖浓度处理后,S384磷酸化的胞质GLUD1可与RelA和IKKβ相互作用,激活NF-κB上调葡萄糖转运蛋白GLUT1的表达,从而增强葡萄糖摄取和糖酵解,促进低糖条件下U87 和U251 细胞的存活;此外,GLUD1产生的α-KG可直接激活IKKβ和NFκB信号,上调GLUT1,促进低糖条件下U87和U251细胞的葡萄糖摄取和存活。该研究成果解释了在低葡萄糖条件下,沉默GLUD1 的U87 和U251 细胞生存能力弱,补充α-KG 到正常水平后,只能恢复部分生存能力的现象。YANG 等[12]研究表明,在人胶质母细胞瘤细胞LN229 或U251 中,表皮生长因子(epidermal growth factor,EGF)诱导表皮生长因子受体(epidermal growth factor receptor,EGFR)激活,导致丝裂原活化的细胞外信号调节激酶1(mitogen-activated extracellular signal-regulated kinase 1,MEK1)和细胞外信号调节激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)激活,从而使转录因子ELK1 磷酸化增强。磷酸化的ELK1 转入细胞核并与GLUD1 的启动子结合,导致GLUD1 的转录激活和谷氨酰氨分解增加。该研究同时指出GLUD1 的下调抑制了胶质母细胞瘤细胞的增殖和胶质母细胞瘤生长,但回补甲基化α-KG 显著恢复了沉默GLUD1 的胶质母细胞瘤细胞的增殖能力。以上研究表明,GLUD1在胶质母细胞瘤中可以使细胞加快葡萄糖摄取、增强糖酵解和耐受低葡萄糖环境;而在敲低GLUD1 后,胶质母细胞瘤细胞的增殖被抑制,耐受低葡萄糖环境的能力减弱。
2.2 胰腺癌
胰腺癌素有“癌症之王”的称号,是预后较差的肿瘤之一,发病隐匿,具有高度侵袭性和转移性,5 年生存率仅为11%[13]。胰腺癌由于发病隐匿,缺乏早期诊断生物标志物,所以大多数患者确诊时已处于晚期,而且胰腺癌对放化疗具有耐受性,对免疫治疗也不敏感,导致治疗效果不佳,预后极差[14-16]。胰腺癌的病因及发病机制目前尚未完全明确。在胰腺细胞中,GLUD1 参与调节胰岛素分泌,尤其是氨基酸刺激的胰岛素分泌,同时也参与其营养代谢。TANIZAWA等[17]报道了Y266C突变的GLUD1基本上对GTP抑制或ADP 激活不敏感,在胰岛素瘤细胞系MIN6 中过表达GLUD1-Y266C,单独使用谷氨酰氨能刺激胰岛素分泌。HE 等[18]发现在高表达XLOC_006390 的胰腺癌细胞CFPAC-1 和BxPC-3 中,XLOC_006390 可通过阻止c-Myc 泛素化从而稳定c-Myc;而c-Myc 可靶向GLUD1 启动子并上调GLUD1 的表达,从而促进α-KG产生,过量的α-KG补充了三羧酸循环,最终促进肿瘤细胞增殖。通过这些研究可以发现,Y266C 突变的GLUD1 在分泌胰岛素方面对氨基酸刺激更敏感;在胰腺癌细胞中,GLUD1 可以产生α-KG 以补充三羧酸循环,从而促进肿瘤进展。
2.3 肺癌
肺癌是全球范围内发病率和死亡率都居于第一的恶性肿瘤,绝大多数肺癌起源于支气管黏膜上皮,可以向四周乃至全身扩散。早期肺癌难以发现,大约70%的患者确诊后已是晚期,5 年生存率约为16%[19]。肺癌可分为两大组织学亚型,即小细胞肺癌和非小细胞肺癌,其中80%~85%的肺癌病例是非小细胞肺癌[20]。临床上这种划分对治疗方案的选择至关重要,小细胞肺癌患者主要采用化学疗法,外科治疗主要适用于非小细胞肺癌患者[21]。JIN 等[22]发现在肝激酶(liver kinase B1,LKB1)缺失的肺癌细胞中,GLUD1的产物α-KG通过增强其底物腺苷酸(adenosine monophosphate,AMP)依赖的蛋白激酶(AMP-activated protein kinase,AMPK)与钙/钙调素依赖性蛋白激酶激酶2(calcium/calmodulin dependent protein kinase kinase 2,CamKK2)的结合来激活CamKK2,促进能量产生,获得抗氧化性,敲除GLUD1基因不仅减弱了肺癌细胞生长,而且使肺癌细胞对失巢凋亡更加敏感,同时抑制转移。WANG 等[23]研究发现GLUD1 介导α-KG 的产生会伴随活性氧(reactive oxygen species ,ROS)积累,通过诱导锌指转录因子促进肺癌细胞迁移和侵袭。该研究还发现过表达GLUD1 的肺癌细胞表现出更强的多西他赛(docetaxel)耐受能力以及更强的转移和迁移能力,但是这些都在沉默GLUD1后被抑制,而在回补α-KG后又抵消了沉默GLUD1 带来的抑制作用。KANG 等[24]报道了EGFR 与GLUD1 共定位于线粒体,EGFR 使GLUD1的Y135磷酸化,从而激活GLUD1,并与P90核糖体S6 激酶2(ribosomal S6 kinase 2,RSK2)一起通过钙/钙调蛋白依赖性蛋白激酶Ⅳ(calcium/calmodulin -dependent protein kinase Ⅳ,CaMKIV)信号增强环磷酸腺苷响应元件结合蛋白(cycle-AMP response binding protein,CREB)活性,从而促进转移;共同抑制RSK2和GLUD1可导致肿瘤内CD8+T细胞浸润增强。上述研究表明,在肺癌细胞中GLUD1介导产生的α-KG可以促进能量产生,增强抗氧化和迁移,增强多西他赛的耐受能力;相反,在GLUD1被敲低后,这些能力会大幅下调。
2.4 乳腺癌
乳腺癌是女性中最常见的恶性肿瘤,其发病率在世界范围内逐年上升。根据国际癌症研究机构的数据,乳腺癌在全球范围内比肺癌更常见,到2040 年,乳腺癌死亡率将上升50%[25]。在我国,乳腺癌是女性第一高发恶性肿瘤,平均诊断年龄为49 岁,比西方国家提前5~10岁,由于该疾病具有很强的异质性、易转移和治疗耐药性等特点,所以该领域的研究仍然面临诸多挑战,耐药性的机制是目前研究的一个主要焦点[26-28]。SPINELLI 等[29]发现乳腺癌细胞主要通过GLUD 催化的还原性氨化反应吸收氨,氨的代谢循环加速可以促进乳腺癌细胞增殖;在小鼠中,GLUD可以利用肿瘤微环境中积累的氨用于产生氨基酸。FARRIS 等[30]报道了GLUD1 在上皮-间质转化(epithelial-mesenchymal transition,EMT)的乳腺癌细胞中的表达上调,当细胞在葡萄糖匮乏的环境时,谷氨酰氨或谷氨酸可作为替代碳源使用,以及通过增加α-KG 减少ROS 诱导的线粒体损伤而增加氧化磷酸化能力,从而抵抗细胞凋亡。这表明GLUD1 在连接碳循环和氮循环方面有重要意义,且GLUD1 在乳腺癌细胞中也会促进耐受低葡萄糖能力和抵抗凋亡的能力。
2.5 结直肠癌
结直肠癌是全球第三大最常见的恶性肿瘤,总体发病率约为5%,5年生存率为40%~60%[31]。根据我国2020 年癌症统计报告,结直肠癌发病率、死亡率在所有恶性肿瘤中分别位居第2 位和第5 位,由于结直肠癌患者早期症状不明显且诊断准确率低,所以多数患者在确诊时已属于中晚期[32]。大多数结直肠癌是从异常的腺窝演变为肿瘤前体病变(息肉),并最终发展为结直肠癌,目前的治疗方案包括内镜和手术局部切除,术前降期放疗和全身治疗,局部和转移性的进行广泛手术,转移灶的局部消融治疗以及姑息性化疗、靶向治疗和免疫治疗[33]。HU 等[34]发现在缺氧条件下,组蛋白乙酰转移酶(p300)可募集GLUD1,促进GLUD1在K503和K527位点同时发生乙酰化,GLUD1在K527 位点的乙酰化可促使GLUD1 锚定脯氨酸羟基化酶(EGLN1)/缺氧诱导因子1α(HIF1α)复合物;而GLUD1 在K503 位点的乙酰化可促使GLUD1 利用α-KG 作为底物产生谷氨酸,降低了EGLN1/HIF1α复合物周围/内部的α-KG 浓度或损害了EGLN1 结合α-KG 的能力,这两种作用都稳定了HIF1α,从而使结直肠癌细胞耐受缺氧。WANG 等[35]研究发现过表达NAD+依赖性蛋白质赖氨酸去酰基酶(SIRT5),可导致GLUD1的K545去戊二酰化激活,GLUD1以去谷氨酰化依赖的方式促进谷氨酰氨合成代谢,从而促进细胞增殖、存活和异种移植肿瘤生长。MIYO等[36]报道GLUD1在结直肠癌细胞系DLD1中的表达显著升高,且DLD1对葡萄糖剥夺有较强的抵抗能力;敲减DLD1 细胞中的GLUD1后,其在葡萄糖剥夺条件下的增殖速度被显著抑制;而上调GLUD1 和SLC25A13(SLC25A13 编码线粒体天冬氨酸-谷氨酸载体)可以适应营养应激,保留三羧酸循环活性,有助于肿瘤侵袭,导致更差的预后。该研究结果与LIU 等[37]关于过表达GLUD1 促进了体外细胞增殖、迁移和侵袭的结论一致。以上研究表明,在结直肠癌细胞中,GLUD1 可以稳定HIF1α 适应缺氧应激,也可以促进谷氨酰胺合成代谢以促进肿瘤进展,还增强代谢适应低葡萄糖应激。
2.6 肝癌
肝癌是指发生于肝脏或从肝脏开始的恶性肿瘤。通过发病部位的不同分为原发性肝癌和转移性肝癌。原发性肝癌还可以细分,主要包括肝细胞癌、肝内胆管癌和混合型肝细胞癌-胆管癌[38]。在我国,肝细胞癌是常见的恶性肿瘤,在上述三种类型中肝细胞癌占75%~85%,起病隐匿,易转移,5 年生存率低,由于缺乏早期症状的诊断技术,大部分患者确诊已是中晚期[39]。目前,肝癌的现有治疗方法包括手术、器官移植和终末期患者特别是原发性肝癌患者的抗癌药物治疗[40]。MARSICO 等[41]研究发现,在肝癌细胞系HepG2 中沉默GLUD1,其增殖效率降低,激活了含半胱氨酸的天冬氨酸蛋白水解酶3/7(cysteine aspartatespecific proteases 3/7,caspases 3/7),并且有明显的核形态学变化,B淋巴细胞瘤-2(B-cell lymphoma-2,BCL2)mRNA 水平下降,线粒体膜电位明显降低。沉默GLUD1基因影响了HepG2 的氧化还原稳态并导致线粒体凋亡,这表明抑制GLUD1活性可以损害肝细胞癌细胞代谢重编程。ZHOU等[39]发现在葡萄糖充足的情况下,谷氨酸-草酰乙酸转氨酶1(glutamic-oxaloacetic transaminase 1,GOT1)介导的生化途径对肝细胞癌细胞的生长起主导作用,但在葡萄糖缺乏的情况下,GOT1的活性受到抑制,而GLUD1 介导的酶促反应被激活从而驱动三羧酸循环。该研究还报道,在低血糖的肝细胞癌组织中,GLUD1 和GOT1 的表达水平存在潜在的负相关,在葡萄糖剥夺下GOT1-GLUD1活性调控机制可能与肿瘤细胞在体内存活有关。上述研究表明,在肝癌细胞中GLUD1 的沉默会影响氧化还原稳态导致线粒体凋亡;当肝癌细胞面临低葡萄糖应激时,GLUD1 会驱动三羧酸循环适应低葡萄糖环境。
2.7 肾癌
肾癌起源于肾小管上皮细胞,可发生于肾实质的任何部位,是最常见的泌尿生殖系统恶性肿瘤,约占所有癌症的2.2%,且发病率持续上升[42]。肾癌早期症状不明显,一般只有在癌变组织变得较大或者转移后,才有较明显的症状,而且20%~40%的患者术后出现复发转移[43]。同时,肾癌对常规放化疗不敏感,但是目前的研究表明靶向药物能使晚期肾癌患者获得明显的临床获益,给患者带来了新的希望[44]。SHAO等[45]发现GLUD1缺失后可赋予肾透明细胞癌细胞对氨基酸剥夺的抗性;在营养充足的条件下,GLUD1 以依赖于其酶活性的方式维持驱动核糖体蛋白基因的表达。在氨基酸剥夺导致雷帕霉素靶蛋白抑制后,GLUD1 从线粒体转运到细胞质,通过E3 连接酶RNF213 降解,因为GLUD1 的降解,细胞内α-KG 水平降低一半以上,并降低α-KG 依赖性赖氨酸去甲基化酶(lysine demethylases ,KDMs)的活性。KDMs活性降低可导致组蛋白H3赖氨酸第9和27位点甲基化增加,进一步抑制RP基因的表达并保存营养以支持细胞存活,避免了在特殊时期过度消耗ATP和营养物。该研究表明,当肾癌细胞面临氨基酸剥夺时,GLUD1 从核糖体转运到胞质并被降解,进而抑制核糖体蛋白基因的表达以保存营养促进存活。
3 GLUD1抑制剂的应用
3.1 R162
R162是一种对GLUD1具有高效力和选择性的嘌呤类似物,是GLUD1 的抑制剂,在体内和体外都可以抑制GLUD1 而减缓肿瘤进展,且对人正常增殖细胞无明显作用,同时能与其他抗癌药物联用增强抗癌效果。JIN 等[46]研究表明,R162 可直接与GLUD1 结合并抑制GLUD1 活性,R162 处理可导致肺癌细胞系H1299 和乳腺癌细胞系MDA-MB-231 胞内的延胡索酸水平降低,谷胱甘肽过氧化物酶(GPx)活性减弱,ROS水平升高,破坏氧化还原平衡,细胞增殖减少,回补α-KG或添加抗氧化剂N-乙酰半胱氨酸可以显著挽救细胞增殖,而且这些数据与在GLUD1 敲减细胞中观察到的表型基本一致。该研究还发现,R162 在人类正常增殖细胞中没有作用,包括人类角化细胞(Ha-CaT)、人类胎儿肺成纤维细胞(MRC-5)和人类包皮成纤维细胞(HFF);R162 抑制GLUD1 使原发性白血病细胞活力下降,但不影响健康人类供者外周血样本中单核细胞的细胞活力。这些数据表明,R162 在人类癌细胞中具有抗增殖潜力和最小的毒性,保证了对人正常增殖细胞的安全性。同时,该研究还测试了R162 在小鼠异种移植瘤模型的体内治疗效果,通过使用肺癌细胞系H1299 异种移植裸鼠进行体内R162 处理,发现R162 治疗显著减缓了小鼠肿瘤生长。POLAT 等[47]使用R162 处理模拟谷氨酰氨剥夺,发现可引起NRF2 蛋白水平提高,其结果与谷氨酰氨剥夺效果类似。ZHU 等[48]研究表明,使用R162 可抑制人宫颈癌细胞株SiHa 和CaSki 增殖并促进细胞凋亡。SHI 等[49]发现在抗癌药物羧酰氨三唑(CAI)处理的同时,用抑制剂R162 抑制GLUD1,或敲除结直肠癌细胞系HCT116 和C26 细胞中GLUD1 的表达,都会大幅增加细胞凋亡,单独使用CAI 或R162 可轻微增加细胞内ROS 的生成,而联合使用则使ROS 生成明显增加。该研究还在BALB/c 小鼠中注射C26 细胞,并在裸鼠中注射HCT116 细胞建立了异种移植肿瘤模型,同样显示单独使用CAI 或R162 均能在一定程度上轻微抑制肿瘤生长,而且CAI 与R162 联合治疗可增加肿瘤微环境中细胞毒性CD8+T细胞的比例。
3.2 EGCG
EGCG(epigallocatechin-3-gallate)是绿茶中含量最高、活性最强的茶多酚单体,是绿茶中主要的活性和水溶性成分,具有很强的抗氧化活性、抗肿瘤能力和抗血管生成能力。EGCG 也是GLUD1 的一种抑制剂,可以抑制肿瘤细胞的生长、侵袭、迁移,促进肿瘤细胞凋亡。在胶质母细胞瘤细胞中,YANG 等[50]发现EGCG 处理后GLUD1 水平明显下调,EGCG 使葡萄糖剥夺细胞的谷氨酸脱氢酶活性减弱,促进细胞死亡,而α-KG的回补可挽救细胞活力,促进细胞存活。该研究还测试了在葡萄糖存在下,使用EGCG和限制葡萄糖拟似物2-脱氧葡萄糖(2-DG)共同处理,结果发现EGCG的加入增强了2-DG 的促细胞死亡能力。PEETERS等[51]发现EGCG 对HCT116 野生型和HCT116 IDH1-R132H 突变细胞系的生长均有抑制作用;在高剂量的EGCG 下,EGCG 可增强HCT116 IDH1-R132H 细胞对放疗的敏感性。也有研究[52]报道了EGCG对乳头状甲状腺癌细胞FB-2和WRO的生长具有剂量依赖性抑制作用。该研究发现EGCG处理可导致细胞运动和迁移减少,E-cadherin表达增加,而且显著增加p53蛋白和mRNA水平;EGCG 通过抑制MMPs 的活性,阻止肿瘤细胞向邻近组织迁移,从而增加细胞与细胞之间的黏附。JIN等[53]通过体外和体内的研究表明,EGCG 可抑制结直肠癌细胞增殖,诱导细胞凋亡。该研究报道经EGCG处理后,重要的促癌基因HES1和Notch2的表达明显受到抑制,说明EGCG可能通过抑制HES1和Notch2进而抑制结直肠癌。TANG 等[54]发现EGCG 可抑制STAT3 的表达和激活,增强Caspase-3 的活性,此外EGCG 还能抑制胰腺癌细胞的侵袭和迁移,也可抑制STAT3下游基因的表达,这些基因包括VEGF、CCND1和c-Myc等。TSANG等[55]报道了EGCG 处理肝癌HepG2细胞可诱导miR-16,并下调靶基因Bcl-2的表达,从而促进HepG2细胞凋亡。以上研究说明,EGCG对GLUD1在蛋白和mRNA层面均具有调控作用,其作用机制需要进一步深入研究,但是EGCG对肿瘤细胞的遏制作用已经得到广泛认可。
4 小结与展望
GLUD1作为管家基因在肿瘤细胞中普遍表达并且展现了在肿瘤应激方面的多面性。当肿瘤细胞面临葡萄糖匮乏、低氨基酸和缺氧等环境压力时,GLUD1 会通过各种机制缓解应激带来的生存压力,促进肿瘤细胞的存活。GLUD1 抑制剂在单独处理肿瘤细胞时,往往能抑制其增殖能力,在体内和体外的联合用药实验中也都表现出较好的杀伤效果。因此,GLUD1 有望成为促癌标志物,GLUD1 抑制剂也有望成为新的治疗靶点。GLUD1 是一个在众多生物化学反应中发挥核心作用的关键酶,尽管其在肿瘤生物化学中的酶学特性已经得到了一定程度的研究,但其在肿瘤细胞中调控网络的复杂性和精细性的理解仍有待深入。今后进一步挖掘和阐明GLUD1 在肿瘤细胞内的具体作用机制以及其与其他信号通路的交互影响,将可能揭示其在肿瘤生物学中所扮演的全新角色,从而提供新的治疗靶点。同时,结合现有的临床治疗手段,还需要深入研究GLUD1 在肿瘤细胞面对应激生存过程中的作用机制,以期发掘新的策略,抵御和治疗多种类型癌症。这不仅能帮助我们深入理解肿瘤的复杂生物学特性,也可能为我们提供创新且更为高效的治疗方案,从而提升癌症患者的生存预期,并改善他们的生活质量。

