囊状幼虫病病毒衣壳蛋白肝素结合基序鉴定及其抗感染作用分析
沈克飞,曹兰,徐登峰,许国洋,杨金龙,罗文华
重庆市畜牧科学院,重庆 402460
囊状幼虫病病毒(sacbrood virus,SBV)是危害蜜蜂健康的昆虫小RNA 样病毒(picorna-like virus),在全球普遍流行[1-4]。SBV最早发现并流行于西方蜜蜂(Apis mellifera)中,1972年首先在我国广东引发中华蜜蜂(A.c.cerana)暴发囊状幼虫病,并迅速传播至全国其他地区[5]。SBV主要危害蜜蜂幼虫,导致幼虫代谢紊乱和组织损伤,甚至不能发育成蛹而死亡[6],富含SBV颗粒的脱皮液集聚在未脱落的幼虫皮肤下,形成囊状。
SBV 整个基因组只有1 个开放阅读框架(open reading frame,ORF),编码1条多聚蛋白(polyprotein)。多聚蛋白在病毒编码的蛋白酶作用下,氨基端剪切、加工产生成熟的衣壳蛋白,组装成病毒颗粒[5]。SBV无囊膜,衣壳蛋白暴露于病毒表面,是与宿主发生相互作用的主要病毒成分[7]。SBV衣壳蛋白含有小RNA病毒衣壳蛋白药物结合口袋(drug-binding pocket)结构域(domain)[8]。
氨基葡聚糖(glycosaminoglycan,GAG)是病原体的主要靶点,病原体几乎在所有感染和发病过程中均使用GAG 来促进黏附和侵入宿主细胞[9-12]。GAG是包含肝素在内的一类阴离子线性多糖,普遍存在于动物细胞表面[11]。病原体与GAG结合主要涉及病原体表面蛋白柔性环上的R 和K 及与其临近的疏水性氨基酸,柔性环上带正电荷的碱性氨基酸簇与带负电荷的GAG 通过形成离子键而结合,柔性环上与碱性氨基酸临近的疏水性氨基酸侧链和糖链上非极性基团间的相互作用有助于维持结合的稳定性[13-15]。阻断病原体结合GAG 可能阻断感染发生。目前对SBV-GAG 相互作用的认识有限,防治囊状幼虫病的有效手段也很有限。阐明SBV-GAG 相互作用,对于基于此作用开发治疗药物具有重要意义。
本研究旨在鉴定SBV 药物结合口袋蛋白2(drugbinding pocket protein 2,Dbpp2)的肝素结合基序(heparin-binding motif),并测定该基序肽及其衍生肽的抗SBV 感染活性,以期为阐明SBV-GAG 相互作用奠定基础及基于此相互作用开发治疗SBV 感染的多肽提供参考。
1 材料与方法
1.1 病毒、菌株及质粒 SBV样品[8]和大肠埃希菌K88菌株由重庆市畜牧科学院兽医兽药研究所提供;表达载体pGEX-4T-1 和大肠埃希菌BL21(DE3)由生工生物工程(上海)股份有限公司提供。
1.2 主要试剂及仪器 肝素琼脂糖珠购自北京索莱宝科技有限公司;肝素和弗氏佐剂购自美国Sigma-Aldrich 公司;碱性磷酸酶标记的山羊抗小鼠IgG 抗体购自美国EarthOx 公司;硝酸纤维素膜购自德国Merck Milli-pore 公司;Gluthathione-Sepharose 4B 和还原性谷胱甘肽购自美国GE Healthcare公司;Quick Start Bradford 购自伯乐生命医学产品(上海)有限公司;BCIP/NBT 购自生工生物工程(上海)股份有限公司;由L 型氨基酸组成的肝素结合基序及其衍生肽由无锡迈默拓普生物科技有限公司采用化学法合成(纯度大于95%)。
1.3 实验动物 SPF 级昆明小鼠,雌性,6 ~ 8 周龄,体质量约为25 g,购自北京华阜康生物科技股份有限公司,动物合格证号:SCXK(京)2019-0008;健康伊普吕兔,雌性,60 日龄,体质量约2 kg,购自重庆某规模化兔场;中蜂蜂群为重庆市畜牧科学院自养蜂群。本实验均以科研为目的对实验动物进行养殖和使用,且按照重庆市畜牧科学院实验动物伦理委员会动物伦理相关规定进行(cqaa2022063)。
1.4 序列分析 以SBV-CQ(GenBank登录号:KJ716806)为参考毒株[7],药物结合口袋结构域及其两翼(398~702 位氨基酸)序列作为研究靶标,命名为Dbpp2。使用在线软件对序列进行二级结构预测(http://www.detaibio.com/tools/chou-fasman-forecast.html)和同源建模(https://www.expasy.org/resources/swissmodel),搜索位于蛋白质空间构象表面的柔性环,查找碱性氨基酸及与其临近的疏水性氨基酸,以搜索肝素结合基序。
1.5 重组蛋白及其抗血清的制备 将肝素结合基序KPANRPRR 中的氨基酸进行替换,设计Dbpp2 的突变体Dbpp21(R290G)、Dbpp22(R290G + R292G)、Dbpp23(R290G+R292G+R293G)和Dbpp24(N289R)。根据大肠埃希菌密码子偏好性优化Dbpp2 及其突变体的编码基因。在基因的5'和3'端分别加入BamHⅠ和XhoⅠ限制性内切酶识别位点。采用化学合成法合成基因,通过BamHⅠ和XhoⅠ限制性内切酶识别位点将基因克隆至pGEX-4T-1,构建重组质粒,将重组质粒转化至大肠埃希菌BL21(DE3),构建重组菌株。基因合成、重组质粒和重组菌株的构建均由生工生物工程(上海)股份有限公司完成。将重组菌株接种于LB培养基中,37 ℃振摇培养至菌体浓度(A600)约为1时,加入终浓度为0.1 mmol/L的IPTG,37 ℃诱导表达3h;培养物4 ℃,5 000×g离心10 min,收集菌体沉淀,每100 mL 培养液加入20 mL PBS(0.1 mol/L,pH 7.2),悬浮菌体,冰水浴中超声(超声功率为300 W,工作4 s,间歇5 s)破碎15 min;加入终浓度1% Trition X-100,4℃垂直旋转孵育30 min;5 000 ×g离心30 min,收集上清,每20 mL加入300 μL Gluthathione-Sepharose 4B,4 ℃垂直旋转孵育1h;PBS洗涤3次后,用10 mmol/L 还原型谷胱甘肽洗脱。将纯化的重组蛋白Dbpp2免疫小鼠制备抗血清,按文献[16]方法操作。使用Tris-HCl(0.02 mol/L,pH 8.0)对纯化的重组蛋白进行透析,采用Bradford法测定蛋白浓度。
1.6 SBV 提取 取出-80 ℃保存的SBV 感染的病死幼虫样品,加入5 倍体积的Tris-HCl(0.02 mol/L,pH 8.0)或PBS(0.01 mol/L,pH 7.2~7.4),充分研磨;加入1/2 体积氯仿,充分振荡;4 ℃,12 000 ×g离心10 min,取上清,用1/2 体积氯仿重复处理,直至上清澄清。
1.7 SBV 与肝素的结合能力检测 取肝素琼脂糖珠混悬液,用预冷的Tris-HCl溶液洗涤3次,用Tris-HCl溶液溶解肝素。将不同浓度肝素(152 μL)分别与肝素琼脂糖珠(10 μL)、Tris-HCl-氯仿抽提的病毒(18 μL)一起加入1.5 mL离心管中,混匀,肝素浓度依次为0、10、30、90 mg/mL,4 ℃缓慢垂直旋转孵育1 h;4 ℃,3 000×g离心5 min,肝素琼脂糖珠沉淀用200 μL 预冷Tris-HCl 溶液洗涤3 次,加入上样缓冲液,沸水浴10 min。样品经12%SDS-PAGE 分离后,电转移至硝酸纤维素膜上,用5%脱脂奶粉室温封闭2 h;TBST洗涤3 次,加入小鼠抗Dbpp2 抗血清(1∶500 稀释),室温孵育1 h;TBST 洗涤3 次,加入碱性磷酸酶标记的山羊抗小鼠IgG(1∶4 000 稀释),室温孵育1 h;TBST洗涤3次,在BCIP/NBT溶液中显色。
1.8 Dbpp2与肝素的结合能力检测 将肝素琼脂糖珠(30 μL)、Dbpp2(0.3 mg/mL,30 μL)及不同浓度的肝素溶液(150 μL)一起加入1.5 mL离心管中,充分混匀,肝素浓度依次为0、10、20、30、40、50、60、70 mg/mL,4 ℃缓慢垂直旋转孵育1 h;4 ℃,3 000×g离心5 min,肝素琼脂糖珠沉淀用200 μL 预冷Tris-HCl 溶液洗涤3次,加入上样缓冲液,沸水浴10 min,12%SDS-PAGE分析Dbpp2与肝素的结合能力。
1.9 肝素结合基序鉴定 将30 μL 肝素琼脂糖珠与1 mg/mL Dbpp2 或Dbpp2 突变体混合,4 ℃缓慢垂直旋转孵育1 h;4 ℃,3 000×g离心5 min,肝素琼脂糖珠沉淀用200 μL预冷Tris-HCl溶液洗涤3次,加入上样缓冲液,沸水浴10 min,12%SDS-PAGE分析Dbpp2突变体与肝素结合能力。
1.10 肝素结合基序对Dbpp2结合肝素能力的抑制作用检测 将肝素琼脂糖珠(30 μL)、Dbpp2(0.3 mg/mL,30 μL)及不同浓度的肝素结合基序溶液(30 μL)一起加入1.5 mL离心管中,充分混匀,肝素结合基序多肽浓度依次为1×10-3、1×10-2、1×10-1、1×100mmol/L,4 ℃缓慢垂直旋转孵育1 h;4 ℃,3 000×g离心5 min,肝素琼脂糖珠沉淀用200 μL 预冷Tris-HCl 溶液洗涤3次,加入上样缓冲液,沸水浴10 min,12%SDS-PAGE分析多肽抑制Dbpp2结合肝素的能力。
1.11 多肽溶血活性测定 采用EDTA真空采血管通过心脏穿刺法采集伊普吕兔血液3 mL,1 000×g离心15 min,弃去上层血浆和白细胞,下层红细胞加入PBS充分混匀,1 000×g离心15 min,弃上清。如此重复3 次后,用PBS 配制成体积分数为2%的兔红细胞混悬液,置于4 ℃备用。用PBS溶解肝素结合基序及其衍生肽,配制成1 mmol/L溶液,倍比稀释(20~2-10)。将50 μL不同浓度的多肽溶液与50 μL兔红细胞悬液在微量凝集板孔中混匀,37 ℃静置30 min,观察多肽的溶血活性。
1.12 多肽抑菌活性测定 用PBS 溶解肝素结合基序KPANRPRR及其衍生肽KPAARPRR、KPRNRPRR、KPRARPRR、KPRWRPRR、KPRWRPRRW,配制成1 mmol/L溶液。将灭菌的营养琼脂倒入平皿,待凝固后将牛津杯(直径为8 mm)立于其上,再向平皿倒入含1 × 106CFU/mL 大肠埃希菌K88 菌株的营养琼脂,待凝固后取出牛津杯,将多肽溶液分别加入孔中,200 μL/孔,4 ℃扩散1 h;再37 ℃培养16~18 h,观察抑菌圈直径大小。
1.13 多肽抗感染作用测定 攻毒前测定蜂群幼虫死亡率[17]:攻毒前18 d 用透明薄膜(30 cm × 50 cm)对仔脾上有幼虫或卵的巢房进行定位、标记和计数,数量记为A;9 d 后将标记的薄膜对准位置贴在原来的巢脾上,查看标记的巢房是否封盖、封盖是否有穿孔,将未封盖或封盖有穿孔的巢房用另一种颜色标记和计数,数量记为B;计算蜂群幼虫死亡率(B/A×100%)。选择群势相当、幼虫死亡率小于5%的蜂群用作攻毒蜂群和健康对照蜂群。取5 mL经0.22 μm微孔滤膜过滤的PBS-氯仿抽提的SBV 溶液,加入1 000 mL 糖水(按白砂糖与水质量比1∶1.2配制)中,充分混匀,即为病毒液。将病毒液在傍晚时分喷洒于攻毒蜂群巢脾双面,每巢脾50 mL,连续喷洒病毒液3 d。于攻毒后第9 天计算幼虫死亡率,发病蜂群用于肝素结合基序及其衍生肽的抗感染检测。每个多肽随机分配3群蜂,每群蜂五足框。于检查当日傍晚给蜂群饲喂含1 mg/L 多肽的糖水,健康对照组和不给药对照组饲喂糖水,每群每次饲喂200 mL,隔日饲喂1次,连续9 次。第1 次给药后第18 天计算蜂群幼虫死亡率及蜂群幼虫死亡降低率。

1.14 统计学分析 应用SPSS 20.0 软件中单因素方差分析进行数据统计分析,以P< 0.05 为差异有统计学意义。
2 结果
2.1 序列分析 Dbpp2 共有22R 和13K,R 和K 碱性氨基酸含量为11.5%(35/305)(图1A)。根据二级结构预测及同源建模结果,Dbpp2的C-端存在1个暴露在表面的富含碱性氨基酸的柔性环,环内分布着与碱性氨基酸临近的疏水性氨基酸,可能是肝素结合基序(图1B)。其他SBV毒株也存在该基序。

图1 Dbpp2 GAG结合基序预测Fig.1 Prediction of GAG-binding motifs in Dbpp2
2.2 SBV与肝素的结合能力 在90 mg/mL范围内,随着肝素浓度的增加,SBV 与肝素琼脂糖珠的结合量呈下降趋势,呈良好的剂量依赖关系,见图2。

图2 肝素对SBV结合肝素琼脂糖珠的抑制作用Fig.2 Inhibitory effect of heparin on SBV binding to heparin agarose beads
2.3 Dbpp2与肝素的结合能力 随着肝素浓度从0提高至70 mg/mL,肝素琼脂糖珠结合的Dbpp2 量逐渐下降,见图3。

图3 Dbpp2结合肝素分析Fig.3 Analysis of Dbpp2 binding to heparin
2.4 肝素结合基序鉴定 相对于Dbpp2,突变体与肝素的结合能力发生了变化。影响Dbpp2 与肝素结合能力的氨基酸残基有R290、R292、R293,将其替换成G 会导致Dbpp2 与肝素的结合能力降低;将N289 替换成R提高了Dbpp2与肝素的结合能力。见图4。表明KPANRPRR 是Dbpp2 结合肝素的关键基序,基序中的R在Dbpp2结合肝素上发挥了关键作用。
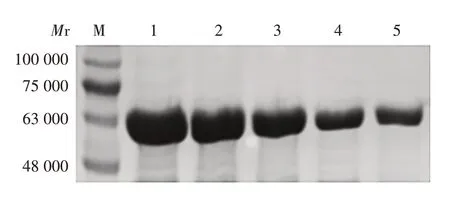
图4 Dbpp2及其突变体与肝素的结合能力分析Fig.4 Analysis of binding ability of Dbpp2 and its mutants to heparin
2.5 肝素结合基序对Dbpp2结合肝素能力的抑制作用 随着KPANRPRR 浓度从1 × 10-3mmol/L 提高至1 × 100mmol/L,肝素琼脂糖珠结合的Dbpp2 量逐渐下降,见图5。表明KPANRPRR 能抑制Dbpp2结合肝素。
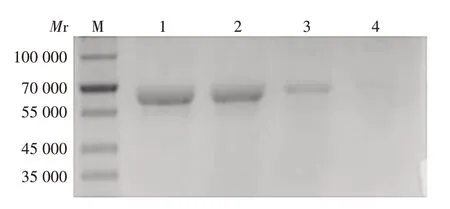
图5 肝素结合基序抑制Dbpp2结合肝素的能力Fig.5 Heparin-binding motif inhibiting ability of Dbpp2 binding to heparin
2.6 肝素结合基序及其衍生肽的溶血活性 肝素结合基序KPANRPRR 及其衍生肽KPAARPRR、KPRNRPRR、KPRARPRR、KPRWRPRR、KPRWRPRRW 均有溶血活性,见图6。
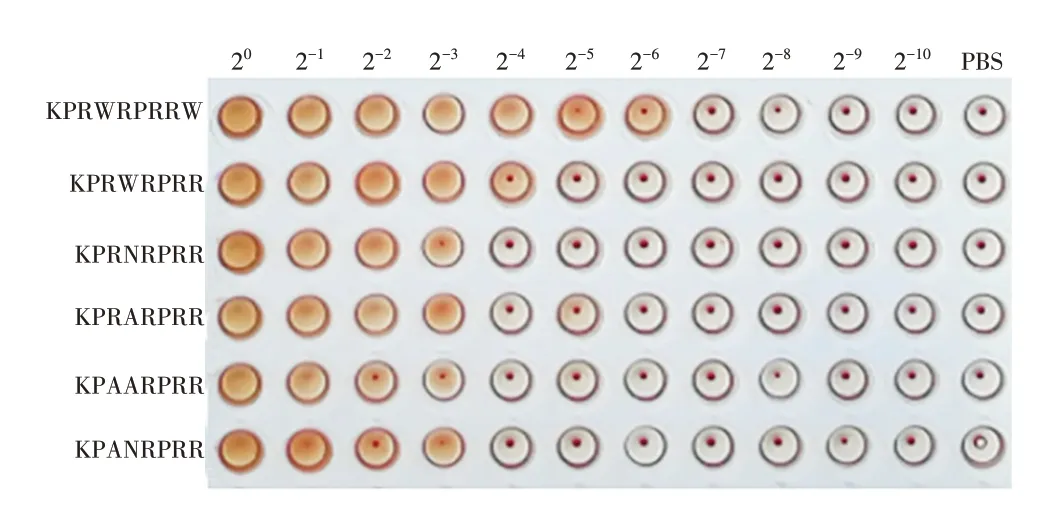
图6 多肽溶血活性测定Fig.6 Determination of peptide hemolytic activity
2.7 肝素结合基序及其衍生肽的抑菌活性 除KPANRPRR 无明显抑菌活性外,其他多肽均有抑菌活性,抑菌活性由小到大依次为KPAARPRR、KPRNRPRR、KPRARPRR、KPRWRPRR、KPRWRPRRW,见图7。

图7 多肽抑菌活性测定Fig.7 Determination of antibacterial activity of peptides
2.8 肝素结合基序及其衍生肽的抗感染作用 攻毒后第9 天,健康蜂群的病情指数等级无改变,攻毒蜂群发病。在18 d 给药过程中,健康蜂群和不给药蜂群的病情指数等级无改变。经18 d 的治疗处理,多肽给药组蜂群幼虫死亡率较不给药组显著降低(P均< 0.01),KPRARPRR 给药组幼虫死亡降低率为65.40%。见表1。表明KPRARPRR 对中蜂囊状幼虫治疗效果最好。

表1 多肽对SBV感染中蜂幼虫死亡率的影响(%)Tab.1 Effect of peptides on mortality of A.c.cerana larvae infected with SBV(%)
3 讨论
SBV衣壳由主要衣壳蛋白VP1、VP2和VP3组成,衣壳蛋白可根据相对分子质量大小从最大亚基VP1到最小亚基VP4 进行命名,也可根据衣壳蛋白与小RNA 病毒蛋白的同源性进行命名,但各衣壳蛋白在多聚蛋白中的精确氨基酸剪切位点目前仍存在争议[5,18]。SBV 病毒粒子的晶体学研究指出,SBV 衣壳蛋白N-端位于衣壳内部,C-端暴露在病毒表面;病毒粒子表面还附着包含60个拷贝的小衣壳蛋白(minor capsid protein,MiCP)[18]。MiCP通过引入病毒蛋白酶的剪切位点而从相对分子质量最大的衣壳蛋白VP3的C-端外侧剪切而来,多聚蛋白的Q428~S708区域为衣壳蛋白VP3,S708 ~ Q756 区域为MiCP[18],这两个区域对应于SBV-CQ 部分多聚蛋白的408~688 和689 ~ 719 位氨基酸区域。VP3 的C-端和MiCP 位于病毒表面,可能参与SBV 受体识别。对应于SBV-CQ部分多聚蛋白的429 ~ 739 位氨基酸区域被证实与宿主细胞热休克蛋白70 同源物5(heat shock protein 70 cognate 5,Hsp70-c5)存在相互作用[7]。本研究以Dbpp2(即SBV-CQ 部分多聚蛋白的398~702位氨基酸区域)为研究对象,根据二级结构预测及同源建模结果,Dbpp2的C-端存在1个暴露在表面的富含碱性氨基酸的柔性环(KPANRPRR),环内分布着与碱性氨基酸临近的疏水性氨基酸,提示该环可能是GAG黏附基序。
GAG 包含多种分子,在动物组织内的分布存在差异[19],病原体可能利用一种GAG 分子作为黏附受体而实现感染[10]。肝素琼脂糖珠是一种可方便购买的商品化试剂,其最常用的上样缓冲液和平衡缓冲液为Tris-HCl(pH 8.0)缓冲液。为利用肝素琼脂糖珠检测SBV、Dbpp2与肝素结合的能力,先用Tris-HCl(pH 8.0)缓冲液浸取病死幼虫样品中的SBV,或用Tris-HCl(pH 8.0)缓冲液对纯化的重组蛋白进行透析处理,以避免样品中的离子对肝素结合产生干扰。SBV为无囊膜病毒,氯仿对其活性无影响[20]。本研究结果显示,SBV、Dbpp2可结合肝素,Dbpp2柔性环(KPANRPRR)上的R290、R292、R293 对Dbpp2 结合肝素具有重要作用,KPANRPRR是Dbpp2的肝素结合基序。
在过去的10 多年间,SBV 在重庆等地流行导致中蜂发病[17,21],给蜂业健康发展和蜂农经济效益造成损失。尽管已通过更换蜂王、RNAi、药用植物提取物等防治SBV 感染,但这些方法仍有局限性,制剂未实现产业化[22]。具有生物活性和安全特性的多肽能有效治疗SBV 感染,为保障蜜蜂健康提供了可供选择的治疗措施[17]。病原体通过结合GAG 而促进黏附宿主细胞已被证明,针对病原体GAG 的相互作用开发阻断病原体侵入细胞的预防和治疗药物是一个新的研究领域,抗菌肽(antibacterial peptide)和抗病毒肽(antiviral peptides)是其中的重要方向[23-26]。本研究结果表明,肝素结合基序KPANRPRR 能剂量依赖性地抑制Dbpp2 结合肝素,KPANRPRR 与抗菌肽、抗病毒肽类似,具有膜干扰活性。阳离子抗菌肽或抗病毒肽富含疏水氨基酸和碱性氨基酸,对抗微生物活性特别重要的是K、R,这些氨基酸也普遍存在于有膜干扰活性的蛋白质或肽中,这类分子可自发穿过脂质膜[27-28]。据此,本研究对KPANRPRR 进行氨基酸残基替换或添加,观察到KPANRPRR 及其衍生肽的体外抑菌活性与溶血活性呈正相关,可见多肽抑菌活性与膜干扰活性呈正相关。肽的膜干扰活性与肽-脂质膜的相互作用有关。肽通过多种机制吸附在脂质膜上或插入脂质膜,或促进膜溶解、渗透,或附着在较大的膜蛋白上,或自聚集而形成孔[27]。多肽抗病毒感染机制与多肽抗菌机制不同,多肽抗病毒感染主要通过与宿主细胞受体相互作用以阻止病毒黏附或侵入宿主细胞[25,29]。因此,在抗病毒感染多肽研究中尤其需要考虑多肽对宿主细胞膜的损伤作用。将KPANRPRR 中的A3 替换成R,N4 替换成A、W,可见衍生肽的溶血活性提高。表明多肽膜干扰活性与多肽碱性氨基酸、含大侧链基团的疏水性氨基酸的组成有关。在治疗SBV 感染的中蜂幼虫试验中,溶血活性居中的KPRARPRR 相对于其他多肽治疗效果最佳。提示抗病毒多肽研究需特别关注多肽的氨基酸组成设计及其膜损伤能力。本研究基于SBV 肝素结合基序设计衍生肽,筛选出有更高抗感染效果的多肽,为利用SBV-GAG 相互作用设计筛选有潜在防治价值的多肽提供了参考。

