达乌里胡枝子根瘤菌的促生作用及高效根瘤菌的鉴定






摘要:本研究选择达乌里胡枝子(Lespedeza daurica)根瘤分离且结瘤效果较好的7株根瘤菌(TG64,TG97,TG98,TG100,TG101,TG105和TG115),通过测定达乌里胡枝子生长表型和主要营养成分,结合结瘤和光合特性初步分析促生的生理生化机制,研究不同根瘤菌的促生作用;通过分子生物学、形态学和生理生化特性鉴定高效根瘤菌。结果表明:除TG64,其余菌株显著提高了株高、根长、生物量和蛋白质含量,改善了根系构建,TG101促生最明显。所有处理单株结瘤5~33个,根瘤干重2.55~35.87 mg;TG98,TG100,TG101和TG115显著提高了叶绿素含量、光合和氮吸收能力,是促生的主要生理生化机制。经鉴定,TG101为格木慢生根瘤菌(Bradyrhizobium erythrophlei)。综上,根瘤菌通过改善植株氮营养促进叶绿素合成、增强光系统活性,提高光合能力,进而促进干物质积累调控生长。其中TG101为高效根瘤菌,为后续研发适用黄土高原的达乌里胡枝子根瘤菌剂提供了菌种资源和理论依据。
关键词:达乌里胡枝子;根瘤菌;筛选;鉴定
中图分类号:S813.9""" 文献标识码:A"""" 文章编号:1007-0435(2024)06-1819-13
Promoting-growth Effect of Rhizobia from Lespedeza davurica
and Identification of Efficient Rhizobium
ZHONG Hua1,2,3#, YANG Kai-yuan1,2,3#, QIN Yun-meng1, GAO Peng1,2,3,
HUANG Chen1,2,3, JIANG Lin1,2,3, ZHAO Xiang1,2,3*
(1.College of Grassland Science, Shanxi Agricultural University, Taigu, Shanxi Province 030801, China; 2 Key Laboratory of Model
Innovation in Forage Production Efficiency, Ministry of Agriculture and Rural Affairs, Taigu, Shanxi Province 030801, China; 3 Shanxi
Key Laboratory of Grassland Ecological Protection and Native Grass Germplasm Innovation, Taigu, Shanxi Province 030801, China)
Abstract:In this study,seven rhizobium strains (TG64,TG97,TG98,TG100,TG101,TG105 and TG115) isolated from nodules of Lespedeza daurica with good nodulation effect were selected. By measuring the growth phenotype and main nutritional components of L. davurica,combined with nodulation and photosynthetic characteristics,the physiological and biochemical mechanisms of growth promotion were preliminarily analyzed,and the growth promotion effects of different rhizobia were explored. Finally,the efficient rhizobium was identified by molecular biology,morphology and physiological and biochemical characteristics. The results showed that except for TG64,the other strains significantly increased the plant height,root length,biomass and protein content,and significantly improved the root construction of the plant. Among them,the promoting-growth effect of TG101 was the best. All strains were nodulated after inoculation,the number of nodules was 5-33 per plant,and the dry weight of nodules was 2.55-35.87 mg per plant. TG98,TG100,TG101 and TG115 significantly increased the chlorophyll content,photosynthetic capacity and nitrogen absorption capacity of the plants,which were the main physiological and biochemical mechanisms for promoting growth. TG101 with the best growth-promoting effect was identified as Bradyrhizobium erythrophlei. In conclusion,the rhizobia promoted the synthesis of chlorophyll,enhanced the activity of photosystem,and improved the photosynthetic capacity by improving the nitrogen nutrition of plants,thus promoting the accumulation of dry matter and regulating its growth. Among them,TG101 with the best growth-promoting effect was an efficient rhizobium,which provided strain resources and theoretical basis for the subsequent development of rhizobium agents suitable for L. davurica in the Loess Plateau,China.
Key words:Lespedeza daurica;Rhizobia;Screening;Identification
氮素(Nitrogen)是限制豆科植物生长发育的最主要元素之一[1]。尽管大气中存在大量的氮,但大多以极稳定状态存在,不能被植物吸收利用[2]。根瘤菌(Rhizobium)能够与豆科植物共生,形成根瘤(Nodule)固定大气中的氮供自身及周围植物利用,是生物固氮(Biological nitrogen fixation)中效率最高的体系[3]。根瘤菌促进植物生长发育主要体现在两方面,一是豆科植物-根瘤菌共生体(Legume-rhizobium symbioses)不仅能够固氮,还通过改善植株的光合特性促进干物质积累,进一步提高产量(生物量);二是可促进根系生长,增加根系吸收面积,进而提高根毛对营养元素的吸收能力,促进植物对周围环境养分的吸收和利用,调控其生长发育,改善品质[6]。豆科植物-根瘤菌共生体在提高土壤肥力,减少氮肥施用,改善生态环境等方面发挥积极作用[7]。因此,探究和开发根瘤菌对于农业生产及生态环境修复具有重要意义。
达乌里胡枝子(Lespedeza davurica)是豆科胡枝子属的多年生草本状半灌木,能够与根瘤菌共生,具有很高的利用价值。其茎叶鲜嫩,富含蛋白质等营养元素,饲用价值高[8];叶片富含黄酮类化合物,具有清热解毒、降血脂等功效,可用于制茶[9];根系较发达,耐旱耐贫瘠,是生态修复的先锋草种[10]。达乌里胡枝子主要分布在我国北方、华中至云南等地的森林草原或草原地带,黄土高原是其分布的几何和多度中心。黄土高原地区土壤氮素匮乏,尤其是草地土壤全氮含量和氮密度均低于农田[13],不利于达乌里胡枝子的生长发育及栽培利用。近年来,为缓解氮素匮乏的问题,人们大量使用氮肥,对土壤、水体和大气等造成了严重的污染[14]。豆科植物-根瘤菌共生体作为一种绿色无污染的固氮方式,在生态环境保护以及农业绿色可持续发展方面逐渐受到重视。
目前,国内外有关胡枝子属植物根瘤菌的研究主要集中于根瘤菌多样性、促生效应等方面,研究地区包括韩国[20]、美国[21]以及我国的陕西、内蒙古、甘肃等。能够与胡枝子属植物共生固氮的根瘤菌有4属,包括慢生根瘤菌属(Bradyrhizobium)、中慢生根瘤菌属(Mesorhizobium)、中华根瘤菌属(Sinorhizobium)和根瘤菌属(Rhizobium)。接种根瘤菌能够显著提高胡枝子的结瘤率、根瘤数、根瘤鲜重以及植物生物量等。山西是达乌里胡枝子的主要分布区之一,但是目前尚未见包括该地区在内的我国达乌里胡枝子根瘤菌的系统研究。本研究选取前期从山西省达乌里胡枝子根瘤分离且具有较好结瘤效果的7株根瘤菌,通过盆栽试验比较不同菌株对植株的促生效应,进一步对其生理生化机制进行分析,对高效根瘤菌进行鉴定,以期为研发适用于黄土高原地区的达乌里胡枝子根瘤菌剂提供菌种资源和理论依据。
1 材料与方法
1.1 供试菌株
2021年从山西省种植的‘晋农1号’达乌里胡枝子根瘤中分离纯化了88株根瘤菌,保存在含有30%甘油的冻存管中,置于—80℃超低温冰箱。
菌种活化及菌悬液的制备:将保存的菌株从-80℃超低温冰箱取出后,置于45℃水浴锅中热激5 min,使其快速复苏。用无菌接种环将复苏菌株划线接种在YMA培养基上,28℃恒温箱(MJ-I型,上海一恒公司)培养24 h。挑取单菌落接种在TY液体培养基,28℃、180 r·min-1恒温振荡培养箱(ZQLY-180E型,上海知楚公司)培养24 h。取10 mL上述培养液置于离心机(H2050R型,湖南湘仪公司)4℃、10 000 r·min-1离心10 min,倒去上清液,用无菌水冲洗3次,收集菌体。向获得的菌体中加入5 mL无菌水,充分混匀,调节OD600为0.8,备用。
16S rRNA基因序列相似性:用无菌接种环挑取根瘤菌单菌落,置于盛有20 μL无菌水的PCR八连排管中,在PCR仪上95℃加热7 min,4℃、10 000 r·min-1离心10 min取上清液作为模板DNA备用。利用细菌16S rRNA基因通用引物P1(5′-AGAGTTTGATCCTGGCTCAGAACGAACGCT-3′)和P6(5′-TACGGCTACCTTGTTACGACTTCACCCC-3′)对模板DNA进行扩增。PCR反应体系:2×Taq Master Mix 25 μL,上、下游引物(10 μmol·L-1)各2 μL,DNA模板(10 ng·μL-1) 2 μL,ddH2O 19 μL。PCR反应条件:94℃ 3 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,30个循环;72℃ 5 min。PCR产物经1%琼脂糖凝胶电泳检测合格后,送生工生物工程(上海)股份有限公司测序。获得的16S rRNA基因序列用生物信息学分析软件DNAStar和SeqMan程序进行拼接和人工校对,编辑后获得的序列提交美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库获得登录号,并利用EzBioCloud (https://www.ezbiocloud.net/identify/)进行序列比对。
利用Fahreus半固体无氮培养基培养达乌里胡枝子幼苗并接种根瘤菌,进一步对其结瘤效果进行测定,最终选取了7株结瘤效果较好的根瘤菌作为供试菌株(表1)。
1.2 培养基及试剂
试剂均为国产分析纯。酵母甘露醇琼脂(Yeast mannitol agar,YMA)培养基参考文献[25]配制,酵母蛋白胨(Tryptone yeast,TY)液体培养基参考文献[26]配制。Gibson微量元素液和Fahreus无氮营养液参考文献[27]配制。
1.3 根瘤菌对盆栽达乌里胡枝子的促生试验
1.3.1 幼苗植株的培养 挑选一批籽粒饱满、色泽形态一致的‘晋农1号’达乌里胡枝子种子(由山西农业大学草业科学实验室提供),用5% NaCl溶液消毒5 min,最后用无菌水漂洗6~8次。用无菌镊子将表面消毒完全的达乌里胡枝子种子播种到盛有无菌蛭石的花盆(内径9 cm,高13 cm)中,每盆播种10粒,然后在温度为25℃,光照周期为16 h/8 h(光照/黑暗),相对湿度为40%~50%的植物培养间培养,期间每周定期补充无菌水。在培养10 d后间苗,每盆留3株长势一致的幼苗。
1.3.2 根瘤菌的接种 从幼苗生长第10天,即间苗结束后开始接种。用移液枪吸取1.1中OD600为0.8的根瘤菌菌悬液1 mL,接种在达乌里胡枝子幼苗茎基部,以接种无菌水的幼苗为对照,并每隔7 d再次接种,共接种3次,每个处理3次重复。接种完成后在植物培养间中培养,期间每周将花盆底部浸泡在Fahreus无氮营养液中吸水,保持基质湿润。
1.3.3 根瘤菌促生作用的测定 形态和生长指标测定:在第1次接种90 d后取样,利用直尺测定植株的垂直株高、根长,利用游标卡尺测定茎粗,利用根系扫描仪(LA-S型,杭州万深公司)统计根系数据,用剪刀将植株地上部与地下部分离后,利用量筒测定植株根体积,利用分析天平分别测定植株和根瘤鲜重。将植株地上部和地下部分别装入信封中,于105℃杀青30 min,65℃烘干至恒重,称重测定其地上部、地下部干重(生物量)。
结瘤特征的测定:利用游标卡尺测定根瘤直径,利用分析天平测定根瘤鲜重。
根瘤投资(Investment to nodulation)的计算[10]:根瘤生物量占植株总生物量的比例。
全氮含量测定:使用连续流动分析仪(AA3型,德国SEAL公司)测定植株地上部分的全氮含量。
粗蛋白含量测定:全氮含量乘以系数6.25即为植株地上部分粗蛋白含量。
可溶性糖含量测定:利用蒽酮法测定植株地上部分可溶性糖含量。
黄酮含量测定:以芦丁为对照品,利用分光光度法测定植株地上部分黄酮含量。
叶绿素相对含量的测定:利用便携式叶绿素测定仪(SPAD-502PLUS型,日本柯尼卡公司)对达乌里胡枝子同一叶位叶片的叶绿素相对含量(SPAD)进行测定,每个处理3次重复。
叶片气体交换参数测定:选取达乌里胡枝子植株的同一叶位叶片,利用便携式光合仪测(CI-340型,美国CID公司)定净光合速率(Net photosynthetic rate,Pn)、气孔导度(Stomatal conductance,Gs)、胞间CO2浓度(Intercellular CO2 concentration,Ci)、蒸腾速率(Transpiration rate,Tr),每个处理3次重复。将测量后的叶片取下,测定其叶面积。
叶绿素荧光参数测定:利用便携式叶绿素荧光仪(PAM-2500型,德国WALZ公司),测定黑暗环境下适应20 min的达乌里胡枝子叶片的初始荧光(Fluorescence origin,Fo)、最大荧光(Fluorescence maximum,Fm)和PSⅡ最大光化学量子产量Fv/Fm(Maximal quantum yield of PSⅡ),并计算可变荧光(Variable fluorescence,Fv)Fv=Fm-Fo和PSⅡ潜在光化学效率(Potential photochemical efficiency of PSⅡ)Fv/Fo。
所述测定指标均为3次重复的平均值。
1.4 高效根瘤菌的鉴定
根据达乌里胡枝子的主要用途(饲草生产和生态修复),以植株的生物量、粗蛋白含量、氮含量、形态指标、叶绿素含量、光合指标以及结瘤指标来确定高效根瘤菌。
1.4.1 形态学鉴定 将高效根瘤菌TG101接种在YMA培养基上,28℃恒温倒置培养,第7 d观察菌落形态特征,测定直径。进行革兰氏染色、芽孢染色[28],电镜下观察菌体形态特征,测量大小,测量重复50次。
1.4.2 生理生化特性鉴定 对高效根瘤菌TG101进行吲哚反应、接触酶反应、淀粉水解反应、明胶液化反应和甲基红反应的测定[29]。
1.4.3 分子生物学特性鉴定 使用MEGA 7.0软件将高效根瘤菌TG101的序列与EZBioCloud数据库中的模式菌株序列进行系统发育分析,采用邻接法(Neighbor-Joining method)构建系统发育树,自展值(bootstrap)为1 000次。
1.5 数据统计与分析
利用Microsoft Excel 2019整理数据,利用SPSS 26.0进行数据分析,对达乌里胡枝子的结瘤数、根瘤直径、株高、根长、茎粗、根体积、植株生物量、根瘤生物量、叶片气体交换参数、叶绿素相对含量、叶片叶绿素荧光参数等指标进行单因素方差分析和最小显著性差异法(Least-Significant Difference,LSD)多重比较(Plt;0.05)。利用Origin 2021统计软件绘制根瘤菌对达乌里胡枝子促生作用的柱状图。
2 结果与分析
2.1 不同根瘤菌菌株对达乌里胡枝子生长的影响
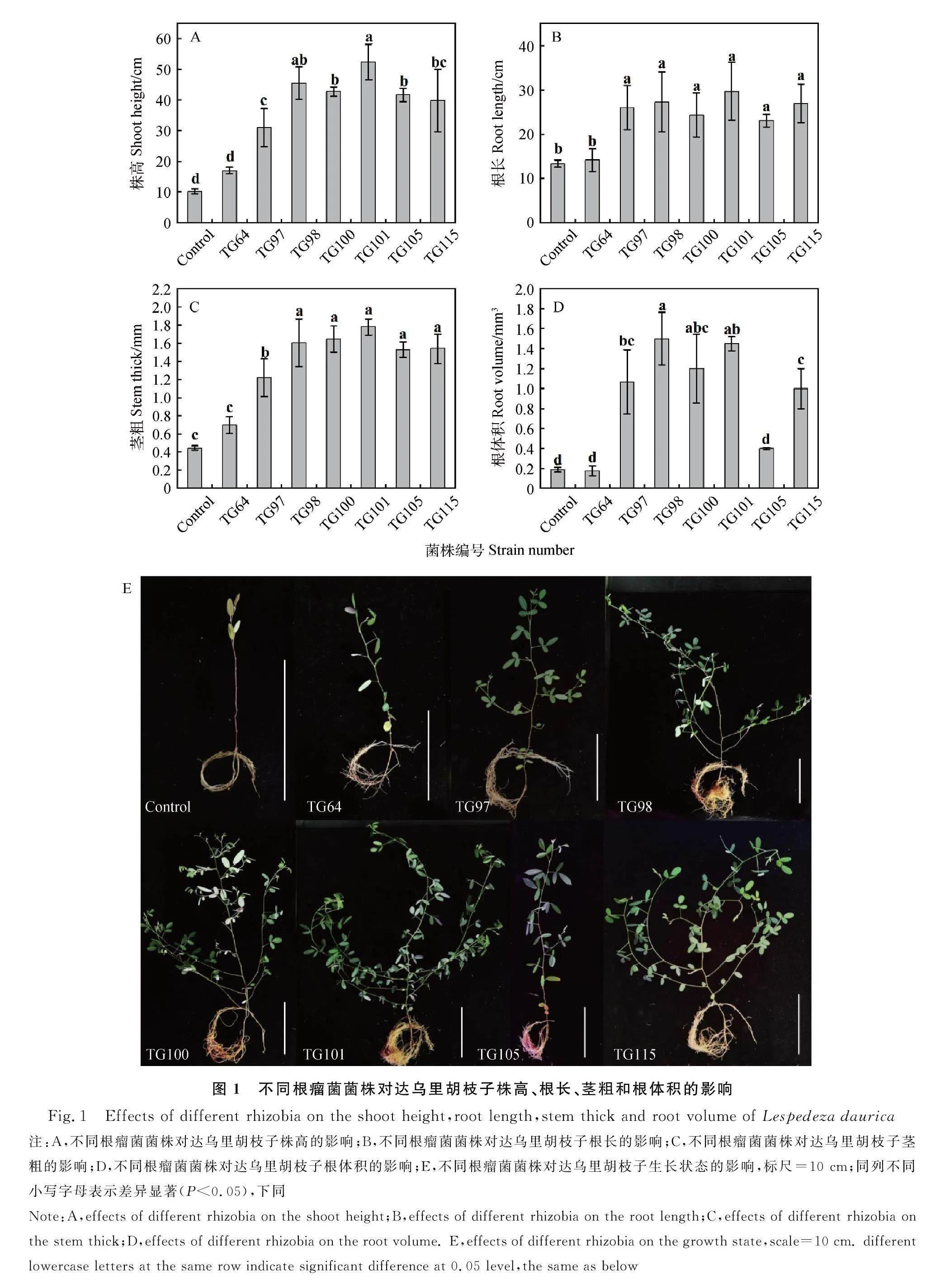
除接种TG64,其余处理均使达乌里胡枝子的株高、根长和茎粗显著提高(Plt;0.05)(图1E)。与对照相比,株高提高了204.3%~414.5%(图1A);根长提高了72.4%~121.4%(图1B);茎粗提高了174.2%~300.0%(图1C)。其中接种TG101的植株株高、根长和茎粗均最高,分别为52.35 cm、29.67 cm和1.78 mm。除接种TG64和TG105,其余处理使根体积显著提高了433.3%~700.0%(Plt;0.05)。其中接种TG98的植株根体积最大,为1.50 mm3(图1D)。
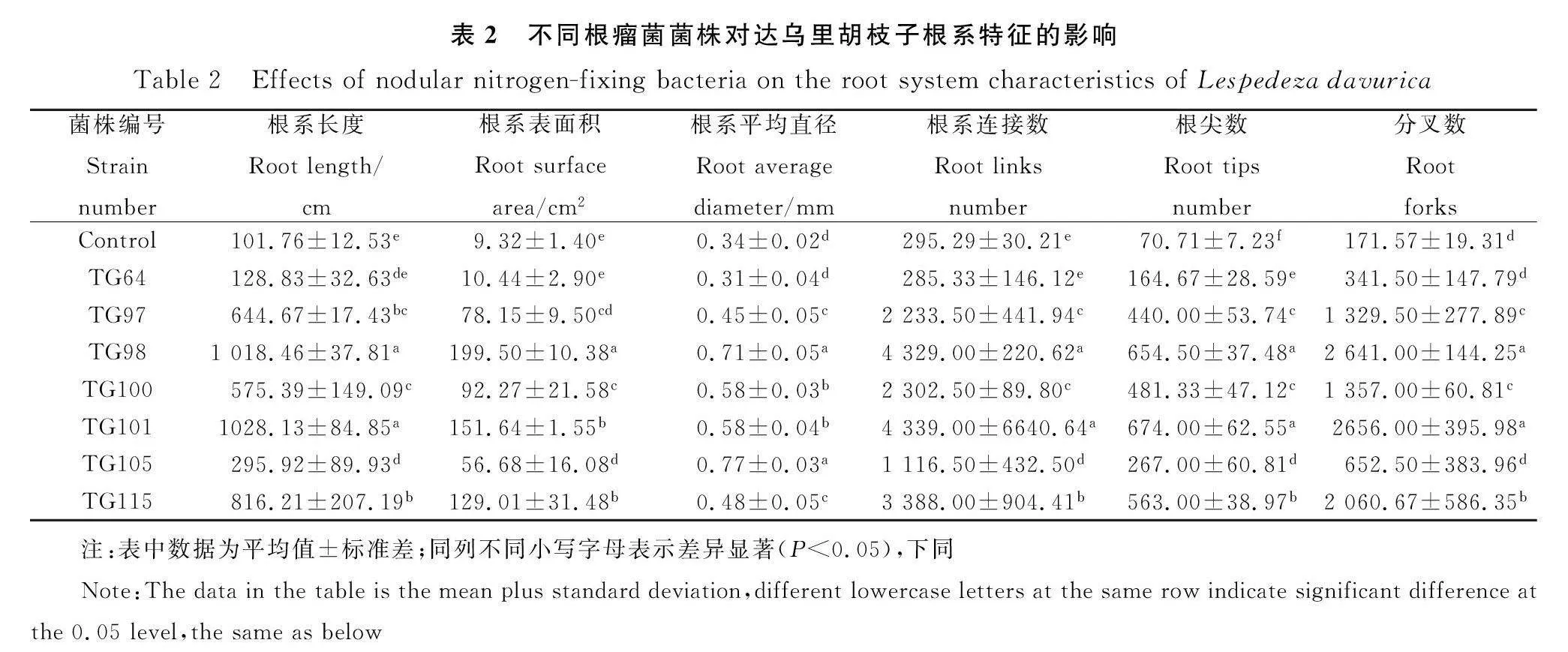
除接种TG64,其余处理均使达乌里胡枝子的根系长度、根系表面积、根系平均直径、根系连接数和分叉数显著提高(Plt;0.05)。与对照相比,根系长度提高了1.9~9.1倍,根系表面积提高了5.1~20.4倍,根系平均直径提高了0.3~1.3倍,根系连接数提高了2.8~13.7倍,根系分叉数提高了2.8~14.5倍。其中,接种TG101的植株根系长度、根系连接数和分叉数最高,分别为1 028.13 cm、4 339.00个和2 656.00个;接种TG98的植株根系表面积和根系平均直径最大,分别为199.50 cm2和0.71 mm。7株根瘤菌使达乌里胡枝子的根尖数显著提高了1.3~8.5倍(Plt;0.05)。其中接种TG101和TG98的达乌里胡枝子根尖数最大,分别为674.00个和654.50个,显著高于其余处理(Plt;0.05)(表2)。
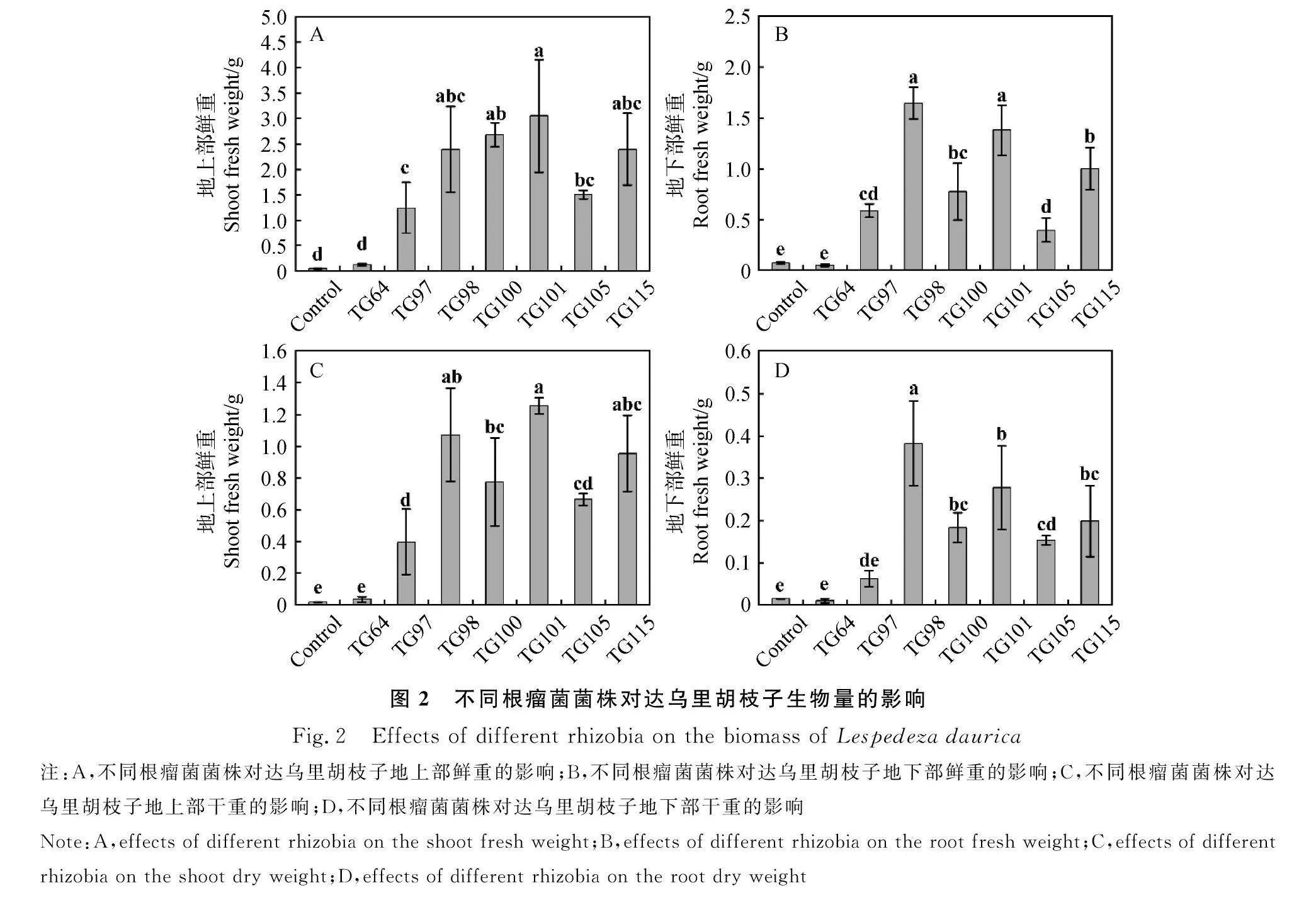
2.2 不同根瘤菌菌株对达乌里胡枝子生物量的影响
除接种TG64,其余处理使达乌里胡枝子的生物量均显著提高(Plt;0.05)。与对照相比,地上部鲜重提高了26.5~66.5倍(图2A);地下部鲜重提高了4.5~21.7倍(图2B);地上部干重提高了21.0~68.47(图2C);地下部干重提高了3.2~25.0倍(图2D)。其中,接种TG101的植株地上部鲜重和地上部干重均为最高,分别为3.05 g和1.26 g;接种TG98的植株地下部鲜重和地下部干重均为最高,分别为1.65 g和0.38 g;并且接种TG98和TG101的植株地下部鲜重显著高于其余处理(Plt;0.05)。
2.3 不同根瘤菌菌株对达乌里胡枝子营养品质的影响
7株根瘤菌均显著提高了达乌里胡枝子的粗蛋白含量(Plt;0.05),与对照相比提高了170.1%~207.4%(图3)。其中,接种TG101和TG115的植株粗蛋白含量显著高于其余处理(Plt;0.05),分别为165.80和160.98 g·kg-1(图3A)。TG97和TG115显著提高了达乌里胡枝子的可溶性糖含量(Plt;0.05),与对照相比提高了4.2%~12.3%。TG64、TG100、TG101和TG115均显著降低了植株可溶性糖含量,与对照相比降低了11.1%~27.9%(Plt;0.05)(图3B)。仅TG98显著提高了达乌里胡枝子的黄酮含量(Plt;0.05),与对照相比提高了6.5%。其余6株根瘤菌均显著降低了植株黄酮含量,与对照相比降低了9.5%~39.4%(Plt;0.05)(图3C)。
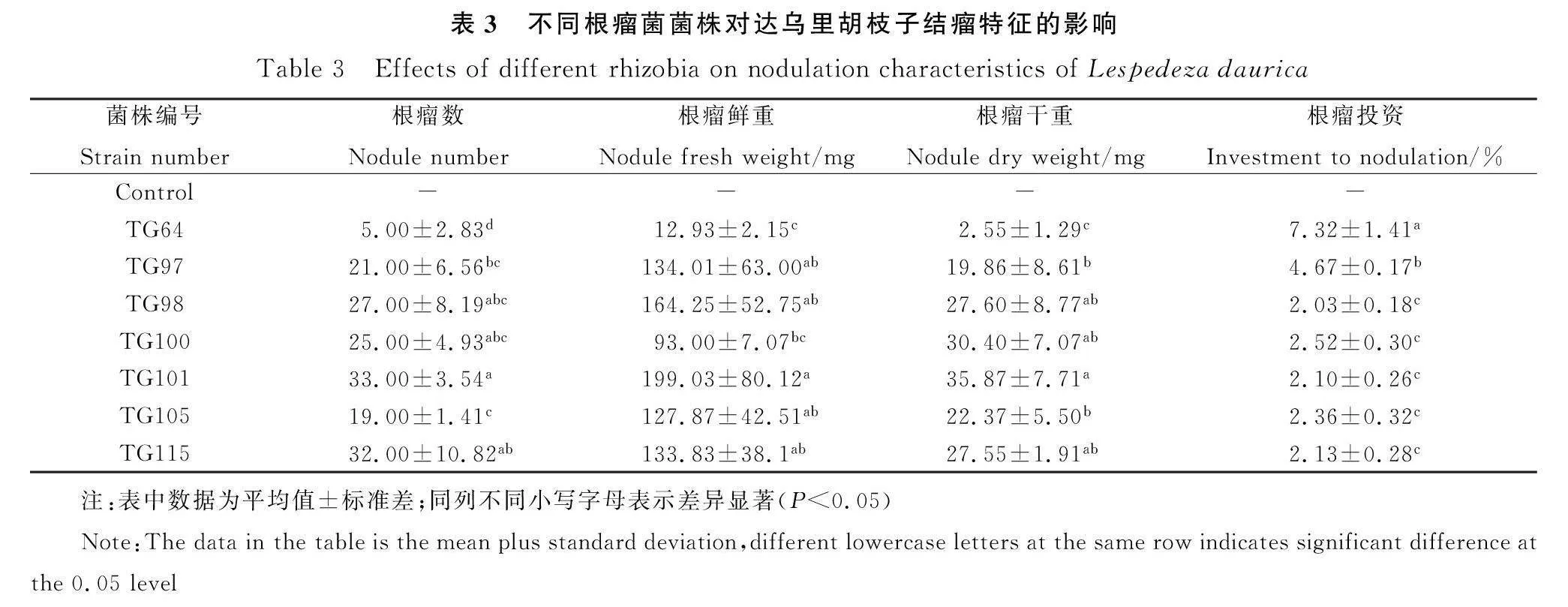
2.4 不同根瘤菌菌株对达乌里胡枝子结瘤特征的影响
7株根瘤菌的单株平均结瘤数量为5~33个·株-1,根瘤平均鲜重为12.93~199.03 mg,根瘤平均干重为2.55~35.87 mg。其中TG101的单株结瘤数量、根瘤平均鲜重和平均干重均最大,分别为33个,199.03 mg和35.87 mg。接种7株根瘤菌后,达乌里胡枝子的根瘤投资为2.03%~7.32%,其中接种TG64和TG97的植株根瘤投资显著高于其他处理(Plt;0.05),分别为7.32%和4.67%,TG98的根瘤投资最低,为2.03%(表3)。
2.5 不同根瘤菌菌株对达乌里胡枝子全氮含量的影响
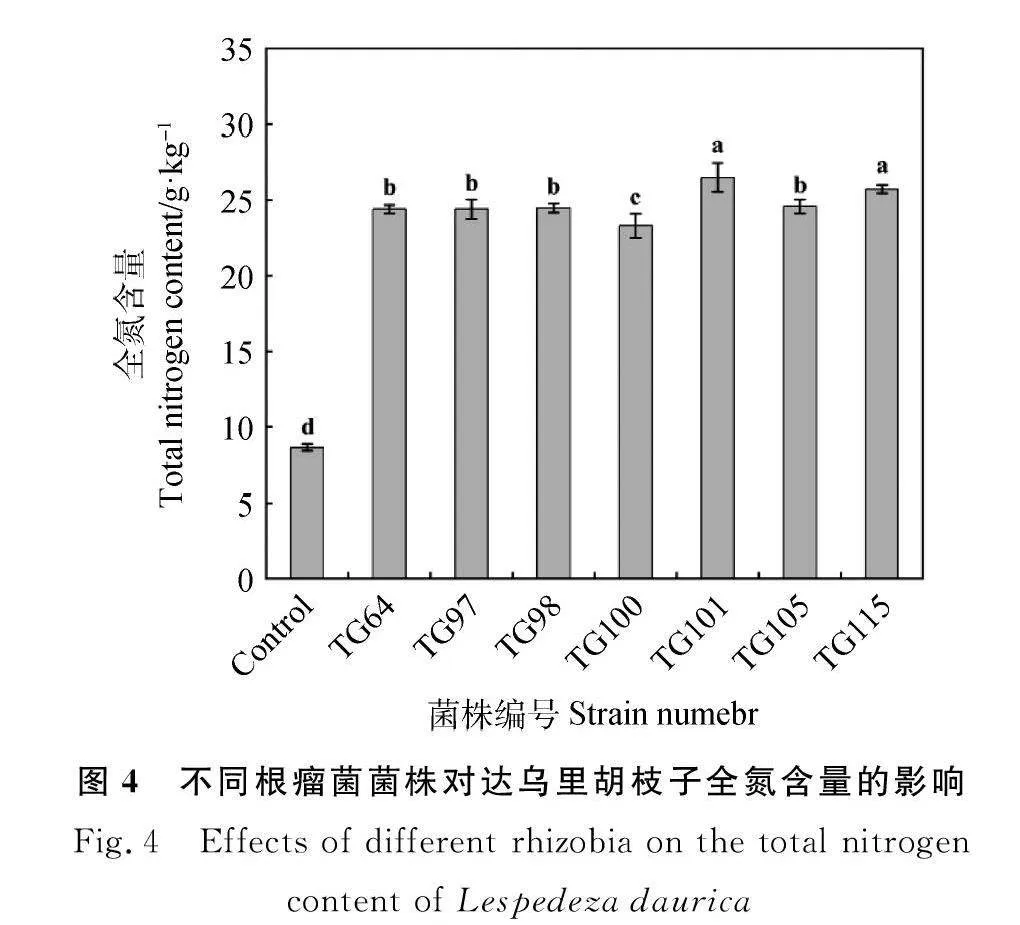
7株根瘤菌均显著提高了达乌里胡枝子的全氮含量(Plt;0.05)。与对照相比提高了170.1%~207.4%。其中,接种TG101和TG115的植株全氮含量显著高于其余处理(Plt;0.05),分别为26.53 g·kg-1和25.76 g·kg-1 (图4)。
2.6 不同根瘤菌菌株对达乌里胡枝子叶绿素相对含量的影响
7株根瘤菌均显著提高了达乌里胡枝子的叶绿素相对含量(Plt;0.05),其SPAD值与对照相比,提高了81.7%~150.4%。其中,接种TG101的植株SPAD值最高,为53.04,显著高于其他处理(Plt;0.05),TG100除外(图5)。
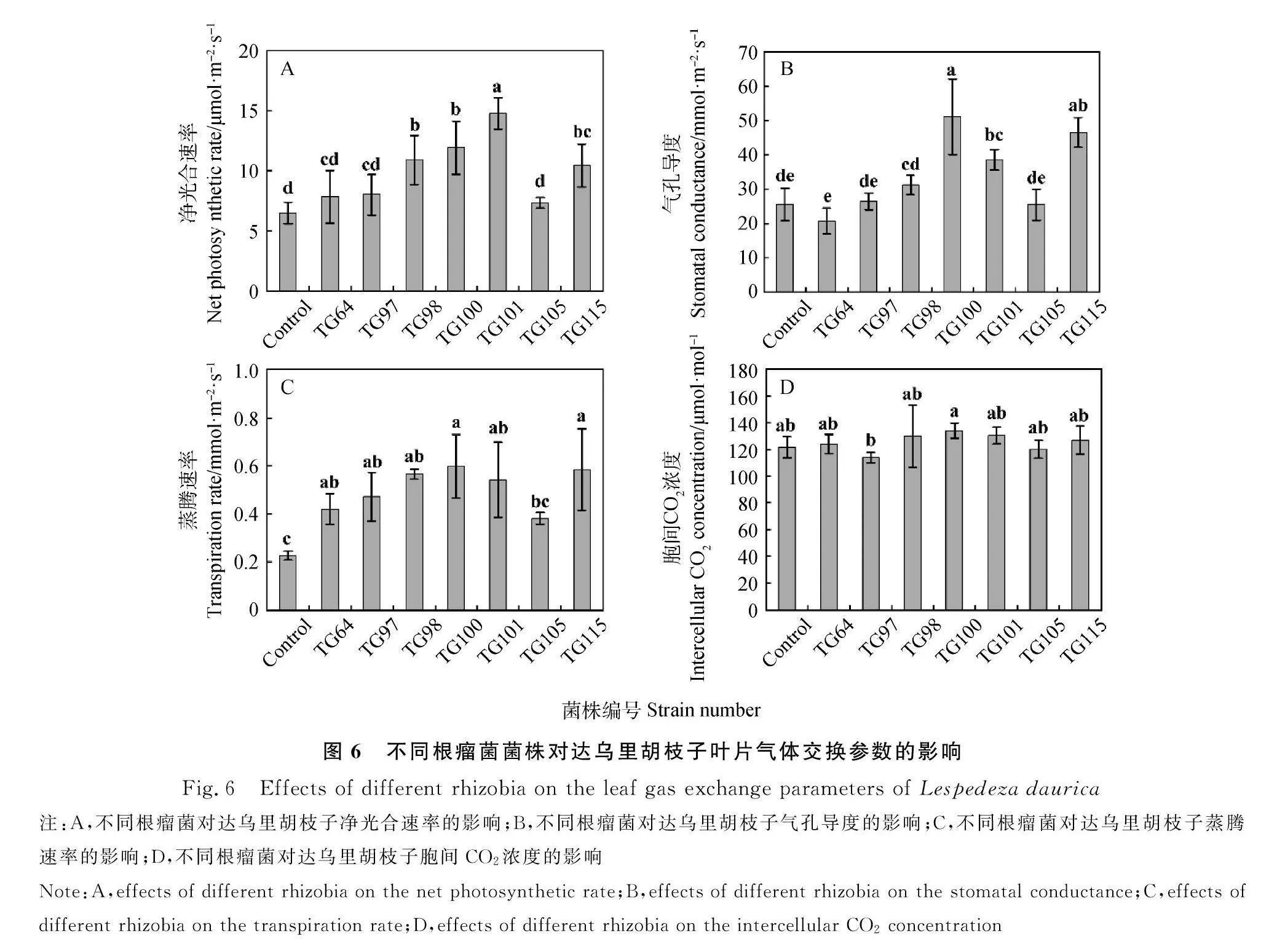
2.7 不同根瘤菌菌株对达乌里胡枝子光合特性的影响
接种TG98、TG100、TG101和TG115后,达乌里胡枝子的净光合速率分别比对照显著提高了67.4%、82.9%、127.1%和60.2%(Plt;0.05) (图6)。其中,接种TG101的植株净光合速率显著高于其他处理(Plt;0.05),为14.76 μmol·m-2·s-1 (图6A)。接种TG100、TG101和TG115后,植株的气孔导度分别比对照显著提高了100.2%、51.0%和82.3%(Plt;0.05)。其中,接种TG100的植株气孔导度最高,为51.01 mmol·m-2·s-1,TG115次之,为46.46 mmol·m-2·s-1,TG101为38.47 mmol·m-2·s-1 (图6B)。除接种TG105,其余处理使植株的蒸腾速率显著提高了86.0%~164.8%(Plt;0.05)。其中,接种TG100的植株蒸腾速率最高,为0.60 mmol·m-2·s-1(图6C)。接种TG97的植株叶片胞间CO2浓度有所降低,但是与对照间均无显著差异(Plt;0.05)(图6D)。
2.8 不同根瘤菌菌株对达乌里胡枝子叶绿素荧光特征的影响
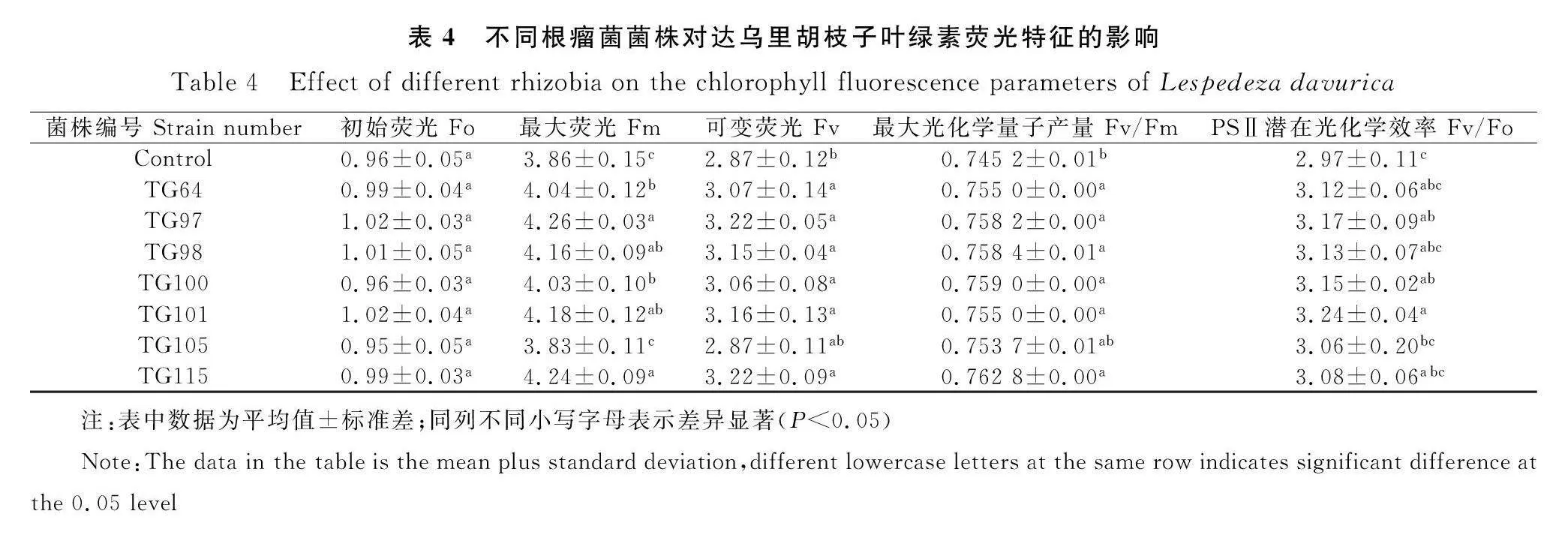
除TG105,其余处理使达乌里胡枝子的最大荧光Fm显著提高了4.4%~10.4%,可变荧光Fv显著提高了7.0%~12.2%,最大光化学量子产量Fv/Fm均显著提高1.3%(Plt;0.05),其中接种TG97的植株Fm最高,为4.26,接种TG97和TG115的植株Fv最高,均为3.22。接种TG97、TG100和TG101后,植株的PSⅡ潜在光化学效率Fv/Fo显著提高了6.7%、6.1%和9.1% (Plt;0.05),其中接种TG101的植株Fv/Fo最高,为3.24(表4)。
2.9 高效根瘤菌TG101的分类地位
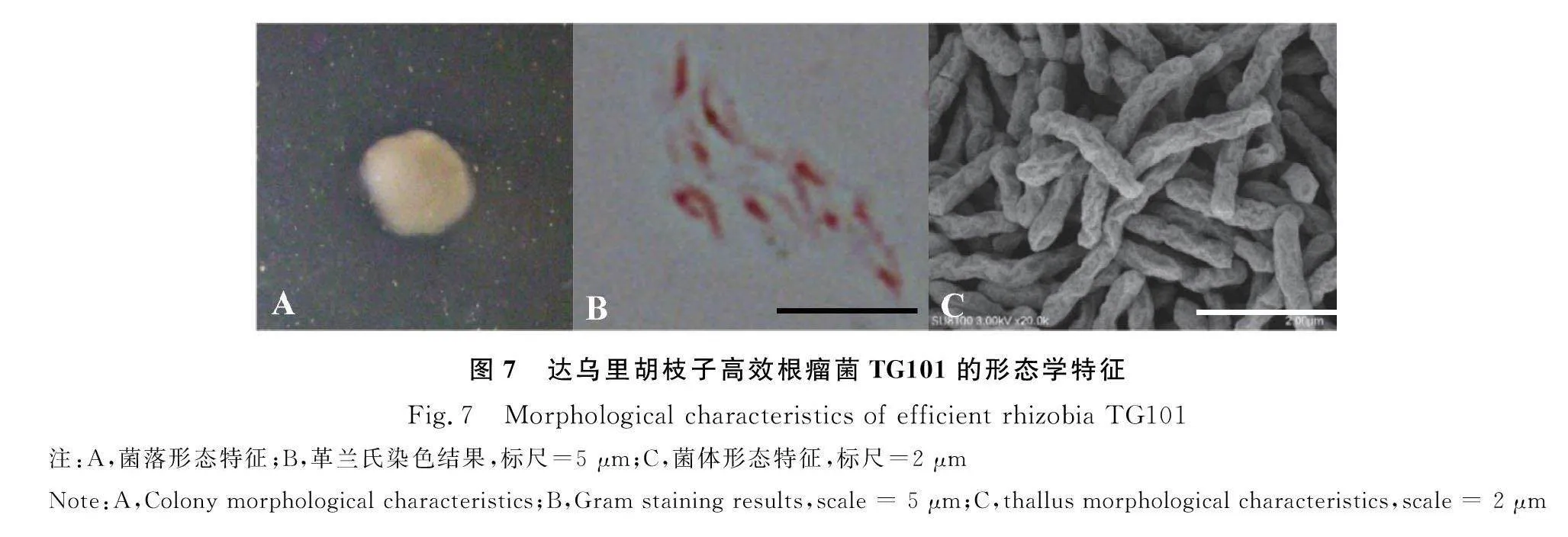
TG101的菌落为白色、圆形,边缘完整,中心无隆起,菌落表面有光泽且不透明,质地粘稠,生长2 d的菌落直径为3.47 mm(图7A)。其革兰氏染色为阴性(图7B),无芽孢,菌体直杆状,大小为(0.54~0.84) μm×(2.39~4.95) μm(图7C,表5)。
在TG101的1%胰胨水溶液滴加Kovac试剂后,培养液层界面无红色环出现,吲哚反应呈阴性。TG101与过氧化氢反应产生气泡,过氧化氢酶反应呈阳性。在TG101的葡萄糖蛋白胨液体培养基滴加甲基红试剂后,培养液呈淡黄色,甲基红反应呈阴性。在淀粉琼脂培养基上滴加碘液,菌落周围无透明圈产生,淀粉水解反应呈阴性。在明胶培养基培养后,TG101无液化现象出现,明胶液化反应呈阴性(表6)。
高效根瘤菌TG101的GenBank登录号为OQ710138,16S rRNA基因序列长度为1 430 bp。通过EZBioCloud数据库比对和系统发育分析(图8),TG101与模式菌株格木慢生根瘤菌(B. erythrophlei CCBAU 53325T 登录号:KF114645)的同源性为99.85%。结合菌株形态学特征、生理生化特性,确定TG101为格木慢生根瘤菌。
3 讨论
生长形态是反映植株生长状况的最直观特征,生物量能够反映其生长状况[30]。本研究中,接种TG97、TG98、TG100、TG101和TG115后,达乌里胡枝子的株高、根长、茎粗、根体积和地上、地下生物量均显著提高。Sun等[31]研究发现,接种根瘤菌能够显著促进刺槐(Robinia pseudoacacia)幼苗生长,其株高、根系直径和总生物量分别提高了44%,19%和123%。全紫曼等[32]研究表明,接种根瘤菌能够显著提高蚕豆(Vicia faba)的株高和生物量。Qu等[33]对盐胁迫下的大豆接种根瘤菌,发现其生物量提高了10.95%~30.95%,本研究中接种根瘤菌后,植株地上生物量提高了26.5~66.5倍,远高于该文献的效果。本研究接种根瘤菌后,达乌里胡枝子的株高、根长、茎粗、根体积和生物量最高分别可提升414.5%,121.4%,300.0%,700.0%和68.47倍,具有良好的应用前景。根系是植物吸收水分和营养元素的关键器官,其生长状况能够反映植物的生长水平和抗逆性等特征[30]。其中根系长度和根表面积是衡量根系吸收范围的重要指标,根系平均直径、连接数、根尖数、分叉数等能够衡量根系的吸收能力[34]。本研究中,接种TG97,TG98,TG100,TG101,TG105和TG115后,达乌里胡枝子的根系长度、根系表面积、根系平均直径、根系连接数和分叉数均显著提高。高文礼等[34]研究表明,接种根瘤菌提高了疏叶骆驼刺(Alhagi sparsifolia)的根系表面积和根系平均直径,促进植株生长。郝凤等[35]在接种根瘤菌对紫花苜蓿根系形态特征的研究中也得到了相似的结论。
生物固氮是豆科植物在整个生长发育过程中最主要的吸收氮素的途径,根瘤是进行生物固氮的重要结构。根瘤数量和重量是评价根瘤菌结瘤能力的两个重要指标[36]。通过盆栽试验对7株根瘤菌的促生效应进行研究,发现TG97,TG98,TG100,TG101,TG105和TG115的结瘤数和根瘤干重显著高于TG64,结瘤效果更好。根据前期采用分子生物学方法初步鉴定结果,发现TG97,TG98,TG100,TG101,TG105和TG115均为慢生根瘤菌属,TG64为新根瘤菌属,与伍惠等[37]的研究结论相似,慢生根瘤菌属通常具有更好的结瘤固氮能力。根瘤投资能够反映豆科植物的生物固氮能力[38]。结瘤固氮是一个高耗能过程,一般而言,豆科植物更倾向于以较低的根瘤投资获取更多的氮营养[39]。本研究中,TG64和TG97的根瘤投资显著高于其他接种处理,而结瘤数、根瘤干重等却相对较低,其原因可能是TG64和TG97的固氮能力较差,植物需要投入更多的物质能量形成根瘤,来获取足够的氮以维持自身生命活动。后续将进一步对上述7株根瘤菌的固氮酶活性进行测定,定量分析其固氮能力。
氮素是构成植物叶绿素、蛋白质、核酸以及激素等成分的重要元素之一,在豆科植物生长发育过程中发挥重要作用[40]。豆科植物-根瘤菌共生体是豆科植物改善自身氮营养的主要途径,本研究发现,接种根瘤菌后达乌里胡枝子的全氮含量显著提高,并且其营养品质也显著改善,尤其是蛋白质含量显著提高,与关于接种根瘤菌对紫花苜蓿氮营养的研究相似。接种根瘤菌并未对达乌里胡枝子的黄酮产生明显影响,因此上述菌株更适用于高蛋白饲草的生产。达乌里胡枝子作为优良的豆科牧草,具有良好的生态修复功能。根据其用途(饲草生产、生态修复),本研究确定以地上生物量、形态指标、粗蛋白含量、氮含量、叶绿素含量、光合指标以及结瘤指标来确定高效根瘤菌。TG101与其他菌株相比,在上述指标中的促进效果更优,因此将TG101确定为高效根瘤菌。在氮限制条件下,植株的叶绿素合成受阻,光系统活性受到抑制,并且气孔导度会明显降低,进而影响自身水分利用与气体交换[44],抑制光合作用,对生长造成不利影响。叶绿素作为植物进行光合作用的最重要色素分子,在光能的吸收和转换过程中发挥着重要作用[45],其含量直接影响植物的光合能力。本研究中,7株根瘤菌均显著提高了达乌里胡枝子的叶绿素相对含量。孙庆圣等[46]研究减施氮肥和接种根瘤菌对大豆光合特性的影响发现,接种根瘤菌能够显著促进叶绿素的合成,进而提高大豆的净光合速率,促进植株生长。菜豆[47]和大豆[48]接种根瘤菌的研究也得到了类似的结果,表明根瘤菌能够通过固氮作用提高植株的氮营养,进而促进了叶绿素的合成。
叶绿素荧光动力学技术在测定植物光合作用的光系统对光能的吸收、传递、消耗和分配等具有重要作用,能够从侧面反应植物的光合功能[49]。其中,初始荧光Fo代表PSⅡ反应中心处于完全开放时的荧光产量;最大荧光Fm代表PSⅡ反应中心处于完全关闭时的荧光产量,反映了通过PSⅡ的电子传递情况;可变荧光Fv反映了QA的还原情况;最大光化学量子产量Fv/Fm反映了PSⅡ的原初光能转化效率;Fv/Fo反映了PSⅡ的潜在光化学效率[50]。已有学者对达乌里胡枝子以及尖叶胡枝子等的光响应曲线特征进行了研究,均在上午9:30—11:30测定较好。本研究通过在上午9:30—11:30测定达乌里胡枝子的叶绿素荧光参数,发现接种根瘤菌显著提高了其Fm、Fv和Fv/Fm,并且TG97、TG100和TG101还显著提高了其Fv/Fo,与李馨园等[53]对大豆接种根瘤菌的研究结果一致,说明接种根瘤菌显著改善了达乌里胡枝子的光系统活性,进而增强其光合作用。植物能够通过光合作用固定光能转化为有机物质供自身利用,光合作用是植物生长发育的保证[54]。净光合速率是反映植物光合潜力的重要指标,也是决定植物生产力的根本因素[55]。本研究中,接种TG100、TG101和TG115显著提高了达乌里胡枝子的净光合速率。Raja等[41]发现田间接种根瘤菌能够显著提高紫花苜蓿的叶绿素含量、光系统活性等。孟捷等[56]研究发现,接种根瘤菌能够显著提高紫花苜蓿的净光合速率,与本研究一致。
4 结论
7株根瘤菌与达乌里胡枝子的共生匹配性和结瘤效果较好,对盆栽植株有不同程度的促生作用。根瘤菌通过与达乌里胡枝子共生,形成根瘤发挥固氮作用改善植株的氮素营养,进而促进叶绿素的合成、改善光系统活性等方式增强其光合能力(净光合速率),从而促进植株固定光能转化为有机物质,调控其生长。其中,TG101对达乌里胡枝子的生物量、粗蛋白含量、氮含量、形态指标、叶绿素相对含量、光合指标以及结瘤指标等的促进效果最优,确定为高效根瘤菌,经分子生物学、形态学和生理生化特性鉴定为格木慢生根瘤菌,可作为后续研发适用于黄土高原地区的达乌里胡枝子根瘤菌剂的菌种资源。
参考文献
[1] TERPOLILLI J J,Hood G A,POOLE P S. What determines the efficiency of N2-fixing Rhizobium-legume symbioses?[J]. Advances in Microbial Physiology,2012,60:325-389
[2] 曹克璠,刘嘉伟,索荣臻,等. 接种根瘤菌对‘蒙农三叶草1号’结瘤固氮及生长的影响[J].草地学报,2023,31(12):3876-3886
[3] HERRIDGE D F,PEOPLES M B,BODDEY R M. Global inputs of biological nitrogen fixation in agricultural systems[J]. Plant and Soil,2008,311:1-18
[4] 张旭辉,马绍英,马蕾,等. 接种根瘤菌对重茬豌豆植株生长及光合特性的影响[J]. 草地学报,2021,29(6):1234-1241
[5] 高文礼,陈晓楠,伊力努尔·艾力,等. 不同水分处理下双接种丛枝菌根真菌和根瘤菌对疏叶骆驼刺生长及氮素转移的影响[J]. 生态学报,2022,42(16):6816-6826
[6] 王二涛. 植物-根瘤菌共生固氮[J]. 中国基础科学,2016,18(1):21-27,22
[7] 赵叶舟,王浩铭,汪自强. 豆科植物和根瘤菌在生态环境中的地位和作用[J]. 农业环境与发展,2013,30(4):7-12
[8] 赵祥,邢毅,董宽虎. 居群与生育期对达乌里胡枝子营养价值的影响[J]. 中国草地学报,2010,32(3):112-116
[9] 李钰莹,杨志青,蒋奇伸,等. 胡枝子茶杀青工艺研究及品质分析[J]. 草学,2021(4):38-44
[10]王银柳,耿倩倩,黄建辉,等. 氮肥和种植密度对达乌里胡枝子的生长与生物固氮的影响[J]. 植物生态学报,2021,45(1):13-22
[11]黄瑾,姜峻,徐炳成. 黄土丘陵区达乌里胡枝子人工草地生产力与土壤水分特征研究[J]. 中国农学通报,2005(6):245-248
[12]赵祥,董宽虎,张垚,等. 达乌里胡枝子根解剖结构与其抗旱性的关系[J]. 草地学报,2011,19(1):13-19
[13]LIU Z P,SHAO M A,WANG Y Q. Spatial patterns of soil total nitrogen and soil total phosphorus across the entire Loess Plateau region of China[J]. Geoderma,2013,197:67-78
[14]GUO J,LIU X,ZHANG Y,et al. Significant acidification in major Chinese croplands[J]. Science,2010,327(5968):1008-1010
[15]GU C T,WANG E T,SUI X H,et al. Diversity and geographical distribution of rhizobia associated with Lespedeza spp. in temperate and subtropical regions of China[J]. Archives of Microbiology,2007,188:355-365
[16]YAO Z Y,KAN F L,WANG E T,et al. Characterization of rhizobia that nodulate legume species of the genus Lespedeza and description of Bradyrhizobium yuanmingense sp. nov[J]. International Journal of Systematic and Evolutionary Microbiology,2002,52(6):2219-2230
[17]WEI G H,TAN Z Y,ZHU M E,et al. Characterization of rhizobia isolated from legume species within the genera Astragalus and Lespedeza grown in the Loess Plateau of China and description of Rhizobium loessense sp. nov[J]. International Journal of Systematic and Evolutionary Microbiology,2003,53(5):1575-1583
[18]冀玉良,韦革宏. 商洛多花胡枝子根瘤菌16S rDNA-RFLP分析及系统发育研究[J]. 西北植物学报,2010,30(5):925-932
[19]姚竹云,陈文新. 胡枝子属根瘤菌的多相分类研究[J]. 微生物学报,1999(4):3-11
[20]PALANIAPPAN P,CHAUHAN P S,SARAVANAN V S,et al. Isolation and characterization of plant growth promoting endophytic bacterial isolates from root nodule of Lespedeza sp[J]. Biology and Fertility of Soils,2010(46):807-816
[21]BUSBY R R,RODRIGUEZ G,GEBHART D L,et al. Native Lespedeza species harbor greater non-rhizobial bacterial diversity in root nodules compared to the coexisting invader,L. cuneata[J]. Plant and Soil,2016,401:427-436
[22]刘振龙,蔡安国. 小冠花、胡枝子及柠条接种根瘤菌的效果[J]. 中国草地,1997(2):81
[23]宁国赞,刘惠琴,白新学,等. 胡枝子根瘤菌优良菌种筛选及应用[J]. 土壤肥料,1995(5):41-44
[24]王宏,翟贺民. 胡枝子丸衣化接种根瘤菌的效果[J]. 内蒙古草业,1995(1):63-65
[25]赵龙飞,徐亚军,曹冬建,等. 溶磷性大豆根瘤内生菌的筛选、抗性及系统发育和促生[J].生态学报,2015,35(13):4425-4435
[26]苗阳阳,周彤,师尚礼,等. 硼对根瘤菌在紫花苜蓿体内运移和定殖及对幼苗生长的影响[J]. 草业学报,2017,26(4):120-133
[27]姚丹. 不同种属PGPR菌株对紫花苜蓿-根瘤菌共生效率的影响[D]. 兰州:兰州大学,2021:26
[28]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:353-384
[29]沈萍,陈向东. 微生物学 [M]. 第2版. 北京:高等教育出版社,2006:85-92
[30]姚丹,牛舒琪,赵祺,等. 梭梭根际枯草芽孢杆菌WM13-24对多年生黑麦草耐盐性的影响[J]. 生态学报,2020,40(20):7419-7429
[31]SUN Q,LIU Y,LIU H,et al. Interaction of biochar type and rhizobia inoculation increases the growth and biological nitrogen fixation of Robinia pseudoacacia seedlings[J]. Forests,2020,11(6):711
[32]全紫曼,陈远学,刘明,等. 成都平原蚕豆高效根瘤菌的筛选及其促生功能初步评价[J]. 植物营养与肥料学报,2019,25(6):943-952
[33]QU L,HUANG Y,ZHU C,et al. Rhizobia-inoculation enhances the soybean’s tolerance to salt stress[J]. Plant and Soil,2016,400:209-222
[34]高文礼,陈晓楠,伊力努尔·艾力,等. 干旱及复水条件下接种AMF和根瘤菌对疏叶骆驼刺根系生长的影响[J]. 西北植物学报,2022,42(7):1189-1197
[35]郝凤,刘晓静,齐敏兴,等. 磷水平和接根瘤菌对紫花苜蓿根系形态特征和根瘤固氮特性的影响[J]. 草地学报,2015,23(4):818-822
[36]郭佩,王佳艺,史晓龙,等. 施氮量对不同基因型花生结瘤特性及氮素利用的影响[J]. 沈阳农业大学学报,2022,53(4):385-393
[37]伍惠,钟喆栋,王学路,等. 与黑龙江大豆主栽品种匹配的优良根瘤菌筛选与鉴定[J]. 应用与环境生物学报,2018,24(1):39-46
[38]BATTERMAN S A,WURZBURGER N,HEDIN L O. Nitrogen and phosphorus interact to control tropical symbiotic N2 fixation:a test in Inga punctata[J]. Journal of Ecology,2013,101(6):1400-1408
[39]SACHS J L,QUIDES K W,WENDLANDT C E. Legumes versus rhizobia:a model for ongoing conflict in symbiosis[J]. New Phytologist,2018,219(4):1199-1206
[40]马雪峰,高旻,程治军. 植物氮素吸收与利用的分子机制研究进展[J]. 作物杂志,2013(4):32-38
[41]RAJA B L,AIT-EL-MOKHTAR M,MOHAMED A,et al. Green compost combined with mycorrhizae and rhizobia:a strategy for improving alfalfa growth and yield under field conditions[J]. Gesunde Pflanzen,2021,73(2):193-207
[42]李莎莎,杨曌,李红,等. 接种根瘤菌对紫花苜蓿产量和品质的影响[J]. 黑龙江畜牧兽医,2021(20):98-101,107
[43]刘忆,袁玲. 根瘤菌和AM真菌对紫花苜蓿结瘤和产质量的影响[J]. 土壤学报,2020,57(5):1292-1298
[44]BROADLEY M R,ESCOBAR A J,BURNS A,et al. Nitrogen-limited growth of lettuce is associated with lower stomatal conductance[J]. New Phytologist,2001,152(1):97-106
[45]黄持都,胡小松,廖小军,等. 叶绿素研究进展[J]. 中国食品添加剂,2007(3):114-118
[46]孙庆圣,原程,张玉先. 减施氮肥和接种根瘤菌对黑大豆光合特性及产量的影响[J]. 作物杂志,2022,(4):132-137
[47]TAIRO E V,MTEI K M,NDAKIDEMI P A. Influence of water stress and rhizobial inoculation on the accumulation of chlorophyll in Phaseolus vulgaris (L.) cultivars[J]. Journal of Plant Nutrition and Soil Science,2017,15:1-13
[48]TAIRO E V,NDAKIDEMI P A. Bradyrhizobium japonicum inoculation and phosphorus supplementation on growth and chlorophyll accumulation in soybean (Glycine max L.)[J]. American Journal of Plant Sciences,2013,12:2281-2289
[49]李晓,冯伟,曾晓春. 叶绿素荧光分析技术及应用进展[J]. 西北植物学报,2006(10):2186-2196
[50]张守仁. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学通报,1999(4):444-448
[51]吴爱姣,徐伟洲,郭亚力,等. 不同水肥条件下达乌里胡枝子的光合-光响应曲线特征[J]. 草地学报,2015,23(4):785-792
[52]杨秀芳,玉柱,徐妙云,等. 2种不同类型的尖叶胡枝子光合-光响应特性研究[J]. 草业科学,2009,26(7):61-65
[53]李馨园,王守义,王淑荣,等. 根瘤菌配施胶质类芽孢杆菌对大豆叶绿素荧光特性、产量及品质的影响[J]. 大豆科学,2014,33(4):541-544,549
[54]EVANS J R. Improving photosynthesis[J]. Plant Physiology,2013,162(4):1780-1793
[55]赵洪贤,张洋军,徐铭泽,等. 油蒿叶片氮分配对其最大净光合速率季节变异的影响[J]. 生态学报,2022,42(17):7156-7166
[56]孟捷,马红,李会军,等. 2种根瘤菌对新牧1号苜蓿光合特征和生长的影响[J]. 新疆农业大学学报,2021,44(4):241-247
(责任编辑 彭露茜)

