杜仲叶际可培养真菌群落组成及产IAA菌株筛选




摘要:杜仲作为我国特有、贵州广泛分布的药用植物,其叶际微生物对其生长具有重要意义。为揭示人工栽培和野生杜仲叶际真菌群落组成、多样性及其功能,本研究采用传统分离培养法,对杜仲叶附生及内生真菌群落组成及多样性进行分析,基于FUNGuild数据库对其进行功能注释,并对其产IAA能力进行评估。本试验共分离获得真菌2门42属226株。其中,从野生杜仲叶中分离获得154株,主要包括青霉属Penicillium(25.32%)等19个优势属;从人工栽培杜仲叶中分离获得72株,主要包括曲霉属Aspergillus(16.67%)等19个优势属。功能注释结果显示:除未定义功能类群,真菌类群主要涉及动物病原菌群(12.79%)、植物病原菌群-木腐菌群(13.95%)和内生菌群-附生菌群-植物病菌群(24.42%)。结果表明人工栽培种和野生种的真菌物种组成差别较大,且共有菌株比例较低。本研究还分离到多个产吲哚-3-乙酸(IAA)菌株。研究结果将为后续精准调控杜仲叶微生物组以增强植物健康、促进植物生长以及功能菌株的开发利用。
关键词:植物微生物;叶际真菌;多样性;生态功能;吲哚乙酸
中图分类号:Q939文献标志码:A杜仲(Eucommia ulmoides Oliver)又名胶木,属于杜仲科杜仲属的落叶乔木植物,主要分布于中国甘肃、陕西等省份,是中国特有的药用和经济树种,在《神农本草经》中被列为上品,富含绿原酸、黄酮、多糖等多种有效成分,通常使用其干燥的树皮和叶子入药,具有降压、增强免疫力、降血糖等药理作用[1]。有研究指出,杜仲的各组织中微生物物种多度高且数量庞大。这些微生物对杜仲的健康、药用成分的合成和积累及产质量具有重要影响。杨娟等研究指出,杜仲树皮中的某些药理活性成分与真菌类群呈明显的正相关[2]。DONG等则对杜仲树皮中的细菌群落组成及功能进行了进一步探究,发现其中大部分核心细菌菌群与树皮的药理活性成分高度相关[3]。张青青等通过研究杜仲种子内的微生物群落组成和多样性,发现杜仲种子内携带多种有益功能菌和潜在致病菌[4]。这些微生物对植物的生长发育和药用价值具有重要影响。
叶片相关微生物,包括上下叶表面和叶组织内部的微生物被统称为叶际微生物。由于叶片作为植物光合作用和物质生产的主要器官,叶际微生物能通过直接影响叶片功能和寿命从而在植物生产力和适应性方面发挥重要作用。但大多数杜仲微生物研究集中在根、树皮和种子等组织部位,缺乏对叶际微生物的关注,少量相关研究则偏重内生菌中的细菌,而对附生菌和内生真菌缺乏了解,这阻碍了对叶际微生物群落的认识[5-7]。因此,本文以杜仲叶为研究对象,对其叶内生及附生真菌多样性进行研究。
有研究指出,环境因素对叶际微生物群落结构具有重要影响[8]。魏亚情发现叶际真菌群落表现出显著的生物地理格局,且叶际真菌群落的主要驱动因子包括年均温、年均降水量等气候因素[9]。另外,沉水植物叶际微生物的群落结构与周围环境如温度、光照等也有一定关系[10-11]。在年均温、年均降水量、温度、光照及土壤pH等环境因素方面,野生和人工种植条件存在较大差异,可能导致叶际微生物多样性及丰度不同。因此,本研究对野生和人工种植杜仲叶际真菌群落进行了差异分析。
叶际微生物赋予宿主有益功能的重要方式为通过合成一种或多种植物激素影响植物激素水平。据报道,吲哚-3-乙酸(IAA)是影响杜仲叶际微生物群落的两种关键植物激素之一,在调控其群落组成、多样性和功能上发挥重要作用[12]。IAA是一种典型的植物生长促进激素,已被广泛报道可由叶际微生物合成产生。如,潘明凯研究发现柑橘叶际微生物克雷伯氏菌Klebsiella表现出较强的IAA分泌能力[13]。梁淑雅等从苦草根、叶际附生细菌中筛选得到11株产IAA菌[14]。刘元等研究发现,怀山药内生真菌锐顶镰刀菌具有较强的IAA分泌能力,可能对宿主植物具有一定的促生作用[15]。叶际微生物,尤其是叶际真菌与植物的健康和生长密切相关,并且作为一种新兴的微生物资源,在农业和医药等领域的生产应用方面具有巨大的发展空间[16]。
综上所述,本研究通过传统分离培养、形态鉴定以及分子鉴定等方法对杜仲叶附生及叶内生真菌群落组成及差异、多样性进行探究,并对杜仲叶际真菌的生态功能进行注释。同时,筛选出能够产IAA的具有促生长活性的菌株,以期为今后杜仲的栽培管理提供重要信息,并积累具有开发利用价值的功能菌株资源。
1材料与方法
1.1样品的采集与处理
从贵州大学西校区(26°25′N,106°40′E)选取4棵健康的野生杜仲树和4棵健康的人工种植杜仲植株,剪取健康无病斑的新鲜叶片若干,编号后置于无菌保鲜袋中,放入4 ℃冰箱保存备用。
称取采集的野生和人工种植的杜仲叶片各2 g分别置于烧杯中,依次用无菌蒸馏水对杜仲叶片进行冲洗,除去叶片表面的尘土颗粒,备用。
本研究各试验样本为野生杜仲叶附生菌株样本(WP)、野生杜仲叶内生菌株样本(WE)、人工栽培杜仲叶附生菌株样本(PP)、人工栽培杜仲叶内生菌株样本(PE)。
1.2叶附生和内生真菌的分离、纯化及保种
1.2.1叶附生真菌的分离
叶面附生微生物的分离采用平板稀释法[17]。将处理好的2 g叶片,放入盛有50 mL灭菌水的三角瓶中,放入振荡器上,恒温25 ℃下,以130 r/min振荡30 min,即制成菌悬液母液,然后用无菌水稀释成10-1、10-2梯度的菌悬液,分别取10-1、10-2两个梯度的菌悬液200 μL均匀涂布于两种培养基平板,每个梯度重复三次,然后置于25~28 ℃培养箱中培养3~5天。
1.2.2叶内生真菌的分离
将叶片组织从上述三角瓶中取出,在无菌操作台上,用70%酒精处理2~3 s,然后用3.5%的次氯酸钠溶液处理3~4 min,再用无菌水漂洗4~5次,每次处理1 min以上,然后用灭菌滤纸吸干组织表面水分。将最后一次洗涤液按100 μL/皿涂布于各分离培养基平板,并置于恒温培养箱中,数天后若未发现培养皿中有菌落生长,则证明叶面灭菌操作合格,灭菌彻底,若皿中有菌落出现,则重复灭菌操作[17]。
内生微生物的分离采用匀浆平板稀释分离法[18]。将表面消毒的叶片组织用无菌剪刀剪碎,避免用手接触叶表,放入灭好菌的研钵中,加入无菌水定容至10 mL,研磨至浆状,得到10-1稀释倍数的样品悬浮液,继而将样品悬浮液稀释成10-2倍的稀释液,由此得到100、10-1、10-2倍三个梯度的稀释液,然后从每个梯度的稀释液中各取200 μL涂布于备好的马铃薯葡萄糖培养基(PDA)平皿上,各梯度均设置三个平行,置于25~28 ℃培养箱中培养5~7天。
1.2.3菌株的纯化及保种
待菌丝长出后,用接种针挑取适量菌丝转接到新的PDA平板上,获得纯培养菌株。待菌株完成逐步纯化后将其接入装有30%甘油的冻存管中,放于4 ℃冰箱临时保藏,或-80 ℃超低温冰箱中进行长期保藏[19]。
1.3菌株的形态学鉴定
将分离得到的真菌菌株接种在PDA平板上,在25 ℃恒温箱培养7~14天后,观察、记录其菌落特征,如颜色、形态、质地,并测量菌落直径[20]。制片后在普通光学显微镜下观察其菌丝形态,测量并记录其孢子形状、大小及分生孢子梗的形态和排列方式等。根据记录的数据,查阅真菌学专业文献资料,对比菌种特征,将菌株鉴定到属。
1.4菌株的分子鉴定
用灭菌刀片从PDA平板上取少量真菌菌株的菌丝和孢子于离心管中,并加适量研磨珠于细胞破碎仪进行研磨。按照真菌基因组DNA提取试剂盒(北京百泰克生物技术有限公司)的操作说明进行真菌DNA的提取,备用。PCR扩增所需引物均来自上海生工生物术有限公司,分别为ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)。
PCR反应体系为25 μL:Master Mix 12.5 μL,引物ITS1和引物ITS4分别为1 μL,DNA模板2 μL,ddH2O 8.5 μL。
PCR反应条件:94 ℃预变性 5 min,1个循环;94 ℃变性1 min;50 ℃退火1 min,72 ℃延伸1 min;进行35个循环,最后72 ℃延伸10 min。
PCR产物的检测:以DNA Marker DL2000为大小参照,分别将扩增产物与对照放入Parafilm薄膜和上样缓冲液中进行混合,在加入GenRed的0.8%的琼脂糖凝胶上进行点样,然后电泳40 min。在紫外光下,若荧光染料标记的DNA条带清晰,且与预期大小一致,则说明扩增成功。
DNA测序:将扩增产物送至昆明硕擎生物科技有限公司,并对待鉴定菌株的ITS序列进行序列测定,经BioEdit人工校对去除引物及双峰序列。登陆NCBI进行BLAST,在GenBank核酸序列数据库中进行同源序列搜索,BLAST结果相似度为99%以上的,确定为同一种,结合形态学特征进行种属鉴定[21-22]。
1.5产IAA菌株的筛选
将待测菌株接种到150 mL PDB液体培养基(马铃薯200 g,葡萄糖20 g,加蒸馏水至1 L,自然 pH,121 ℃ 灭菌 20 min)上进行培养(250 mL 锥形瓶,28 ℃,150 r/min)7 d,用移液枪吸取200 μL发酵液置白色坩埚内。1∶1加入标准比色液,每株菌试验设置3个平行;同时设置一组空白对照(未接种的PDB培养液)和一组阳性对照(按1∶1将200 μL吲哚-3-乙酸标准液(0.9 mg /L)与标准比色液混合),在暗处静置30 min后,观察其颜色变化。颜色不变为阴性,代表菌株不产IAA;颜色变成粉红或红色则为阳性,代表菌株产IAA。
1.6数据处理及分析
1.6.1叶际真菌的分离频率
本研究以分离频率(IF)界定可培养真菌群落的优势类群,将分离频率在10%以上的属定义为优势属。分离频率的计算公式为[23]
分离频率IF(%)=P/N×100%
式中:P为某一真菌分离株的总数;N为所有真菌分离株的总数。
1.6.2叶际真菌的群落组成与差异分析及生态功能注释统计分离得到的真菌在属水平上的分离频率,对其进行群落组成及差异分析。通过FUNGuilds数据库获得已鉴定的真菌类群的营养型及生态功能信息。通过Omicstudio、BioLadder-生物信息在线分析和派森诺基因云绘图平台分别绘制杜仲叶际真菌群落生态功能和组成的百分比柱状图、主成分分析图、比例韦恩图。
1.6.3叶际真菌的α多样性分析
本研究结合 Shannon-wiener与 Margalef 指数对各样本进行多样性分析,涉及的指数计算方法如下:
Shannon-wiener 多样性指数H=-Σ(Pi×ln(Pi))
Margalef 丰富度指数R=(S-1)/ln N
式中:Pi为第i种真菌菌株数与所有真菌分离株总数的比值;S为分离得到的真菌种类数;N为所有真菌分离株的总数。
2结果与分析
2.1野生和人工栽培杜仲叶际真菌群落组成及差异分析本研究以野生和人工栽培杜仲叶为样本,分离得到可培养真菌2门42属75种226株。不同来源的杜仲叶真菌群落的优势类群差异显著且各不相同。
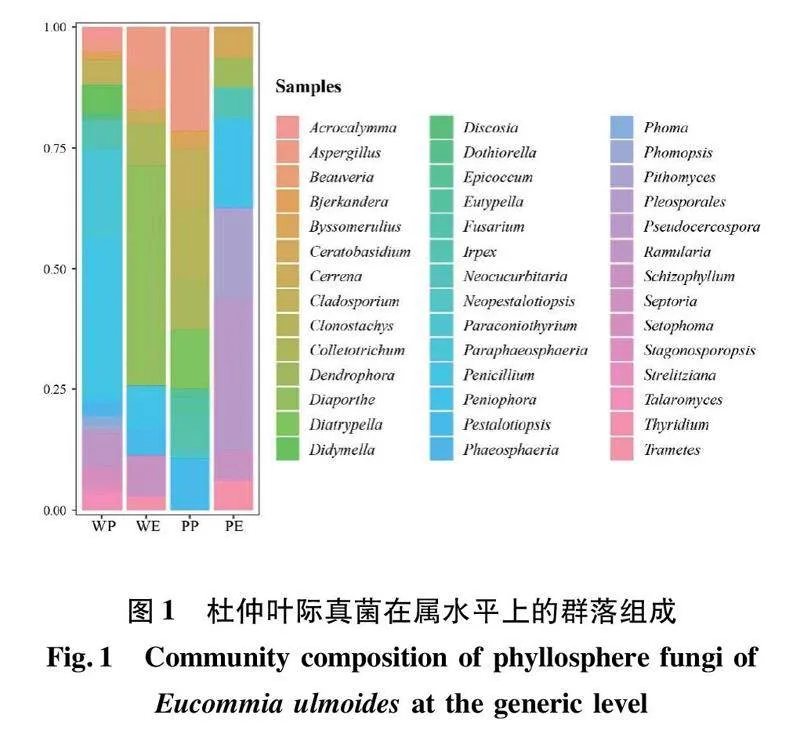
野生杜仲叶样本共分离获得附生真菌(WP)2门4纲11目18科25属35种119株。其中,子囊菌门Ascomycota是主要的优势类群。纲水平上,座囊菌纲Dothideomycetes、散囊菌纲Eurotiomycetes是优势纲,分离频率分别为50.42%和37.82%。其次是伞菌纲Agaricomycetes(8.40%)和粪壳菌纲Sordariomycetes(3.36%)。属水平上,青霉属Penicillium(31.93%)是优势属。其次是近暗球腔菌属Paraphaeosphaeria(17.65%)、长隔孢属Ramularia(6.72%)、亚隔孢壳属Didymella(5.88%)、枝孢菌属Cladosporium(5.04%)、耙齿菌属Irpex(5.04%)、棘壳孢属Setophoma(3.36%)、Acrocalymma(2.52%)、球腔菌属Phaeosphaeria(2.52%)、曲霉属Aspergillus(2.52%)和篮状菌属Talaromyces(2.52%)等。其余属的分离频率都在1%左右(图1)。
野生杜仲叶样本共分离获得内生真菌(WE)2门3纲8目9科10属15种35株其中,子囊菌门为真菌优势类群。纲水平上,粪壳菌纲(68.57%)和伞菌纲(20.00%)为优势纲。其次是散囊菌纲(11.43%)。属水平上,其优势属是间座壳属Diaporthe(45.71%),其次是裂褶菌属Schizophyllum(8.57%)、炭疽菌属Colletotrichum(8.57%)、白僵菌属Beauveria(8.57%)、曲霉属(8.57%)、隔孢伏革属Peniophora(5.71%)、拟盘多毛孢属Pestalotiopsis(5.71%)、下皮黑孔菌属Cerrena(2.86%)、栓菌属Trametes(2.86%)和青霉属(2.86%)(图1)。
人工栽培杜仲叶样本共分离获得附生真菌(PP)2门4纲7目9科11属15种56株。其中,子囊菌门为主要优势菌群。纲水平上,粪壳菌纲(60.71%)和散囊菌纲(21.43%)是优势纲。其次是座囊菌纲(14.29%)和伞菌纲(3.57%)。属水平上,其优势属是曲霉属,分离频率为21.43%,其次是螺旋聚孢霉属Clonostachys(14.29%)、假蕉孢壳属Diatrypella(12.50%)、枝孢菌属(12.50%)、拟盘多毛孢属(10.71%)、炭疽菌属(10.71%)、镰刀菌属Fusarium(7.14%)、絮干朽菌属Byssomerulius(3.57%)、弯孢聚壳属Eutypella(3.57%)、新拟盘多毛孢属Neopestalotiopsis(1.79%)和附球霉属Epicoccum(1.79%)(图1)。
人工栽培杜仲叶样本共分离获得内生真菌(PE)2门2纲7目8科8属10种16株。其中,子囊菌门和担子菌门Basidiomycota为优势菌群。纲水平上,伞菌纲和座囊菌纲,分离频率均为50.00%,是优势纲。属水平上,假尾孢菌属Pseudocercospora(31.25%)为优势属。其次是隔孢伏革菌属(18.75%)、皮司霉菌属Pithomyces(18.75%)、角担菌属Ceratobasidium(6.25%)、裂褶菌属(6.25%)、栓菌属(6.25%)和耙齿菌属(6.25%)等(图1)。
野生杜仲叶(W)共分离出真菌154株,隶属于2门4纲14目24科31属。在属水平,如图2(a)所示,主要包括青霉属、近暗球腔菌属、间座壳属、长隔孢属和亚隔孢壳属等19个优势属,其中,青霉属(25.32%)、近暗球腔菌属(13.64%)和间座壳属(10.39%)占有绝对优势,为主要优势属。
人工栽培杜仲叶(P)共分离出真菌72株,隶属于2门4纲12目16科19属。在属水平,如图2(a)所示,主要包括曲霉属(16.67%)和螺旋聚孢霉属(11.11%)等19个优势属。
野生和人工栽培杜仲叶共分离到叶附生真菌(P)175株,隶属于2门4纲13目22科33属。在属水平,如图2(b)所示,主要包括青霉属(21.71%)、近暗球腔菌属(12.00%)和曲霉属(8.57%)等21个优势属。
野生和人工栽培杜仲叶共分离到内生真菌(E)51株,隶属于2门4纲12目14科15属。在属水平,如图2(b)所示,主要包括间座壳属(31.37%)、隔孢伏革菌属(9.80%)和假尾孢菌属(9.80%)等15个优势属,其中,间座壳属(26.07%)为主要优势属。
由主成分分析图3(a)可知,第一主成分(PCA1)的方差贡献率为30.11%,是主要特征,第二主成分(PCA2)的方差贡献率为28.04%,是次要特征,累计方差贡献率为58.15%。WP、WE、PP和PE这4个样本在两个主成分轴上呈现为4组,说明4样本之间真菌群落具有显著差异。
Venn图显示如图3(b),野生和人工栽培杜仲叶际及内生可培养真菌群落不具有共有属,互相之间差异明显。不同生境不同区位杜仲叶样本都存在一定数量的独有真菌类群。例如,野生杜仲叶样本中,内生(WE)真菌群落有3个独有类群,依次为白僵菌属、下皮黑孔菌属和间座壳属。人工栽培杜仲叶内生(PE)真菌群落具4个独有类群,依次为角担菌属、Dendrophora、皮司霉菌属和假尾孢菌属。人工栽培杜仲叶附生(PP)真菌群落具7个独有类群,依次为絮干朽菌属、螺旋聚孢霉属、假蕉孢壳属、附球霉属、弯孢聚壳属、镰刀菌属和新拟盘多毛孢属。野生杜仲叶附生(WP)真菌群落独有类群最为丰富,多达19个属,分别为:Acrocalymma、黑管菌属Bjerkandera、亚隔孢壳属、双毛壳孢属Discosia、小穴壳菌属Dothiorella、新葫芦科菌属Neocucurbitaria、拟盾壳霉属Paraconiothyrium、近暗球腔菌属、球腔菌属、茎点霉属Phoma、拟茎点霉属Phomopsis、Pleosporales、长隔孢属、Septoria、棘壳孢属、壳多孢菌属Stagonosporopsis、横断孢属Strelitziana、篮状菌属和Thyridium。
2.2野生和人工栽培杜仲叶真菌群落多样性
微生物群落的多样性指数是用来量化和比较不同样本中微生物种类数量和丰度的统计量。Shannon-wiener 指数(香农-维纳指数)是群落多样性指数,它综合考量群落中物种的丰富度(物种数量)和均匀度(每个物种的相对丰度)。它的数值越大,表示群落生物多样性越高[24]。Magalef丰富度指数不考虑相对丰度,仅关注群落的丰富度,因此指数值越高,表示观察到的物种越多,群落的物种丰富度也就越高[25]。
如表1所示,Shannon-wiener和 Margalef 指数的顺序均为由高到低,表现为野生附生(WP)gt;人工附生(PP)≥野生内生(WE)gt;人工内生(PE)。这一结果表明,野生杜仲叶附生(WP)真菌群落最为丰富,其次是人工栽培杜仲叶附生(PP)和野生杜仲叶内生(WE)真菌群落,多样性最低的是人工栽培杜仲叶内生(PE)真菌群落。结果还表明,野生(W)较人工栽培(P)杜仲叶真菌群落更为丰富;杜仲叶附生(P)较内生(E)真菌群落更为丰富。
2.3杜仲叶际真菌群落功能分析
使用FUNGuilds平台对杜仲叶际真菌类群的营养型和生态功能类群进行分析(图4)。其中,20个物种被成功注释,营养型包括病原型(Pathotroph)(24.42%)、病原-腐生型(Pathotroph-Saprotroph)(24.42%)、共生型(Symbiotroph)(12.79%)、病原-共生型(Pathotroph-Symbiotroph)(38.37%)4大类。除未定义功能类群(Undefined functional group),所有真菌类群涉及植物病原菌群(Plant Pathogen)(11.63%)、动物病原菌群(Animal Pathogen)(12.79%)、内生菌群(Endophyte)(12.79%)以及多种混合功能类群如动物病原菌群-未定义腐生菌群(Animal Pathogen-Undefined Saprotroph)(3.49%)、内生菌群-附生菌群-植物病菌群(Endophyte-Epiphyte-Plant Pathogen)(24.42%)、动物病原菌群-内生菌群-木腐菌群(Animal Pathogen-Endophyte-Wood Saprotroph)(3.49%)、动物病原菌群-植物病原菌群-木腐菌群(Animal Pathogen-Plant Pathogen-Wood Saprotroph)(3.49%)、内生菌群-地衣寄生菌群-植物病原菌群(Endophyte-Lichen Parasite-Plant Pathogen)(1.16%)、植物病原菌群-木腐菌群(Plant Pathogen-Wood Saprotroph)(13.95%)、内生菌群-植物病原菌群(Endophyte-Plant Pathogen)(12.79%)10类。55个物种在FUNGuilds数据库中未能注释到对应功能。整体来看,野生杜仲叶际真菌功能群主要集中于内生菌群-附生菌群-植物病原菌群、内生菌群-植物病原菌群、动物病原菌群,人工栽培杜仲叶际真菌功能群则主要为植物病原菌群-木腐菌群和动物病原菌群,且在野生杜仲叶上的内生真菌数量显著高于人工栽培杜仲。
2.4产IAA菌株筛选及能力评估
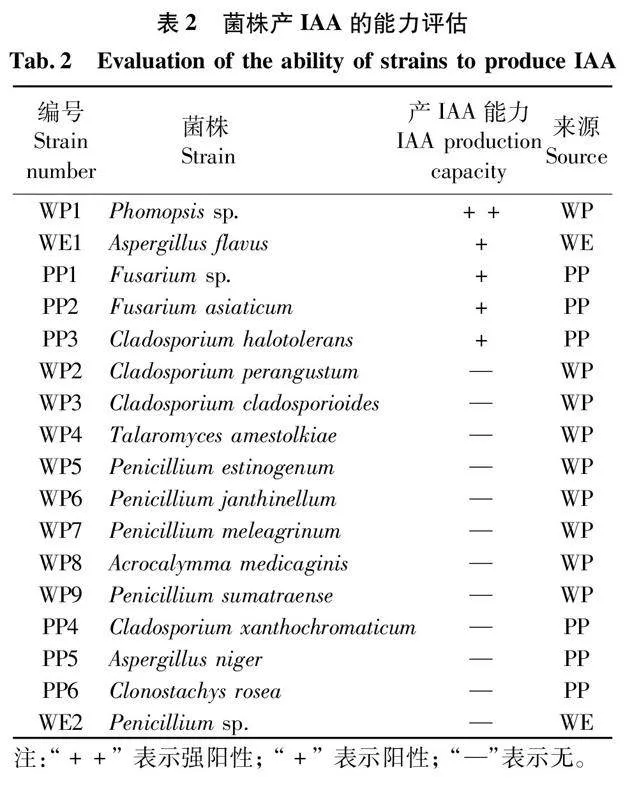
从野生及人工栽培杜仲叶中共分离75种真菌,如表2所示,只有拟茎点霉属一未定种Phomopsis sp.,黄曲霉Aspergillus flavus,镰刀菌属一未定种Fusarium sp.,亚洲镰刀菌Fusarium asiaticum和深海真菌耐盐枝孢Cladosporium halotolerans能够产IAA,其中,有3种属于人工栽培杜仲叶附生真菌,1种属于野生杜仲叶附生真菌,1种属于野生杜仲叶内生真菌。由表可知,拟茎点霉属一未定种Phomopsis sp.具有显著阳性颜色反应,产IAA能力最强,高于其他4个菌株。
3讨论
本研究从群落组成、多样性及生态功能等方面对比分析了野生和人工栽培杜仲叶际真菌群落。采用传统培养法、匀浆平板稀释分离法对野生和人工栽培条件下的杜仲叶际真菌群落进行培养、分离和纯化。
结合形态学和分子生物学方法,对分离获得的真菌菌株进行鉴定,确定其在各分类单元上的分类地位。结果表明,从野生和人工栽培杜仲叶共分离真菌226株,分属于42属75种。在野生杜仲叶附生真菌(WP)优势属为青霉属(32.48%)。符合以往研究结果即:青霉属真菌是自然界中最大的真菌种属,也是自然界中最常见的真菌。青霉属真菌中报道了许多具有抗菌、抗肿瘤、抗病毒等活性的次级代谢产物,是药物先导化合物的重要来源。其中,青霉素作为抗菌药物在医学领域有十分广泛的应用。此外,环孢菌素作为一种免疫抑制剂,常用于器官移植后的抗排异反应治疗;他汀类药物则可用于降低降胆固醇药水平[26-27]。
在野生杜仲叶附生真菌(WP)中发现特有属:拟茎点霉属。其有性态为子囊菌门的间座壳属,这类真菌不仅会导致多种植物的叶斑病,还会引起茄子果实的褐纹病,是引起植株产量降低和植株落败的关键因素。林宇等人观察到一些非洲楝的叶片出现较严重的叶斑病,通过显微镜观察,他们将叶斑病的发生归因于拟茎点霉属真菌的感染,并将这种叶斑病命名为非洲楝拟茎点霉叶斑病[28]。中国真菌志:拟茎点霉属中有楝拟茎点霉Phomopsis abdita引起的楝树枝枯病的记载[29]。SUN等证明了间座壳属和拟茎点霉属病原菌复合体对大豆具有致病性[30]。野生杜仲叶内生真菌(WE)优势属为间座壳属,分离频率为45.71%,属于植物病原菌。
人工栽培杜仲叶附生真菌(PP)优势属为曲霉属,分离频率为21.43%。曲霉属真菌在自然界中广泛存在,并可应用于多个领域。曲霉属真菌的某些类群能产生对昆虫有毒的化合物。据COLE等报道,一株杂色曲霉Aspergillus versicolor可产生杂色酰亚胺,这种化合物对某些昆虫的成虫有毒杀和熏蒸作用[31]。因此,这类真菌可在农林害虫的生物防治策略中成为潜在的工具。另外,在人工栽培杜仲叶附生真菌(PP)中的一特有属镰刀菌属,能分泌多种毒素,可导致作物减产和品质下降,同时也可能对人和动物的健康构成威胁[32]。人工栽培杜仲叶内生真菌(PE)优势属为假尾孢菌属,分离频率为31.25%。尾孢类真菌是植物病原菌,也是其他植物病原菌知名的重寄生菌,一些种已用于有害杂草的生物防治,是一类具有重要经济意义的真菌[33]。假尾孢属是尾孢类真菌中世界性植物病原真菌的大属,在热带和亚热带环境中造成谷类、果蔬、林木、药材等植物的叶斑、疫病、果斑和果腐,致使叶片枯死,过早脱落或造成落花、落果[34]。
结合Shannon-wiener和Margalef这2个微生物群落多样性指标的分析结果来看,在属水平上,野生杜仲叶附生(WP)真菌群落多样性最高,这可能是因为野外生态环境复杂多变,植物微生物与周围环境中的微生物存在交换,从而导致其真菌群落更为丰富;其次是人工栽培杜仲叶附生(PP)真菌群落。这一结果的出现,可能是由于野生杜仲叶面积远大于人工栽培杜仲,叶面积越大,允许栖息的微生物种类和数量越多。张曼研究发现,紫苏等8种药用植物的叶面积与部分附生真菌的物种多度显著正相关[35]。目前很多研究是针对植物内生真菌,未来或可对植物附生真菌群落投入更多关注。叶附生真菌较内生真菌多样性更高,这与AGLER等的研究结果“与内生微生物群相比,叶附生微生物群似乎更加多样和丰富”一致[36]。此外,野生和人工栽培杜仲叶真菌群落共有属比例低,具有显著的空间异质性,这可能是由于真菌对不同环境的选择偏好形成了不同的群落模式[37]。
在群落功能预测中,在杜仲叶上存在一定种类和数量的腐生型真菌,这些真菌被认为具有降解木质素、纤维素和半纤维素的能力,其可能参与凋落物的分解,释放大量矿物质养分归还到土壤,供绿色植物吸收利用[38]。另外,部分真菌还被注释为内生真菌,这些类群有较强的适应能力,可促进宿主植物生长、土壤养分吸收与利用、改善土壤环境微生物群落结构。然而,也注释到多种动植物病原菌,如枝孢样枝孢霉Cladosporium cladosporioides会导致柑橘果实腐败[39]。因此,揭示杜仲叶际真菌群落组成和功能是了解植株健康以及后续人为调整微生物菌群增强植物健康、提高作物产量和质量的先决条件。
本实验筛选得到拟茎点霉属一未定种Phomopsis sp.、黄曲霉Aspergillus flavus等5个具有产IAA活性的菌株,其中Phomopsis sp.的能力最为显著。SHAO[12]等报道吲哚-3-乙酸和异戊烯基腺嘌呤这两种激素是影响杜仲叶际微生物群落的关键植物激素,在调控其群落组成、多样性和功能上发挥重要作用。因此,在杜仲的种植过程中,适当加含产吲哚-3-乙酸微生物的菌肥,通过植物-微生物相互作用实现植物生长正向调控,可能更有利于杜仲产量及品质的提升。
综上所述,在野生和人工栽培条件下的杜仲叶际真菌群落差异显著,这对优化农业实践和提升药材杜仲的质量有重要意义。掌握其中的变化趋势以及主要影响因素,能够帮助人们通过调控微生物群落来提高杜仲的药用价值,也能为其野生资源保护和人工培育提供理论依据。除此之外,利用筛选到的产生长素菌株制成复合型菌肥,在杜仲生长过程中进行人工干预,或可促进杜仲更好更快生长,进而促进杜仲相关产业发展。药用植物杜仲叶际真菌多样性丰富,有大量尚待开发利用的微生物资源,有望成为解决杜仲资源与市场需求矛盾的关键替代物。参考文献:
[1]向智, 李焕杰, 谌鑫阳, 等. 药食同源植物杜仲化学成分、药理作用及产品开发的研究概况[J]. 中国实验方剂学杂志, 2024, 30(2): 190-202.
[2] 杨娟, 董醇波, 陈万浩, 等. 不同地区杜仲树皮内生真菌群落组成及生态功能结构的差异分析[J]. 中国中药杂志, 2019, 44(6): 1126-1134.
[3] DONG C B, YAO T, ZHANG Z Y, et al. Structure and function of bacterial microbiota in Eucommia ulmoides bark[J]. Current Microbiology, 2020, 77(11): 3623-3632.
[4] 张青青, 董醇波, 邵秋雨, 等. 杜仲种子内生微生物群落组成及生态功能分析[J]. 林业科学研究, 2023, 36(2): 50-60.
[5] 杨娟. 杜仲相关真菌群落组成及其对活性成分的影响[D]. 贵阳: 贵州大学, 2019.
[6] 孙微微. 杜仲内生真菌的分离鉴定及活性菌株在小麦中的定殖研究[D]. 合肥: 安徽农业大学, 2016.
[7] 王维. 茎点菌属SP-16F产松脂醇二葡萄糖苷的液体培养条件研究[D]. 杨凌: 西北农林科技大学, 2008.
[8] 徐爱玲, 蒋敏, 白萍萍, 等. 青岛城市公园3种植物叶表面颗粒物形态特征及叶际细菌群落结构[J]. 地球环境学报, 2023, 14(4): 458-471.
[9] 魏亚情. 橡胶树叶际微生物多样性空间分布格局及其机制[D]. 海口: 海南大学, 2023.
[10]何聃, 任丽娟, 邢鹏, 等. 沉水植物附着细菌群落结构及其多样性研究进展[J]. 生命科学, 2014, 26(2): 161-168.
[11]柳晓东, 朱海珍, 姜民志, 等. 北京龙形水系三种沉水植物根际及叶际微生物群落特征[J]. 生物工程学报, 2021, 37(10): 3663-3674.
[12]SHAO Q Y, RAN Q S, LI X, et al. Deciphering the effect of phytohormones on the phyllosphere microbiota of eucommia ulmoides[J]. Microbiological Research, 2024, 278: 127513.1-127513.10.
[13]潘明凯. 柑橘叶际肠杆菌功能活性及其耐药性研究[D]. 昆明: 昆明理工大学, 2022.
[14]梁淑雅, 崔陈陈, 胡思文, 等. 苦草附生细菌的分离鉴定及高效功能菌株筛选[J]. 中国环境科学, 2024, 44(5): 2630-2641.
[15]刘元, 刘淼, 阮元, 等. 怀山药内生真菌产3-吲哚乙酸能力检测[J]. 中成药, 2020, 42(9): 2517-2519.
[16]黄雪珍, 赵龙飞. 药用植物内生菌对宿主植物促生作用机制研究进展[J]. 微生物学通报, 2023, 50(4): 1653-1665.
[17]张丽娜. 山茶叶部微生物区系与灰斑病发生关系的研究[D]. 雅安: 四川农业大学, 2010.
[18]苏博.杜仲内生细菌在玉米中的定殖特征及强化抗病机制的研究[D]. 合肥: 安徽农业大学, 2017.
[19]杨娟, 董醇波, 陈万浩, 梁建东, 等. 不同地区杜仲树皮内生真菌群落组成及生态功能结构的差异分析[J]. 中国中药杂志, 2019, 44(6): 1126-1134.
[20]谭玉琴, 张红芳, 樊有赋, 等. 单叶蔓荆根际土壤真菌多样性[J]. 菌物研究, 2014, 12(4): 214-217.
[21]沈湛云, 朱波, 张泉龙, 等. 不同产地玄参内生真菌种群结构的比较分析[J]. 中草药, 2019, 50(4): 957-962.
[22]LANDEWEERT R, LEEFLANG P, KUYPER T W, et al. Molecular identification of ectomycorrhizal mycelium in soil horizons[J]. Applied and Environmental Microbiology, 2003, 69(1): 327-333.
[23]张芝元, 郑欢, 韩燕峰,等. 不同宠物狗体表一些部位角蛋白降解真菌物种多样性[J]. 菌物学报, 2017, 36(5): 563-572.
[24]康林玉, 王静, 刘周斌, 等. 土壤类型对辣椒根系和果实显微结构影响的研究[J]. 中国农学通报, 2017, 33(28): 73-80.
[25]康林玉. 不同类型土壤下辣椒的生长发育及辣椒种植对微生物的影响[D]. 长沙: 湖南大学, 2018.
[26]孙园园, 于豪冰, 翟祥宁, 等. 青霉属真菌次级代谢基因挖掘的研究进展[J]. 中国海洋药物, 2024, 43(1): 74-85.
[27]SEVDAMETOVA E, ZAINOL N. Morphological, physiological,biochemical and molecular characterizationof statin-producing Penicillium microfungi isolated from little-explored tropical ecosystems[J]. Curr Res Microb Sci, 2021, 2: 100044.1-100044.8.
[28]林宇, 李增平, 吴如慧, 等. 非洲楝拟茎点霉叶斑病病原菌鉴定及其生物学特性的测定[J]. 热带生物学报, 2019, 10(1): 34-40.
[29]戚佩坤, 姜子德, 向梅梅, 等. 中国真菌志:第34卷 拟茎点霉属[M]. 北京: 科学出版社,2007.
[30]SUN S, KIM Y M, CHAISAN T, et al. 在韩国引起大豆种腐病的拟茎点霉属Phomopsis/间座壳属Diaporthe[J]. 大豆科技, 2014(5): 5.
[31]COLE M, ROLINSON G N. Microbial metabolites with insecticidal properties[J]. Appl Microbiol, 1972, 24(4): 660-662.
[32]张卫娜, 贾谏, 陆晓宇, 等. 镰刀菌属真菌毒素的研究进展[J]. 广东农业科学, 2013, 40(15): 130-133.
[33]郭英兰. 尾孢类真菌研究进展[J]. 菌物研究, 2020, 18(4): 282-293.
[34]郭英兰. 中国羽叶楸上的羽叶楸假尾孢新种[J]. 菌物学报, 2017, 36(3): 275-277.
[35]张曼. 安国药用植物叶际附生微生物多样性研究[D]. 保定: 河北大学, 2023.
[36]AGLER T M, RUHE J, KROLL S, et al. Microbial hub taxa link host and abiotic factors to plant microbiome variation[J]. PLoS Biology, 2016, 14(1): 1002352.1-1002352.31.
[37]朱攀, 薛文凯, 李小燕, 等. 青藏高原垫状点地梅叶际及内生可培养微生物多样性[J]. 微生物学通报, 2023, 50(1): 13-34.
[38]贾梅花, 王哲, 刘金福, 等. 格氏栲天然林凋落物对马尾松种子萌发的影响[J]. 林业科学研究, 2021, 34(1): 128-136.
[39]解淑慧, 邵兴锋, 王可, 等. 柑橘采后腐烂主要致病菌的分离鉴定及丁香精油对其抑制作用研究[J]. 果树学报, 2013, 30(1): 134-139, 181.
(责任编辑:于慧梅)
Community Composition of Culturable Fungi in Eucommia Ulmoides
Phyllosphere and Screening of IAA-Producing Strains
QI Yinghua, ZHAO Yufeng, SONG Keyun, WANG Yanling, RAN Qingsong,
SHAO Qiuyu, DONG Chunbo, HAN Yanfeng*
(Institute of Fungus Resources, Guizhou University, Guiyang 550025, China)Abstract: As a unique medicinal plant in China, Eucommia ulmoides is widely distributed in Guizhou province. The phyllosphere microorganisms are of great significance for its growth. In order to reveal the community composition, diversity, and function of phyllosphere fungi in artificially cultivated and wild Eucommia ulmoides, and to screen strains with IAA-production activity, based on the traditional cultivation methods, the composition and diversity of endophytic fungal communities in Eucommia ulmoides phyllosphere was analyzed, and their function groups were annotated based on the FUNGuild database. As a result, a total of 226 fungal strains were isolated from E. ulmoides phyllosphere belonged to 2 phyla and 42 genera. Among them, 154 strains were from wild leaves, mainly including 19 dominant genera such as Penicillium (25.32%), and 72 strains were from artificially cultivated leaves, mainly including 19 dominant genera such as Aspergillus (16.67%). The functional annotation results showed that, except for undefined functional groups, fungal groups mainly involve Animal Pathogen (12.79%), Plant Pathogen Wood Saprotroph (13.95%) and Endophyte Epiphyte Plant Pathogen (24.42%). The fungal species composition of cultivated and wild Eucommia ulmoides was quite different. At the same time, this study also screened several bacterial strains producing IAA. This research will provide valuable microbial resources for the subsequent artificial regulation of E.ulmoides phyllosphere microbiota to enhance plant health, promote plant growth, and develop functional strains.
Key words: plant microbiota; phyllosphere fungi; diversity; ecological functions; indole-3-acetic acid

