Klebsiella oxytoca EN-B2高效转化羟胺和亚硝态氮的影响因素研究


摘要:羟胺和亚硝态氮对动植物具有毒害作用,并通过污染环境进一步危害人类健康。本研究以实验室前期分离获得的一株高效转化羟胺和亚硝态氮的克雷伯氏菌(Klebsiella oxytoca )为研究对象,探究不同环境因素对该菌株同时去除羟胺和亚硝态氮的影响。结果表明,在碳源为丁二酸钠,接菌量0.4×108 CFU、碳氮比(C/N)15、温度25 ℃、转速150 r/min和初始pH值8.0条件下,菌株EN-B2对羟胺、亚硝态氮、总氮的去除效率最高,去除率分别达到了99.42%、100.00%和87.76%。此外,本研究通过向亚硝态氮体系中添加不同浓度的羟胺,进一步探讨了羟胺对菌株EN-B2反硝化过程的影响。结果表明,当体系中羟胺浓度超过3 mg/L后,随着羟胺浓度的进一步增加,该菌株在相同时间下亚硝态氮去除速率降低。本研究有助于理解Klebsiella oxytoca EN-B2在羟胺和亚硝态氮混合体系中的除氮特性,为氮污染废水的处理工艺提供重要参考。
关键词:Klebsiella oxytoca;羟胺;亚硝态氮;环境因素
中图分类号:X523文献标志码:A随着农业和工业现代化进程的不断推进,氮肥的过度施用、未经恰当处理的工业废水排放和垃圾滤液的渗漏等问题日益严重[1],导致湖泊、水库和河流等水源遭受严重污染[2]。《中国生态环境状况公报》发布的2021年我国209个重要湖泊(水库)的营养状态监测报告显示,贫营养状态湖泊(水库)占10.5%,中营养状态占62.2%,轻度富营养状态占23.0%,中度富营养状态占4.3%[3]。其中,氮污染在水体富营养化中最为突出,污染物主要为铵、羟胺、硝态氮和亚硝态氮[4-6],其中,羟胺和亚硝态氮是硝化过程的中间产物[7-8],均具有极强的毒性。人体摄入过多羟胺和亚硝态氮易生成高铁血红蛋白从而诱发肝癌、食管癌以及胃癌[9]等疾病,严重威胁到人类公共卫生安全。
氮污染废水的处理技术主要包括物理法、化学法和生物法。其中,微生物驱动的生物脱氮工艺具备效率高、成本低和无二次污染等特点而备受关注,已成为污水处理厂主流的脱氮方式[10]。在生物脱氮过程中,羟胺的适量投放会对反应器脱氮效率及微生物生长具有一定的促进作用[11]。然而,羟胺排放到环境中会对植物造成危害,且过量的羟胺还会抑制微生物生长,进而降低脱氮效率[12]。研究高效转化羟胺的微生物有助于降低羟胺的毒害作用,其中,异养硝化-好氧反硝化(HN-AD)细菌的分离鉴定和生理特性等是目前的研究热点[13],如异养硝化-好氧反硝化细菌Klebsiella michiganensis MF1[14]和Klebsiella pneumoniae CF-S9[15]在单一氮源试验中均表现出良好脱氮特性,而对于HN-AD细菌在羟胺和亚硝态氮混合氮源中进行脱氮的相关研究较为缺乏。
本研究以实验室前期分离筛选获得的异养硝化-好氧反硝化菌株Klebsiella oxytoca EN-B2为研究对象,通过使用不同接菌量、碳氮比(C/N)、培养温度、溶解氧、碳源和初始pH值,探究了该菌株对羟胺和亚硝态氮混合体系的最佳去除条件。此外,通过控制体系中羟胺的添加量,揭示不同浓度的羟胺对EN-B2的亚硝酸盐去除能力的影响。本研究结果揭示了影响菌株EN-B2去除羟胺和亚硝态氮的关键因素,为生物脱氮工艺的优化提供科学指导。这些发现对耐羟胺菌株的研究和实际应用具有重要意义,以期为开发更高效的脱氮菌株和污水处理工艺的改进提供实用方案。
1材料与方法
1.1材料
1.1.1菌株来源
实验室前期已分离筛选的具备高效除羟胺性能的菌株Klebsiella oxytoca EN-B2[16]。
1.1.2培养基
LB液体培养基(g/L,pH 7.2):氯化钠10.0 g,酵母浸粉5.0 g,胰蛋白胨10.0 g。
培养条件优化培养基(g/L, pH 7.2): NaNO2 0.246 g,NH2OH·HCl 0.0496 g,KH2PO4 1.5 g,K2HPO4 3.5 g,MgSO4 0.04 g,GaCl2 0.014 g,Fe2(SO4)3 0.009 g,柠檬酸钠 3.676 g,丁二酸钠2.025 g,葡萄糖 2.252 g,蔗糖 4.278 g,乙酸钠1.625 g,酒石酸钾 3.528 g。
灭菌条件:121 ℃、0.11 MPa条件下加热灭菌30 min。
1.2培养条件对菌株EN-B2脱氮能力的影响
取1 mL甘油菌液接种于LB液体培养基中,置于摇床中活化36 h。将3 mL活化后的菌悬液转接至100 mL LB液体培养基中,进行48 h的扩大培养。将扩大培养后的菌悬液离心5 min(6 500 r/min,25 ℃),用40 mL灭菌超纯水洗涤2次,再用无菌水重悬菌体。调整菌密度D600值至0.5×108 CFU/mL,从而使菌株初始细菌浓度为0.5×108 CFU/mL,随后接种于优化培养基中,25 ℃下摇床振荡培养30 h后,取离心后的上清液于试管中,检测总氮、亚硝态氮、羟胺、D600、铵态氮、硝态氮、及pH值。羟胺采用8-羟基喹啉紫外分光光度法、亚硝态氮采用N-(1-萘基)-乙二胺分光光度法、铵氮采用靛酚蓝紫外分光光度法、硝态氮采用紫外分光度法和总氮采用碱性过硫酸钾消解紫外分光光度法[17]。
培养条件优化培养基以羟胺和亚硝态氮为混合氮源,分别设置不同的细菌浓度(0.2、0.3、0.4、0.5、0.6和7×108 CFU/mL)、C/N比例(5、10、15、20和25)、温度(5、10、15、20、25和30 ℃)、转速(0、50、100、150和200 r/min)、碳源种类(柠檬酸钠、丁二酸钠、葡萄糖、蔗糖、乙酸钠和酒石酸钾钠)和pH值(6.0、7.0、8.0、9.0和10.0),摇床培养30 h,分别检测0 h和30 h时培养基中的总氮、羟胺、亚硝态氮、铵态氮、硝态氮浓度、pH值和D600值,以此计算总氮、羟胺和亚硝态氮在30 h内的去除效率,氮去除率计算公式:Ef=(R1-R2)/R1[18](R1和R2分别表示初始氮浓度和最终氮浓度),进而评估不同因素对菌株EN-B2的生长及脱氮的影响,筛选菌株脱氮的最适培养条件。
1.3羟胺对菌株EN-B2去除亚硝态氮的影响
培养基中添加的初始亚硝态氮浓度固定为50 mg/L,设置羟胺浓度分别为0、1、3、5、7和9 mg/L。根据上述优化结果设置培养条件,每隔6 h取样测定D600值、亚硝态氮及总氮吸光度,无机氮去除率计算公式同1.2,计算羟胺和亚硝态氮的去除情况,从而评估羟胺对菌株EN-B2去除亚硝态氮的影响。所有试验均设置3个平行。
2结果与讨论
2.1接种量对菌株EN-B2脱氮的影响
接菌量的大小是影响菌株脱氮效率的重要因素之一,接种量过低会导致在一定时间内菌体密度较低,从而导致菌体脱氮效果不佳,但接种量过多反而会引起菌株竞争营养物质,导致细菌死亡从而降低脱氮效率[19]。因此,探究最适接菌量有助于提高菌株EN-B2的好氧反硝化脱氮效率,也能为实际应用提供参考。接菌量对菌株EN-B2脱氮性能的影响如图1(a)所示,当EN-B2的细菌浓度从0.2×108 CFU/mL逐渐增加至0.4×108 CFU/mL时,羟胺的去除率分别74.40%、86.52%和93.76%,亚硝态氮去除率分别为90.09%、97.82%和100.00%,总氮去除率分别为23.07%、62.06%和88.17%,D600值分别为0.29、1.24和1.24,此过程无铵态氮和硝态氮积累(图1(b))。表明在一定接种量范围内,相同作用时间和条件下,菌株接种量越大无机氮去除效果越好,这是因为接种量大,菌株产生的脱氮相关酶越多,氮去除效果越好,与邱晓帆[20]的研究结果一致。此外,随着接菌量的继续增加,总氮与羟胺去除率均呈现降低的趋势。当细菌浓度为0.5×108、0.6×108和0.7×108 CFU/mL时,羟胺的去除率为93.76%、88.74%和64.96%,总氮去除率分别为87.29%、83.47%和80.74%,D600值分别为1.27、0.59和0.28。结果表明过高的接种量抑制了菌株EN-B2的氮去除能力,这可能是由于培养基中营养物质缺乏不能满足菌株的生长繁殖所致,但亚硝态氮仍可被完全去除。可以看出在接菌量为0.4×108 CFU/mL时,菌株EN-B2对TN和羟胺的去除率最高,同时亚硝态氮的去除率也高达100.00%。与此同时,未检测到硝态氮和铵态氮的积累(图1(b))。结合羟胺去除率、亚硝酸盐去除率和总氮去除率,菌株EN-B2脱氮的最适接菌量被确定为0.4×108 CFU/mL。
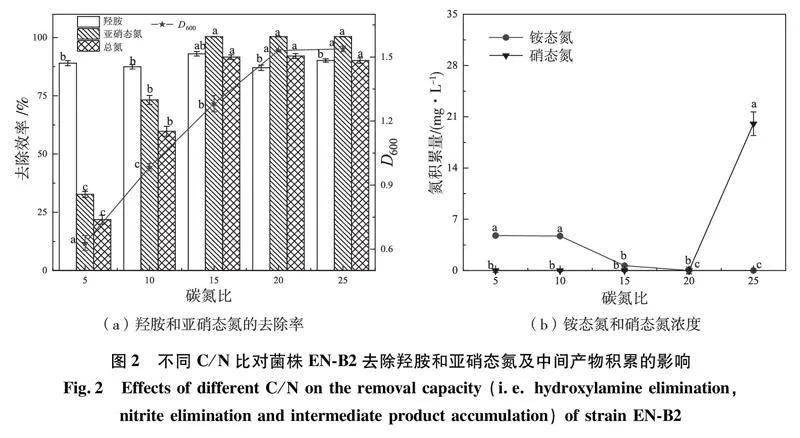
2.2C/N比对菌株EN-B2脱氮的影响
碳源和氮源是微生物生长和代谢的必需元素,碳源是微生物的结构单元和能量来源,而氮源则参与氨基酸、蛋白质和核酸的合成[21]。C/N比对微生物好氧反硝化过程具有极大的影响,当碳源的含量较低时,会导致细菌能量不足而死亡,影响反硝化效率[22],但实际应用过程中过高的碳源需求则会导致成本升高。
本研究对菌株EN-B2在不同C/N比条件下的羟胺和亚硝态氮去除率进行探究。结果如图2(a)所示,在C/N比为5时,菌株EN-B2在30 h内对羟胺、亚硝态氮和总氮的去除率分别为89.01%、32.68%和21.86%,当C/N比为10时,羟胺、亚硝态氮和总氮的去除率分别为87.46%、73.25%和59.79%,当C/N为15、20和25时,亚硝态氮被完全去除,表明较高的C/N比促进了菌株EN-B2的亚硝态氮去除。随着C/N比的增加,羟胺去除率从C/N比为15时的93.03%降至C/N比为20时的87.04%,但当C/N比提升至25时去除率升至90.15%。总氮去除率从C/N比为15时的91.61%提升到C/N比为20时的最大值92.06%,但当C/N比上升至25时,总氮的去除率降至90.14%,考虑到C/N比为15和20时亚硝态氮去除效率和总氮去除率接近,且均达到91%以上,且此时铵态氮和销态氮的积累量较低(图2(b)),同时羟胺去除率在C/N比为15时最大。因此综合成本、羟胺去除率、亚硝态氮去除率和细胞生长速率等多种因素,确定菌株EN-B2去除亚硝态氮的最适C/N比为15。本研究的结果与菌株Acinetobacter sp. T1[23](最佳C/N比为10)和菌株Alcaligenes faecalis TF-1[24](最佳C/N比为16)的研究结果均不一致,表明不同菌株脱氮的最佳C/N比具有差异性,筛选最佳C/N比对于优化菌株脱氮性能具有重要意义。
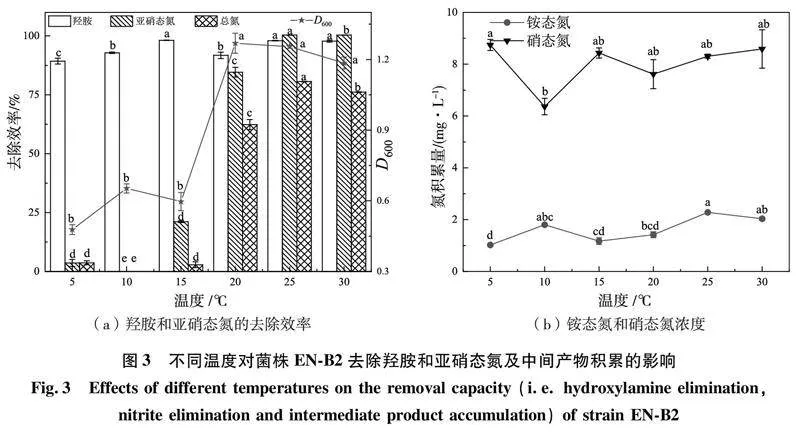
2.3温度对菌株EN-B2脱氮的影响
温度是影响脱氮过程的关键因素之一,其主要通过影响脱氮关键酶活性来影响菌株的氮代谢效果。本研究以亚硝态氮和羟胺制备混合氮源,探究菌株EN-B2在不同温度下的氮去除能力。结果如图3所示,在20~30 ℃的温度范围内,菌株EN-B2均能正常生长,且具备去除羟胺和亚硝态氮的能力。当温度从5 ℃升高到15 ℃,该菌株对羟胺的去除率从89.31%逐渐升高至98.12%,而亚硝态氮去除率从3.60%降至0.00%后又升至21.09%,此时铵态氮浓度从1.02 mg/L小幅升至1.17 mg/L,硝态氮浓度从8.74 mg/L降至6.36 mg/L后又升至8.43 mg/L。当温度升至20 ℃时,菌株EN-B2的亚硝态氮和总氮去除率大幅度上升,分别达到了84.59%和62.33%,羟胺的去除率为91.77%,此时铵态氮和硝态氮浓度分别为1.42 mg/L和7.62 mg/L。随着温度的进一步升高,亚硝态氮和总氮去除率均在25 ℃时达到最高,分别为100.00%和80.63%,羟胺去除率为98.00%,此时铵态氮积累处于较低水平为2.28 mg/L,而硝态氮为8.31 mg/L。
综合不同温度下亚硝态氮、羟胺和总氮的去除效率,菌株EN-B2生长及去除羟胺和亚硝态氮的最佳温度为25 ℃。在5~15 ℃内,仅羟胺的去除效率处于较高水平,而亚硝态氮和总氮的去除效率极低,且温度越低,氮去除效率越低,推测原因为脱氮过程的关键酶活性在低温条件下受到一定的抑制,这与菌株Acinetobacter sp.ND7[25]和Acinetobacter calcoaceticus TY1[26]的结果相似。
2.4溶解氧对菌株EN-B2脱氮的影响
溶解氧是同步硝化反硝化过程的重要影响因素[27],其作为反硝化过程的电子受体,不同水平的溶解氧会对细菌的脱氮效率产生不同的影响[28],为探究溶解氧对菌株EN-B2脱氮作用的影响,本研究分别设置溶解水平为0、50、100、150和200 r/min。如图4(a)所示,随着溶解水平从0 r/min增加到100 r/min,菌株EN-B2对羟胺的去除率由90.51%升至93.43%,而亚硝态氮和总氮的去除率分别从0.00%和0.00%大幅增至100.00%和85.21%,当溶解水平增加至150 r/min时,总氮、羟胺以及亚硝态氮的去除率均达到峰值,分别为85.58%、97.05%和100.00%,表明菌株EN-B2对总氮降解能力在一定范围内随着转速的提高而增强。然而,当转速增加到200 r/min时,总氮的降解率有所下降,可能是由于较高的转速对细菌活性产生了不良影响。上述结果表明,溶解氧对菌株EN-B2的羟胺与亚硝态氮去除能力具有较大影响,而该菌株去除混合氮源的最适溶解氧水平为150 r/min。
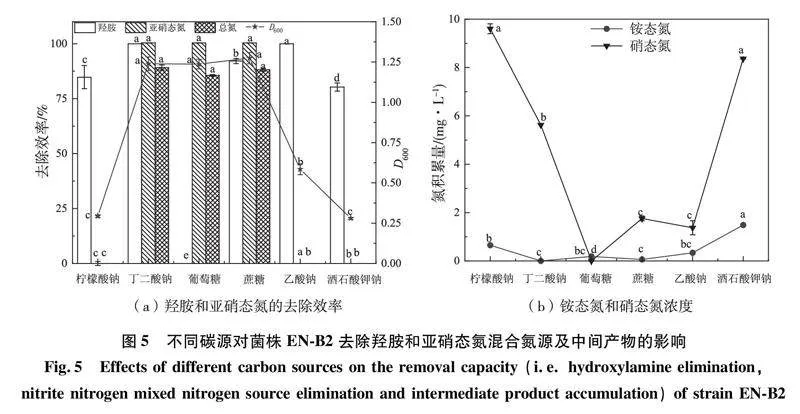
2.5 碳源对菌株EN-B2脱氮的影响
不同的碳源通常具有不同的化学结构和分子量,并且能作为生物脱氮过程中的电子供体和能量来源,通常结构较简单、分子量小的碳源更容易被微生物利用[29]。本研究探索了不同碳源对菌株EN-B2去除羟胺与亚硝态氮的影响。如图5(a)所示,碳源对菌株EN-B2去除混合氮具有显著的影响。以葡萄糖作为碳源时,菌株EN-B2对羟胺的去除率几乎为零,而对亚硝态氮和总氮的去除率分别为100.00%和85.21%;而以柠檬酸钠、乙酸钠和酒石酸钾钠为碳源时,菌株EN-B2在30 h内对亚硝态氮和总氮的去除率几乎为零,对羟胺的去除率分别为84.78%、100.00%和80.28%,且它们为碳源时细菌生长最缓慢;当以丁二酸钠和蔗糖为碳源时,菌株对羟胺、亚硝态氮、总氮均具有去除能力,效率分别为100.00%、100.00%、89.13%和92.12%、100.00%、88.15%。且以丁二酸钠为碳源时,无铵态氮的积累,硝态氮为5.62 mg/L(如图5(b))。以上结果表明,菌株EN-B2可以利用不同碳源去除羟胺与亚硝态氮,尤其是以丁二酸钠作为碳源时,羟胺、亚硝态氮和总氮的去除率均最高,因此,丁二酸钠是菌株EN-B2去除硝态氮的最适碳源。试验结果表明不同碳源对菌株EN-B2去除羟胺、亚硝态氮和总氮有不同程度的影响,推测其原因是微生物对不同分子量和结构的碳源的利用存在一定的偏好性[30],使得微生物在不同碳源下表现出不同的生长情况和氮去除特性。
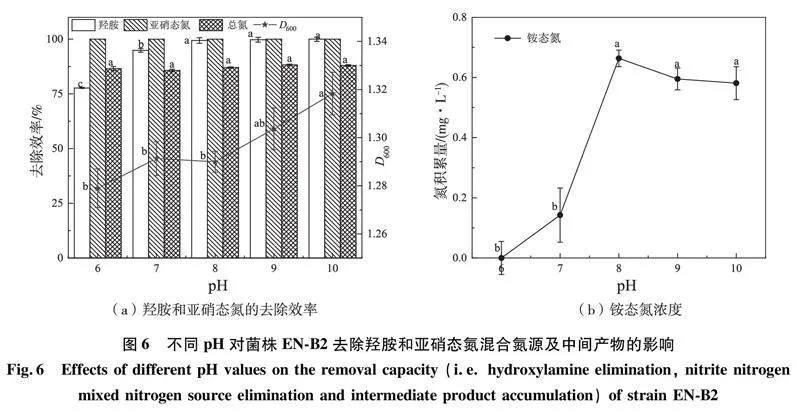
2.6初始pH值对菌株EN-B2脱氮的影响
pH值在微生物的生长和代谢中起着至关重要的作用,通常细菌在不适的pH环境中会导致菌体中多种酶的活性降低,从而降低微生物的代谢能力[31]。因此,探究初始pH值与菌株EN-B2转化羟胺与亚硝态氮的关系非常重要。如图6(a)所示,不同初始pH值条件对菌株EN-B2的羟胺、亚硝态氮和总氮去除效率均有影响。当初始pH值控制在6.0、7.0、8.0、9.0和10.0时,亚硝态氮均被完全去除,羟胺的去除率分别为77.71%、94.92%、99.42%、99.74%和99.98%,总氮去除率分别为86.49%、85.72%、87.08%、88.25%和87.98%,无硝态氮的积累且铵态氮的积累处于较低水平(如图6(b)),表明菌株EN-B2具有较大的pH值适应范围,这与LEI等人[32]的研究结论一致。碱性环境比酸性环境更有利于菌株EN-B2除氮,当pH值为8.0、9.0和10.0时,其总氮、羟胺和亚硝态氮的去除效率较pH为6.0时更高,综合经济成本、实际环境条件,确定菌株EN-B2菌株EN-B2是一种喜碱性细菌,其进行生长繁殖及脱氮作用的最适pH值为8.0。
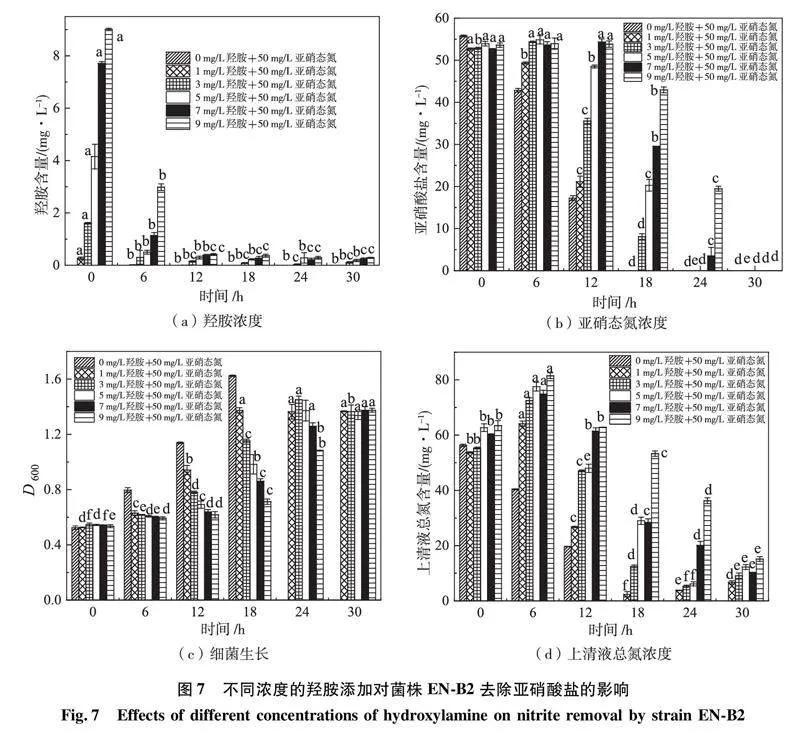
2.7羟胺对亚硝态氮去除的影响
羟胺是一种抑制剂[33],具有极强的毒性,其不仅对植物的生长繁殖会产生毒害作用,同时还会通过抑制微生物的生长,从而降低微生物的脱氮效率[34],使得污水脱氮处理达不到理想效果。
为研究羟胺对菌株EN-B2去除亚硝态氮的影响,将不同浓度的羟胺添加到含有50 mg/L亚硝态氮的培养基中,每隔6 h取样检测培养基中羟胺和亚硝态氮浓度。结果如图7(a)和(b)所示,当初始羟胺浓度分别为0和1 mg/L时,6 h时,亚硝酸盐的去除效率分别为25.18%和6.34%,此时羟胺浓度分别为0.00 mg/L和0.02 mg/L,而在初始羟胺浓度大于3.0 mg/L时,亚硝态氮的浓度均略微上升。菌株培养至12 h时,在0和1 mg/L的羟胺浓度下,亚硝酸盐的去除率分别增至69.19%和59.90%,此时羟铵均完全去除,同时在3 mg/L的羟胺作用下,亚硝酸盐也出现了去除的现象,但去除效率仅为32.70%,而5、7和9 mg/L 的羟胺严重抑制了亚硝酸盐的去除。由图7(b)和(c)可知,在12~18 h,羟胺浓度和菌株生长呈现反比关系,这与李健弟[11]、WANG[35]和LI等人的[36]研究结果一致,均显示羟胺的添加会导致亚硝态氮的积累量增加,表明亚硝态氮的去除率与羟胺浓度在一定范围内呈反比关系。如图7(d)所示,当菌株EN-F2培养至30 h时,所有羟胺浓度条件下的亚硝态氮均被完全去除。在不同浓度羟胺添加条件下,该菌均能快速去除亚硝态氮,与对照组相比(4.27 mg/L/h),当羟胺为1.0 mg/L时,该菌对亚硝态氮去除速率最大,在6~12 h期间达到了4.70 mg/L/h表明低浓度的羟胺可提高菌株EN-B2对亚硝态氮的去除速率。
3结论与展望
3.1结论
克雷伯氏菌(Klebsiella oxytoca) EN-B2可在广泛的pH(7.0~10.0)和C/N比(10~30)范围高效去除羟胺和亚硝态氮,单因素试验结果表明,菌株EN-B2去除羟胺与亚硝态氮的最适接种浓度为0.4×108 CFU/mL、C/N为15、温度为25 ℃、溶解氧水平为150 r/min、碳源是丁二酸钠、初始pH为8.0;不同浓度羟胺添加对菌株EN-B2去除亚硝态氮的速率具有显著的影响,随着羟胺的浓度由0 mg/L增加至9.0 mg/L,总氮的去除率由100.00%逐渐降至76.12%;当羟胺浓度超过3.0 mg/L后,菌株EN-B2的亚硝态氮去除随羟胺浓度上升逐渐受到抑制,完全去除等量亚硝态氮所需时间越长。上述结果表明,菌株EN-B2对于废水中的羟胺和亚硝态氮具有良好的净化潜力。
3.2展望
本研究以实验室前期分离筛选获得的菌株EN-B2为材料,分析不同因素对其在羟胺与亚硝态氮混合体系中的脱氮效果的影响,优化了菌株EN-B2的最适反应条件,通过研究不同浓度羟胺对菌株EN-B2去除亚硝态氮的影响,揭示该菌株具有的高效反硝化能力,明确了羟胺与菌株去除亚硝态氮的关系。本研究可为生物法去除羟胺与亚硝态氮的混合氮源以及污水处理提供参考,但仍然存在一些不足有待后续研究:
(1)本文研究了菌株EN-B2的脱氮特性,但未能阐明其脱氮机理,后续研究可对除氮过程中是否会产生N2O和脱氮功能基因进行研究,探索微生物除氮机制;
(2)本研究对菌株EN-B2脱氮特性的探索仅限于试验条件下,未在实际环境中应用,后续研究应注重在实际生活污水中的研究,以准确评估菌株EN-B2的实际应用能力。参考文献:
[1]于泓, 卢维宏, 张乃明. 我国设施栽培土壤退化特征及修复技术研究进展[J]. 蔬菜, 2021(11): 35-42.
[2] 李慧, 曹逸凡, 王桂良, 等. 设施农田土壤氮污染现状及修复技术[J]. 现代农业科技, 2023(11): 176-180,185.
[3] 中华人民共和国生态环境部.2021中国生态环境公报[EB/OL]. [2024-04-21]. https://www.mee.gov.cn/hjzl/sthjzk/jagb/202205/P020220527579939593049.pdf.
[4] TITOV V Y, PETRENKO Y M. Proposed mechanism of nitrite-induced methemoglobinemia[J].Biochemistry (Moscow), 2005, 70(4): 473-483.
[5] KNOBELOCH L, SALNA B, HOGAN A, et al. Blue babies and nitrate-contaminated well water[J]. Environmental Health Perspectives, 2000, 108(7): 675-678.
[6] JU C J, NIYAZI S, CAO W Y, et al. Characteristics and comparisons of the aerobic and anaerobic denitrification of a Klebsiella oxytoca strain: performance, electron transfer pathway, and mechanism[J]. J Environ Manage. 2023, 338: 117787.1-117787.10.
[7] 乔昕, 王博, 郭媛媛, 等. 羟胺对氨氧化菌和亚硝酸盐氧化菌的竞争性选择[J]. 环境科学, 2020,41(8): 3765-3772.
[8] 李舒泓, 张嘉媛, 梁植, 等. 亚硝酸盐对鱼类的毒性效应研究进展[J]. 河北渔业, 2023(3): 38-43.
[9] 王嘉琦, 邓浩亮. 张掖市周边集约化农区地下水硝态氮污染来源与防治研究[J]. 现代农业研究, 2022, 28(10): 129-131.
[10]景依葶, 田晓娟, 魏晓霞, 等. 混合耐冷菌的筛选及生活污水的降解研究[J]. 陇东学院学报, 2022,33(5): 92-96.
[11]李健弟. 羟胺对单级自养脱氮工艺脱氮性能及微生物菌群结构的影响特性研究[D]. 西安:长安大学, 2021.
[12]ZHANG M M, HE T X, CHEN M P, et al. Ammonium and hydroxylamine can be preferentially removed during simultaneous nitrification and denitrification by Pseudomonas taiwanensis EN-F2 [J]. Bioresource Technology, 2022, 350: 126912.1-126912.9.
[13]MIAO L, LIU Z. Microbiome analysis and omics studies of microbial denitrification processes in wastewater treatment:recent advances[J]. Sci China Life Sci. 2018, 61(7): 753-761.
[14]HE T, XIE D, LI Z, et al. Ammonium stimulates nitrate reduction during simultaneous nitrification and denitrification process by Arthrobacter arilaitensis Y-10[J]. Bioresource technology, 2017, 239: 66-73.
[15]PADHI S K, TRIPATHY S, SEN R, et al. Characterisation of heterotrophic nitrifying and aerobic denitrifying Klebsiella pneumoniae CF-S9 strain for bioremediation of wastewater[J]. International Biodeterioration amp; Biodegradation, 2013, 78: 67-73.
[16]HE T, ZHANG M, CHEN M, et al. Klebsiella oxytoca (EN-B2): a novel type of simultaneous nitrification and denitrification strain for excellent total nitrogen removal during multiple nitrogen pollution wastewater treatment[J]. Bioresour Technol. 2023,367: 128236.1-128236.9.
[17]CHEN M, DING C, HE T, et al. Efficient hydroxylamine removal through heterotrophic nitrification by novel bacterium Glutamicibacter arilaitensis EM-H8[J]. Chemosphere. 2022, 288:132475.1-132475.10.
[18]HE T X, XIE D T, NI J P, et al. Nitrous oxide produced directly from ammonium, nitrate and nitrite during nitrification and denitrification[J]. Journal of Hazardous Materials, 2020, 388: 122114.1-122114.8.
[19]何腾霞. 耐冷高效亚硝酸盐型好氧反硝化细菌及其对氮转化能力研究[D]. 重庆:西南大学, 2017.
[20]邱晓帆. 脱氮微生物筛选及脱氮条件优化研究[D]. 无锡:江南大学, 2012.
[21]吴启凤.耐冷异养硝化与好氧反硝化细菌Pseudomonas fragi EH-H1的脱氮途径与脱氮产物研究[D]. 贵阳:贵州大学, 2023.
[22]XI H, ZHOU X, ARSLAN M, et al. Heterotrophic nitrification and aerobic denitrification process: promising but a long way to go in the wastewater treatment[J]. Science of The Total Environment, 2022, 805: 150212.1- 150212.15.
[23]CHEN S, HE S, WU C, et al. Characteristics of heterotrophic nitrification and aerobic denitrification bacterium Acinetobacter sp. T1 and its application for pig farm wastewater treatment[J]. Journal of bioscience and bioengineering, 2019, 127(2): 201-205.
[24]ZHANG Q, ZHU Y, YUAN C, et al. Nitrogen removal and mechanism of an extremely high-ammonia tolerant heterotrophic nitrification-aerobic denitrification bacterium Alcaligenes faecalis TF-1[J]. Bioresource Technology, 2022, 361: 127643.1-127643.9.
[25]LIN X, LI X, FAN W, et al. Heterotrophic nitrification and aerobic denitrification by a novel Acinetobacter sp. ND7 isolated from municipal activated sludge[J]. Bioresource technology, 2020, 301: 122749.1-122749.8.
[26]WU L, DING X, LIN Y, et al. Nitrogen removal by a novel heterotrophic nitrification and aerobic denitrification bacterium Acinetobacter calcoaceticus TY1 under low temperatures[J]. Bioresource Technology, 2022, 353: 127148.1-127148.7.
[27]SUN Z, LV Y, LIU Y, et al. Removal of nitrogen by heterotrophic nitrification-aerobic denitrification of a novel metal resistant bacterium Cupriavidus sp. S1[J]. Bioresour Technol. 2016, 220: 142-150.
[28]ZHANG Q L, LIU Y, AI G M, et al. The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium, Bacillus methylotrophicus strain L7[J]. Bioresour Technol. 2012, 108: 35-44.
[29]WU Q, HE T, CHEN M, et al. Nitrogen removal characterization and functional enzymes identification of a hypothermia bacterium Pseudomonas fragi EH-H1[J]. Bioresource Technology, 2022, 365: 128156.1-128156.8.
[30]HU J, YANG X, DENG X, et al. Isolation and nitrogen removal efficiency of the heterotrophic nitrifying-aerobic denitrifying strain K17 from a rare earth element leaching site[J]. Frontiers in Microbiology, 2022, 13: 905409.1-905409.11.
[31]ZHANG H, LI S, MA B, et al. Nitrate removal characteristics and 13C metabolic pathways of aerobic denitrifying bacterium Paracoccus denitrificans Z195[J]. Bioresource technology, 2020, 307: 123230.1-123230.11.
[32]LEI X, JIA Y, CHEN Y, et al. Simultaneous nitrification and denitrification without nitrite accumulation by a novel isolated Ochrobactrum anthropic LJ81[J]. Bioresource Technology, 2018, 272: 442- 450.
[33]邢崇阳, 范禹辰, 陈璇, 等. 羟胺对厌氧氨氧化污泥群落的影响[J]. 环境科学, 2020, 41(7):3365-3372.
[34]陈梦苹.高效羟胺型硝化与反硝化细菌EM-H8的氮转化研究[D]. 贵阳:贵州大学, 2022.
[35]WANG Y, WANG Y, WEI Y, et al. In-situ restoring nitrogen removal for the combined partial nitritation anammox process deteriorated by nitrate build-up[J]. Biochemical Engineering Journal, 2015, 98(15): 127-136.
[36]LI J, ZHANG Q, LI X, et al. Rapid start-up and stable maintenance of domestic wastewater nitritation through short-term hydroxylamine addition[J]. Bioresource technology, 2019, 278: 468-472.
(责任编辑:于慧梅)
Study on the Characteristics of Efficient Conversion of Hydroxylamine
and Nitrite by Klebsiella Oxytoca EN-B2
ZOU Jianguo XU Xingzhou" WANG Ying TIAN Shan" WANG Xiaoqiang WANG Jiachen
CHEN Chan ZOU Ting, HE Tengxia" JIANG Long
(1.College of Life Sciences, Guizhou University, Guiyang 550025, China; 2.Key Laboratory of Plant Resource Conservation and
Germplasm Innovation in Mountainous Region (Ministry of Education), Guizhou University, Guiyang 550025, China)Abstract: Hydroxylamine and nitrite are toxic to plants and animals, and can further endanger human health through polluted environment. In this study, a strain of Klebsiella oxytoca EN-B2 with efficiently ability to convert hydroxylamine and nitrite was used, which isolated in our previous study. Exploring the effects of environmental factors on the removal of hydroxylamine and nitrite. The results show that EN-B2 remov hydroxylamine, nitrite and total nitrogen most efficiently under the conditions of sodium succinate as carbon source, 0.4×108 CFU/mL, carbon-nitrogen ratio (C/N) of 15, temperature of 25 ℃, rotation speed of 150 r/min and initial pH of 8.0. It with removal rates of 99.42%, 100.00% and 87.76%, respectively. In addition, different concentrations of hydroxylamine were added to the nitrite system, and the effect of hydroxylamine on nitrite removal by strain EN-B2 was further explored. The results show when the concentration of hydroxylamine exceed 3 mg/L, as the concentration of hydroxylamine increase, the removal ability of EN-B2 decrease. This study is helpful for understanding the characteristics of Klebsiella Oxytoca EN-B2 in removing hydroxylamine and nitrite, which providing an important reference for the treatments of nitrogen contaminated wastewater.
Key words: Klebsiella oxytoca, hydroxyamine, nitrite, environmental factors

