稳转oHSV2主要衣壳蛋白VP5人宫颈癌细胞系的构建

[摘 要] 为建立稳定表达溶瘤Ⅱ型单纯疱疹病毒主要衣壳蛋白(VP5)的人子宫颈癌HeLa-VP5细胞系,探究VP5蛋白是否调控自然杀伤细胞(NK)的细胞毒性。运用piggyBac转座系统,通过lipofectamine 3000TM 脂质体转染法,将 pPBDP-UL19和pSPBT质粒转入HeLa细胞,利用嘌呤霉素(Puro)筛选稳定细胞株,用有限稀释法得到单克隆细胞,利用western blot鉴定HeLa-VP5细胞系中VP5蛋白的表达,以及利用流式细胞术检测HeLa-VP5中GFP的表达,最后实时监测法比较改造前后细胞系的生长活性变化。通过嘌呤霉素抗性筛选和有限稀释挑取单克隆,获得3株HeLa-VP5单克隆细胞;western blot鉴定发现3株HeLa-VP5细胞系VP5蛋白均有表达;流式检测单克隆细胞系GFP阳性率均达到99%;活细胞实时监测法检测发现HeLa-VP5细胞系与亲本细胞HeLa细胞具有一致的生长活性。HeLa-VP5稳转细胞系构建成功,作为评估VP5蛋白是否调控自然杀伤细胞(NK)细胞毒性的靶细胞,为揭示oHSV2发挥抗肿瘤作用机制提供理论基础。
[关键词] 溶瘤Ⅱ型单纯疱疹病毒; 主要衣壳蛋白; 稳转细胞系
[中图分类号] R153" [文献标识码] A
溶瘤病毒疗法是一种新兴的实体瘤治疗方式。它使用可自我复制的溶瘤病毒选择性地感染肿瘤细胞,促进细胞裂解并产生可以扩散到其他肿瘤细胞的后代[1],通过直接溶瘤作用和诱导抗肿瘤免疫反应特异性杀死肿瘤细胞。溶瘤病毒(oncolytic virus,Ovs)是一类可以选择性地感染和杀死癌细胞,但不伤害正常细胞的天然或重组病毒。到目前为止,全球已经批准了Rigvir(ECHO-7)、Oncorine(H101)、T-VEC (Imlygic)和DELYTACT (teserpaturev/G47Δ) 等4个OVs药物,分别用于治疗黑色素瘤、头颈癌、转移性黑色素瘤和恶性神经胶质瘤或任何原发性脑癌。另外,单纯疱疹病毒、牛痘病毒、腺病毒、呼肠孤病毒和新城疫病毒等不同类型的溶瘤病毒已进入临床前和临床研究阶段。单纯疱疹病毒(herpes simplex virus,HSV)是包膜双链 DNA 病毒,主要引起野生型唇疱疹和生殖系统感染。改良的HSV是一种用于诊断和治疗癌症的病毒类型。迄今为止,包括Oncovex(T-VEC)、1716、G207、NV1020、HF10和G47Δ在内的几种HSV突变体已经完成或进入Ⅰ期、Ⅱ期和ⅡⅠ期临床试验,以治疗来自不同组织的黑色素瘤、乳腺癌和胶质瘤等不同恶性程度的肿瘤[2]。
单纯疱疹病毒是最常用的溶瘤病毒载体之一。常见的溶瘤单纯疱疹病毒(oHSV)通过敲除神经毒性因子ICP34.5来减弱病毒对正常细胞的致病性,增强其在肿瘤细胞中的选择性复制[3]。溶瘤Ⅱ型单纯疱疹病毒oHSV2是基于标准株 HSV-2(HG52)而改造的,即敲除了ICP34.5基因和ICP47基因,同时插入了人粒细胞巨噬细胞集落刺激因子(human granulocyte macrophage colony stimulating factor,hGM-CSF)基因。其改造的优势在于:1)ICP34.5的基因产物可以通过干扰素途径抑制细胞对病毒的清除,而在肿瘤细胞内此途径是缺失的,将ICP34.5敲除后,增强了oHSV2对肿瘤细胞选择性复制;2)ICP47导致了TAP缺陷,从而限制了感染细胞的免疫识别,而ICP47基因的缺失恢复了MHC I,使肿瘤细胞响应免疫应答,上调了US11的表达,促进病毒在肿瘤细胞内的生长并提高病毒的溶瘤活性[4];3)oHSV2载体含有hGM-CSF,它可以激活抗原呈递细胞,诱导肿瘤特异性免疫应答。
肿瘤已经开发出不同的策略来逃避免疫监视,包括对主要组织相容性复合体(major histocompatibility complex,MHC)的经典MHC I类抗原进行下调或对非经典HLA-G和HLA-E抗原进行上调。人类白细胞抗原(HLA-E)在大多数组织的细胞表面普遍以低水平表达,但在肿瘤细胞和病毒感染的细胞中过表达[5],并通过与自然杀伤(NK)细胞和T淋巴细胞上的受体CD94 / NKG2受体结合来进行免疫调节。HLA-E与CD94 / NKG2受体的结合,可以导致NK细胞的抑制或活化,这取决于HLA-E所呈现的肽和与CD94相关的NKG2受体[5-8]。由于其免疫抑制的特征,HLA-E的表达可能代表了肿瘤逃避免疫监视的重要机制。
前期研究发现,UV-oHSV2感染肿瘤细胞(BGC823、LoVo、A549、HeLa)后,细胞的HLA-E上调表达,并且利用GST pull-down、Co-IP等技术筛选出HLA-E的互作蛋白——oHSV2主要衣壳蛋白VP5。VP5蛋白是由HSV-2的UL19基因所编码的主要衣壳蛋白,在感染复制晚期达到最高表达水平。冷冻电子显微镜下观察到HSV-2(MS株)衣壳结构由大约3000个蛋白质组成,分为六邻体(hexons)、五邻体(pentons)和三联体(triplexes)等3种类型。六邻体和五邻体都包含VP5(六邻体还包含VP26),三联体包括VP23和VP19C。VP5蛋白形成了广泛的分子间网络,包括多个二硫键(总共约1500个)和非共价相互作用,与VP26蛋白和三联体支撑衣壳稳定和装配[9]。
为初步验证VP5蛋白是否影响了HLA-E分子的表达水平,将表达VP5蛋白的质粒瞬时转染肿瘤细胞后,发现细胞HLA-E的表达水平上调。为进一步探究oHSV2的主要衣壳蛋白VP5如何上调HLA-E以及VP5是否通过干扰HLA-E与CD94/NKG2受体的相互作用从而调控NK细胞的细胞毒性,本研究拟构建稳定表达VP5蛋白的肿瘤细胞系,以便后续oHSV2抗肿瘤作用机制研究。
本研究采用的是piggyBac转座系统。昆虫的piggyBac转座子是一种新兴的非病毒系统,可以有效诱变和介导基因转移到哺乳动物基因组中[10],与基于病毒的系统相比,是一种更安全的选择。它可以携带高达14 kb的DNA片段,且转座效率没有显著影响。PiggyBac转座子通过“剪切和粘贴”机制有效地在载体和染色体之间转置。在转位过程中,转座酶识别位于转座子载体两端的转座子特异性倒置末端重复(ITR)序列,将内容物从载体上移出并将它们整合到目的染色体的TTAA位点中[11],其切除精确,不会留下任何痕迹序列。因此PiggyBac转座子成为哺乳动物中使用的主要转座子/转座酶系统。使用带有UL19基因(编码VP5蛋白)的转座质粒(pPBDP-UL19)和表达转座酶的质粒(pSPBT),将UL19基因整合至HeLa细胞染色体上,以绿色荧光蛋白(green fluorescent protein 即 GFP)作为荧光标记,嘌呤霉素作为细胞抗性,进行细胞系筛选和单克隆挑选,成功构建了HeLa-VP5稳转细胞系。
本研究构建稳定表达溶瘤Ⅱ型单纯疱疹病毒主要衣壳蛋白(VP5)的人子宫颈癌HeLa-VP5细胞系,将其作为评估VP5蛋白是否调控自然杀伤细胞(NK)细胞毒性的靶细胞,为揭示oHSV2发挥抗肿瘤作用机制提供理论基础。
1 材料与方法
1.1 实验材料和仪器
溶瘤病毒oHSV2由本实验团队进行基因改造、生产、纯化。实验所使用Hela细胞、质粒载体PiggyBac Dual promoter、Super PiggyBac Transposase由本团队保存,细胞培养基是DME/F-12(HyClone,USA),大肠杆菌DH5α感受态细胞由本实验团队制备,限制性内切酶(NEB),质粒小提中量试剂盒购于诺唯赞公司,嘌呤霉素(Puro)购于碧云天生物公司,流式细胞检测仪(BD),体视荧光显微镜(Nikon 公司),北京东联哈尔二级生物安全柜。
1.2 质粒构建
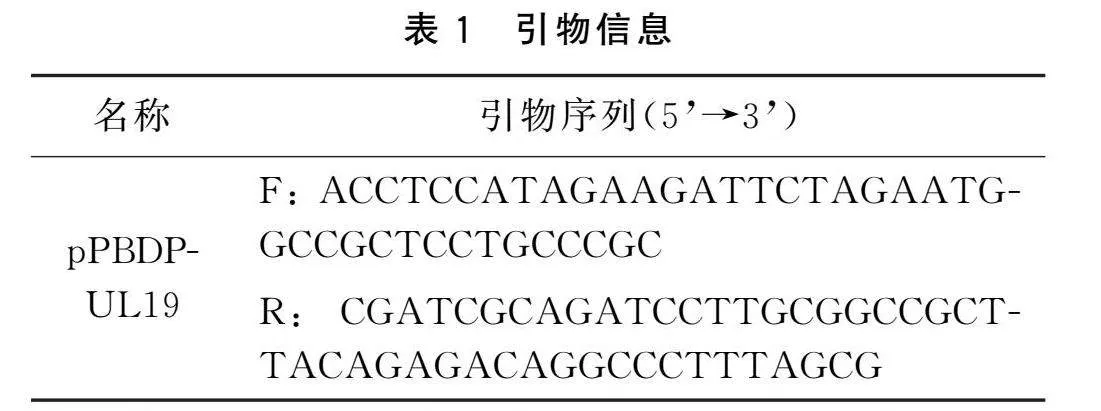
配制PCR体系及设置反应程序。所用到的引物见表1。
将UL19基因片段产物和pPBDP空载同源重组。其重组产物转化DH5α后,摇菌1 h。取菌液涂布LB固体平板(Amp抗性)。待平板长出单克隆菌落后,挑取10个单克隆菌落摇菌培养。取菌液做菌落PCR,出现UL19阳性结果的菌株外送测序。测序结果与NCBI上的发布序列比对。
1.3 质粒提取
将测序成功的菌液以1∶1000的比例接种至LB液体培养基(Amp抗性)中,37℃,220 r/min 摇菌14 h后提质粒。
1.4 细胞敏感性实验
将HeLa细胞接种于24孔板中。次日将嘌呤霉素(1~10 μg/mL)加入孔中,每个梯度设置3个复孔,并做好标记。每日观察孔内贴壁细胞占比,在第2、4、6天更换含有嘌呤霉素的培养基。将第4天中HeLa细胞存活率为0时的嘌呤霉素浓度设为其最低致死浓度。
1.5 质粒转染
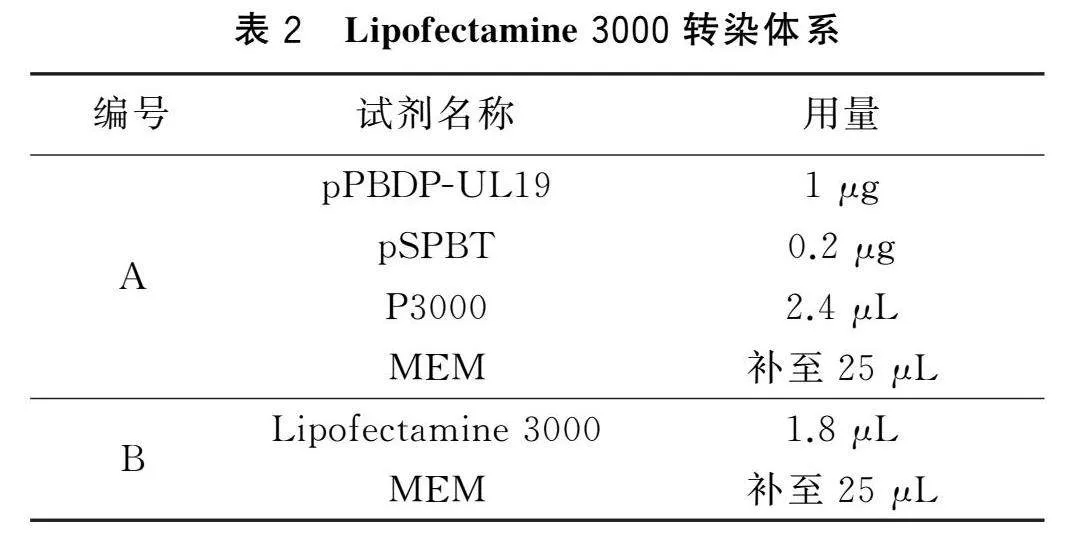
转染前一天将HeLa细胞接种到24孔板中。按照说明书配制反应体系(表2)。
将体系A和B分别制备好后,充分混匀,室温静置10 min。将总体系加入孔中,培养48 h后观察GFP表达情况。
1.6 HeLa-VP5单克隆细胞系筛选
换用嘌呤霉素的完全培养基进行培养。当孔中有90%以上的细胞发光时,进行单克隆细胞筛选。将孔板内细胞消化,用梯度稀释法将细胞悬液稀释到一定密度后接种到96孔板中,确保每孔中只有一个细胞。48 h后观察96孔板,记录下单个细胞生长对应的孔。待单细胞长成细胞团并有完整细胞形态后,选出发绿色荧光的单克隆细胞团,并将其扩大培养。
1.7 Western blot检测HeLa-VP5细胞系中VP5蛋白的表达
取HeLa细胞和HeLa-VP5细胞,冰上裂解细胞20 min后,13 000 r/min,4℃离心收集上清。加入SDS-PAGE蛋白上样缓冲液后,100℃煮沸15 min。将上述蛋白样品进行电泳,保证每孔上样量相同。使用半干法转膜,15 V,20 min,得到样品NC膜。将NC膜封闭,洗膜,一抗孵育,二抗孵育后,滴加ECL显色液进行显影。
1.8 流式细胞术检测HeLa-VP5细胞系中GFP的表达
取1×106个HeLa和HeLa-VP5 细胞。以HeLa细胞作为对照组,收集细胞悬液到EP管中,离心弃去上清。用PBS分别清洗、重悬细胞,过滤后上机。设置流式细胞仪检测通道为 GFP 单通道,收集1×104个细胞。GFP通道的相对荧光强度作为GFP表达的量化指标。
1.9 活细胞实时监测法检测HeLa-VP5细胞系增殖活性
取1×104个的HeLa和HeLa-VP5 细胞,以Hela细胞作为对照组,将细胞悬液加入电极板中。将电极孔板放入活细胞实时监测仪上,静置30 min。监测细胞指数,5 min/次,记录细胞生长曲线。一共监测40~60 h。
2 结果
2.1 pPBDP-UL19质粒的构建
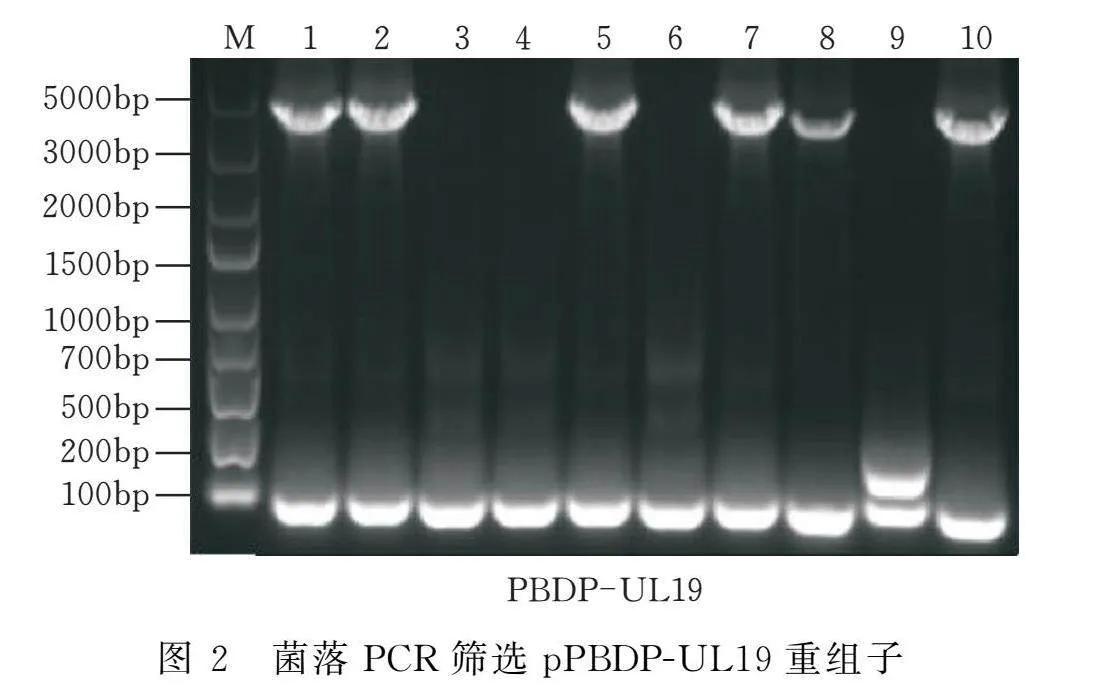
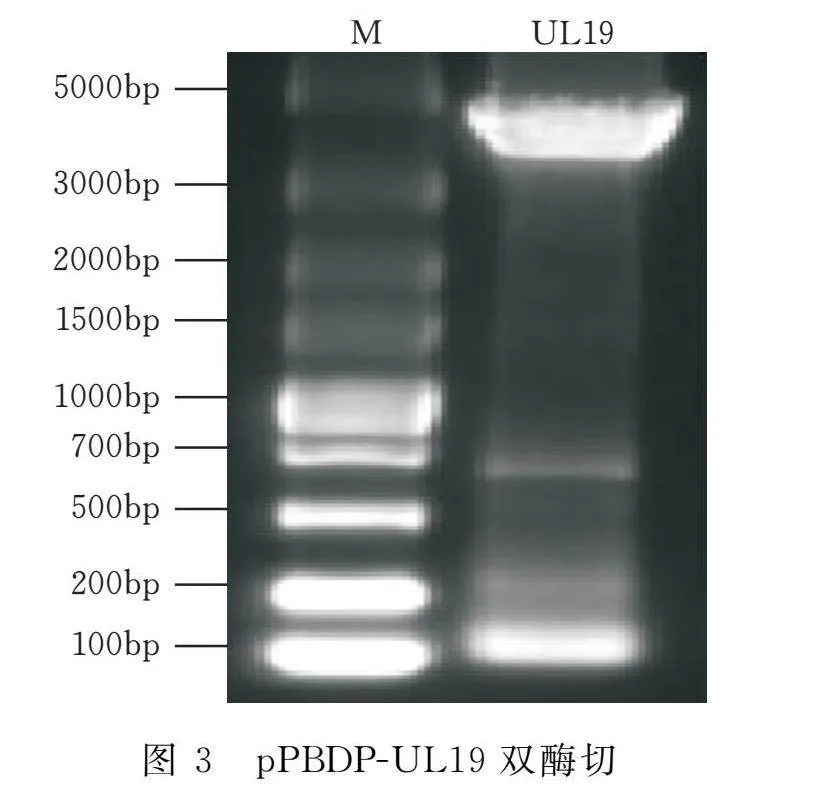
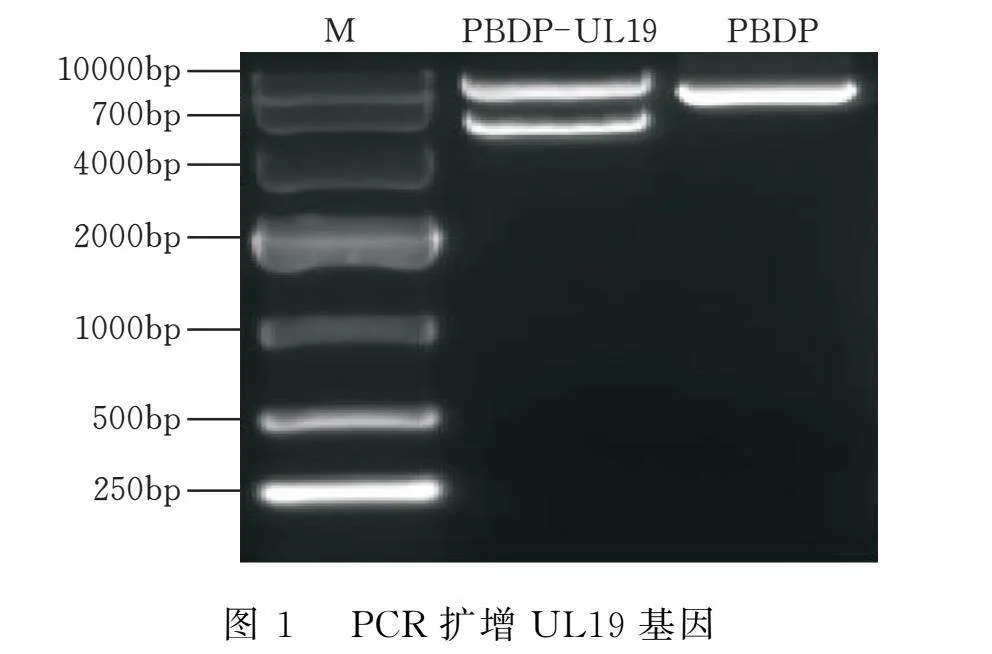
以oHSV2的cDNA为模板扩增UL19基因(4125 bp,编码VP5蛋白)。如图1所示,其扩增条带在约4125 bp处,与目的基因大小一致。通过单克隆菌落PCR鉴定,其扩增条带位置与目的基因一致(图2)。挑取3个单菌落外送测序,测序结果与GenBank中发表的序列一致。选取测序正确的质粒,通过双酶切(图3)鉴定,证明质粒pPBDP-UL19构建成功。
2.2 HeLa对嘌呤霉素敏感性实验
设置不同嘌呤霉素浓度(1~10 μg/mL)进行Hela细胞敏感性分析。根据致死曲线可知,筛选到第4天时,在2 μg/mL的浓度梯度下观察到细胞存活率为0。因此以2μg/mL作为HeLa单克隆细胞筛选的最佳浓度。
2.3 质粒转染HeLa细胞
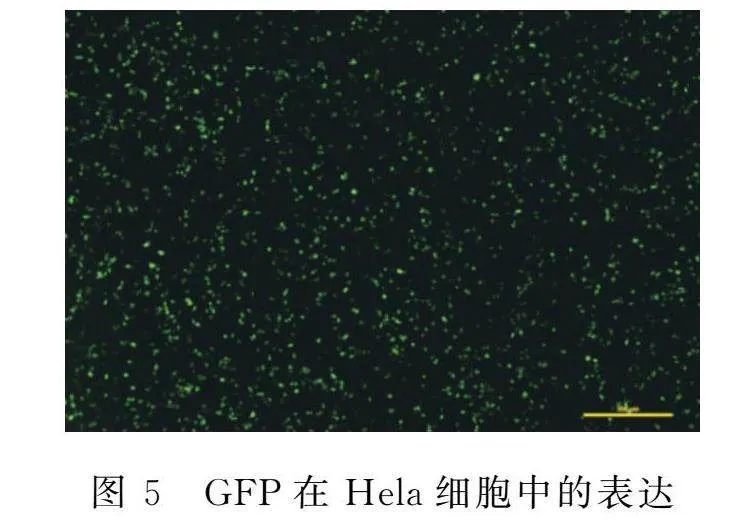
将pPBDP-UL19质粒和pSPBT质粒共同转染HeLa细胞48 h,通过荧光显微镜可以观察到视野内有30%以上的细胞发光(图5),说明pPBDP-UL19质粒和pSPBT质粒转染效率较高,并成功表达了GFP。
2.4 HeLa-VP5单克隆细胞系挑选及培养
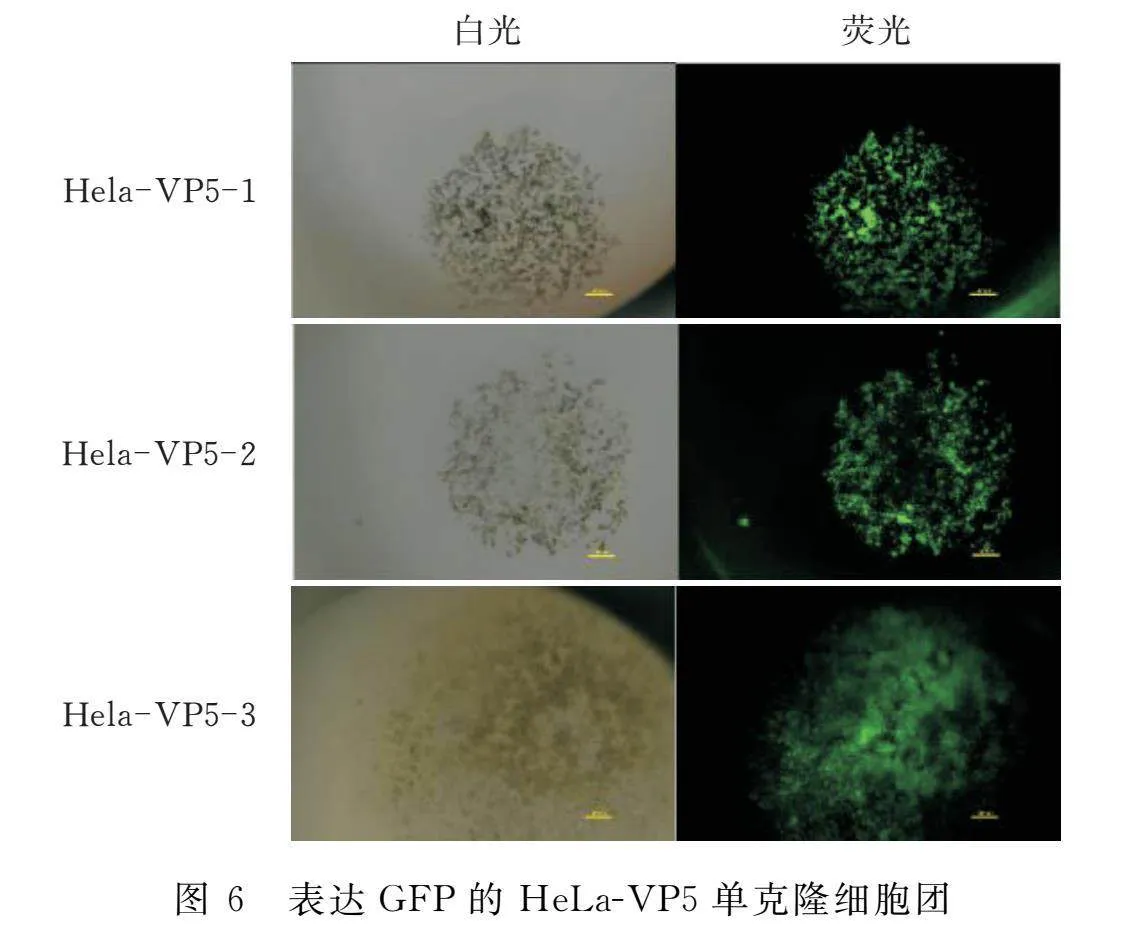
经过2 μg/mL嘌呤霉素加压筛选后,进行单克隆细胞系挑选及培养,得到了3株稳定表达GFP的单克隆细胞株(图6)。
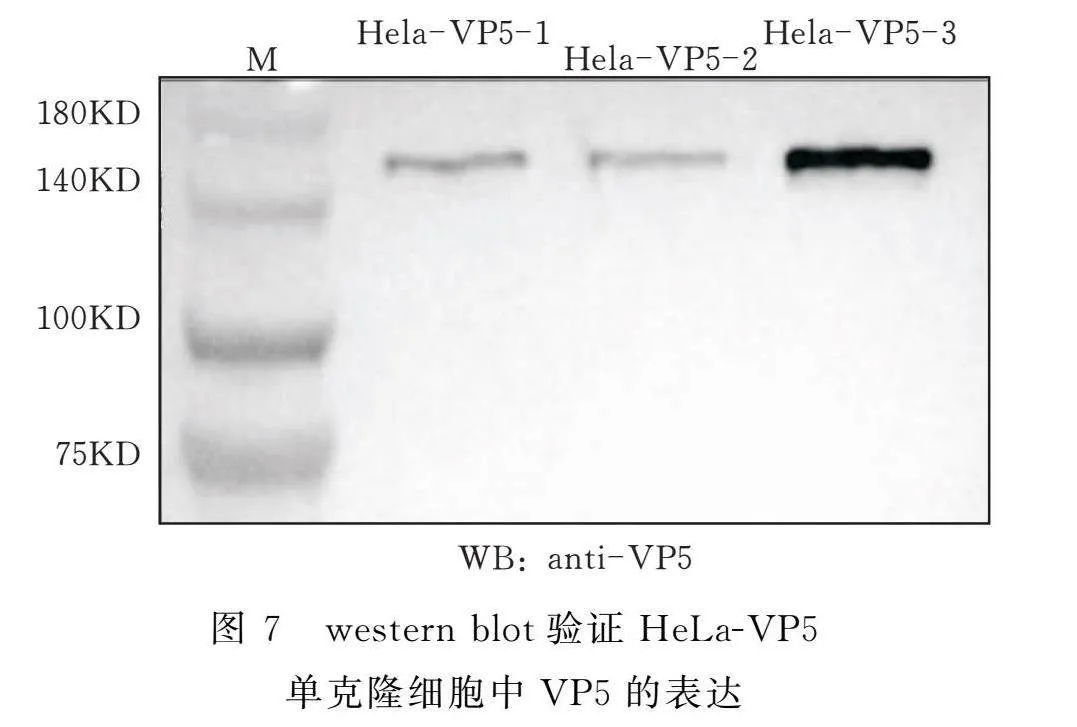
2.5 HeLa-VP5细胞系VP5蛋白的表达
收集HeLa细胞和HeLa-VP5细胞,将细胞裂解后取上清进行western blot分析。3株HeLa-VP5单克隆细胞均检测到VP5(图7)。
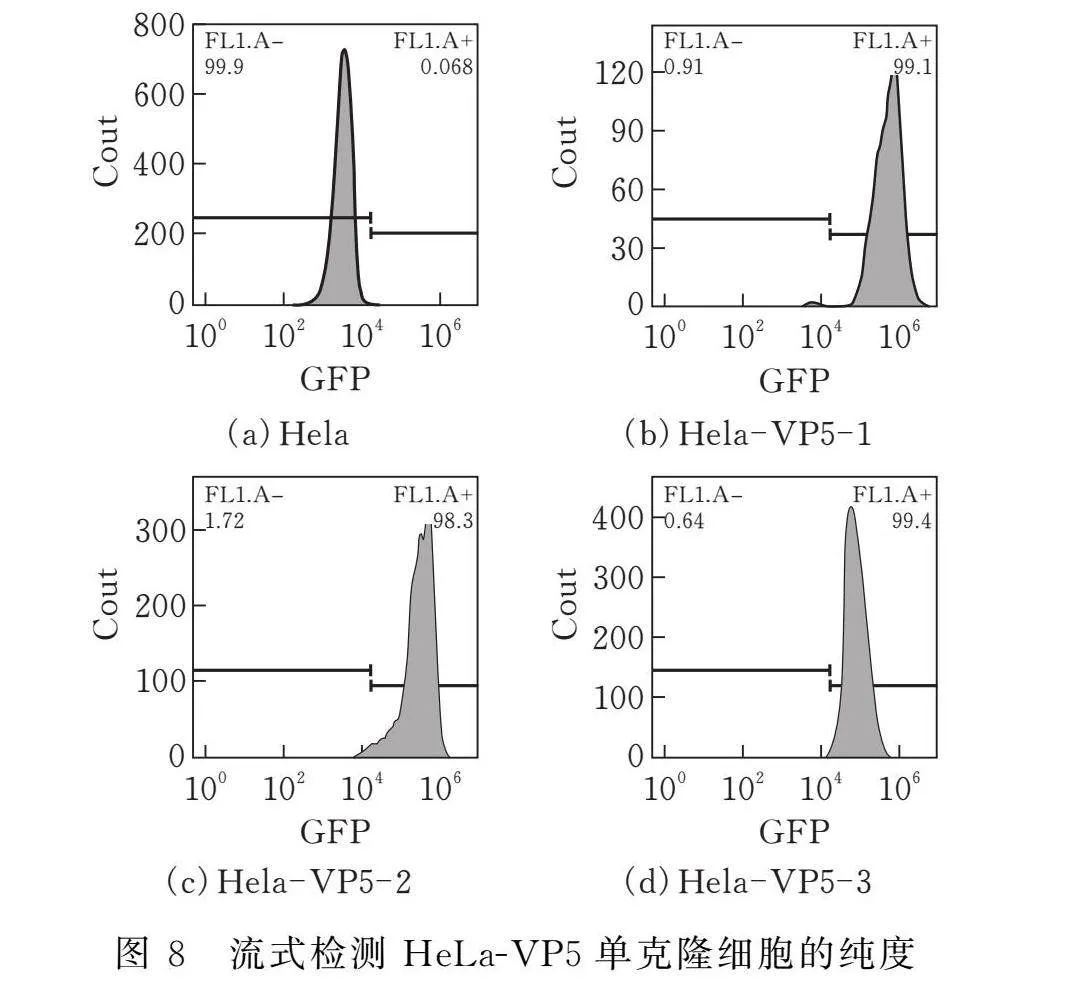
2.6 流式细胞术检测HeLa-VP5细胞系纯度
如图8所示,通过流式细胞仪检测HeLa-VP5细胞与HeLa细胞的GFP阳性率(FL1-A+表示GFP阳性率)。HeLa-VP5-1和HeLa-VP5-3与对照组相比, GFP阳性率均在99%以上,说明HeLa-VP5单克隆细胞系构建成功。
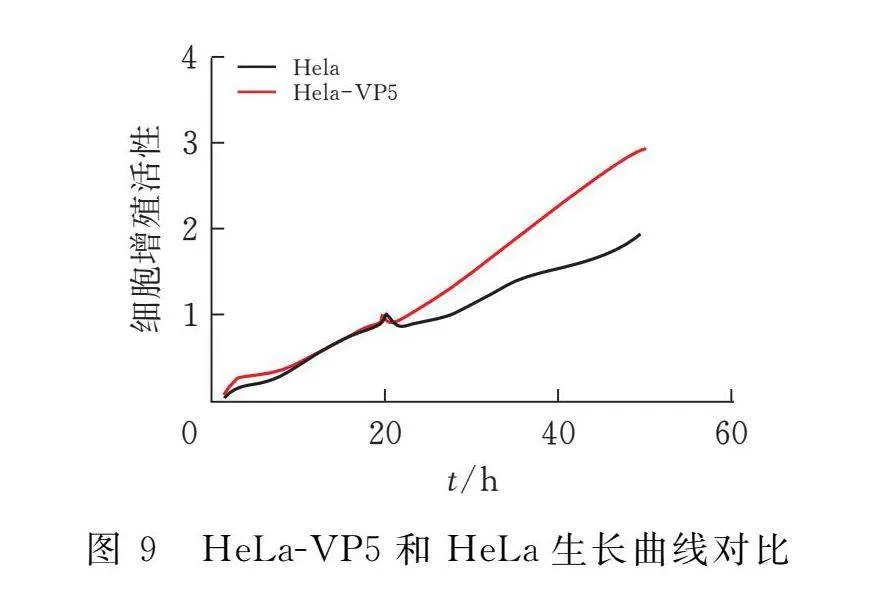
2.7 活细胞实时监测法检测HeLa-VP5细胞系增殖活性
通过生长曲线(图9)可以得知,HeLa-VP5与其亲本细胞HeLa生长曲线趋势一致,说明VP5蛋白的表达对细胞增殖活性没有影响。
3 讨论与结论
本研究运用piggyBac转座系统构建稳转细胞系。通过构建带有UL19基因的转座质粒(pPBDP-UL19)和表达转座酶的质粒(pSPBT),完成了HeLa细胞对UL19基因的整合,利用嘌呤霉素抗性筛选阳性细胞。通过western blot、流式细胞术、活细胞实时监测等方法证实了UL19整合到HeLa细胞的基因组中并成功表达VP5蛋白,证明使用piggyBac转座子/转座酶系统在人宫颈癌细胞(HeLa)中进行永久性基因转移是可行的。
溶瘤病毒作为用于治疗的病毒,可以选择性地在肿瘤组织内复制,并将其破坏裂解,但不会感染正常组织[12]。而肿瘤细胞裂解释放出的抗原,则能进一步激活系统性的抗肿瘤免疫应答,实现对原位和转移肿瘤的杀伤[13]。然而,肿瘤已经发展出逃避免疫系统监测的机制,免疫抑制分子(如白细胞免疫球蛋白样受体LILRB4和细胞程序性死亡一配体1(PD-L1))的高表达,可以抑制抗肿瘤免疫反应[14]。
免疫检查点抑制剂(ICIs)是近年来治疗肿瘤的流行免疫疗法之一,其通过靶向和抑制免疫检查点(包括 CTLA-4 和 PD-1)来激活免疫应答。但与“热”肿瘤相比,免疫检查点抑制剂在治疗“冷”肿瘤方面效果较小,原因在于促炎细胞因子的产生和T细胞浸润的水平将在一定程度上改变肿瘤微环境(TME)的“冷”(非T细胞炎症)与“热”(T细胞炎症)性质,这与肿瘤发展过程中表现出的抑制或支持性质密切相关。“热”肿瘤的特征是T细胞浸润和免疫激活的分子标志物。“热”肿瘤对免疫治疗的反应率较高,而“冷”肿瘤表现出明显的T细胞缺陷或排斥反应[15]。
OV的治疗活性不仅限于其溶瘤活性,还包括肿瘤微环境和免疫系统的整合调节。因此,OV提供了逆转肿瘤微环境的免疫抑制并使肿瘤对免疫检查点阻断敏感的理想手段。当与全身免疫检查点阻断(如CTLA-4和PD-1阻断)相结合时,溶瘤病毒疗法的抗肿瘤疗效显著增强[16-17]。此外,转基因可以通过病毒基因组工程技术插入OV基因组,其中病毒编码的基因表达可以免疫调节肿瘤,还可以构建表达检查点抑制性抗体分子的新OV。通过病毒抗体治疗(即重组抗体的基因递送),结合不同模式的直接和间接杀伤癌细胞,增强对肿瘤细胞的局部免疫应答[18-20]。
抗肿瘤是免疫系统的多个组成部分相互协作、共同作用的结果。在肿瘤微环境中,NK细胞等免疫细胞是协调oHSV清除肿瘤细胞的主要参与者。NK细胞通过表面的激活性或抑制性受体直接靶向并杀死外源细胞,其免疫过程不具备抗原特异性和MHC限制性。它已被证明可被招募到肿瘤微环境中,并有助于病毒感染细胞的清除[21-22]。NK细胞表面激活性受体和抑制性受体之间的相互协调、共同作用,决定了其对靶细胞的最终反应[6]。当肿瘤细胞中的激活性配体表达上调时,会结合大量的NK表面激活性受体,从而增强NK细胞的杀伤能力。NK细胞被激活后,除了可以直接杀伤肿瘤细胞外,还可以通过分泌细胞因子和趋化因子,增强其他免疫细胞的杀伤能力。相反,当抑制性受体与相应配体结合时,则减弱了NK细胞的细胞毒性。CD94 / NKG2A异二聚体作为抑制NK细胞反应的重要一员,在肿瘤浸润处的NK和CD8+T细胞中高表达, 而HLA-E在肿瘤细胞和病毒感染的细胞中过表达[4]。随着HLA-E的上调,它与抑制性受体的结合成为调控NK细胞活性的主要影响因素,某些肿瘤和免疫性疾病通过该途径逃避免疫检查。
通过前期研究发现了oHSV2的主要衣壳蛋白VP5可以引起不同肿瘤细胞HLA-E的上调。有研究报道一些病毒感染的细胞中也发生了HLA-E的表达上调[7-8,23-24],认为病毒蛋白编码由人白细胞抗原E(HLA-E)呈递的肽(如HCMV(人巨细胞病毒)、HCV(丙型肝炎病毒))存在病毒感染引起HLA-E表达上调的现象。HCMV感染细胞后,通过其糖蛋白UL40产生的多肽与HLA-E结合,上调HLA-E在细胞表面的表达,然后通过CD94/NKG2A受体,从而逃脱NK细胞的裂解[7]。Nattermann等在HCV中也发现了类似的机制,HCV导致HLA-E上调,通过其与CD94/NKG2A的相互作用,从而抑制NK细胞的裂解功能[8]。但EBV(Epstein-Barr病毒)能够产生一种多肽绑定HLA-E分子,破坏NKG2A的识别,导致NK细胞的激活[23]。与自身肽相反,病毒肽可以增强或抑制HLA-E和受体CD94 / NKG2的结合,从而影响NK细胞对靶细胞的杀伤。本研究构建稳定表达VP5蛋白的肿瘤细胞系,并将其作为评估VP5蛋白是否调控自然杀伤细胞(NK)细胞毒性的靶细胞,为后续oHSV2抗肿瘤作用机制研究奠定了基础。
[ 参 考 文 献 ]
[1] ZHAO Q, ZHANG W, NING Z F,et al. A novel oncolytic herpes simplex virus type 2 has potent anti-tumor activity. J PloS one[J], 2014, 9(03):e93103.
[2] WANG Y, JIN J, LI Y, et al. NK cell tumor therapy modulated by UV-inactivated oncolytic herpes simplex virus type 2 and checkpoint inhibitors[J]. Translational Research, 2022, 240: 64-86.
[3] HARDCASTLE J, KUROZUMI K, DMITRIEVA N, et al. Enhanced Antitumor Efficacy of Vasculostatin (Vstat120) Expressing Oncolytic HSV-1[J]. Molecular Therapy, 2010, 18(02): 285-294.
[4] 赵倩. 新Ⅱ型单纯疱疹溶瘤病毒的构建和功能研究[D]. 北京:北京协和医学院, 2014.
[5] SELIGER B, JASINSKI-BERGNER S, QUANDT D, et al. HLA-E expression and its clinical relevance in human renal cell carcinoma[J]. Oncotarget. 2016,7(41):67360-67372.
[6] DAI H-S, GRIFFIN N, BOLYARD C, et al. The Fc domain of immunoglobulin is sufficient to bridge NK cells with virally infected cells[J]. Immunity, 2017, 47(01): 159-170.
[7] ULBRECHT M, MARTINOZZI S, GRZESCHIK M, et al. Cutting edge: the human cytomegalovirus UL40 gene product contains a ligand for HLA-E and prevents NK cell-mediated lysis[J]. The Journal of Immunology, 2000, 164(10): 5019.
[8] NATTERMANN J, NISCHALKE H D, HOFMEISTER V, et al. The HLA-A2 restricted T cell epitope HCV Core 35-44 Stabilizes HLA-E expression and inhibits cytolysis mediated by natural killer cells[J]. The American Journal of Pathology, 2005, 166(02): 443-453.
[9] YUAN S, WANG J, ZHU D, et al. Cryo-EM structure of a herpesvirus capsid at 3.1 [J]. Science, 2018, 360(6384): eaao7283.
[10] CHEN Y-T, FURUSHIMA K, HOU P-S, et al. Piggybac transposon-mediated, reversible gene transfer in human embryonic stem cells[J]. Stem Cells and Development, 2009, 19(06): 763-771.
[11] Sandoval-Villegas N, Nurieva W, Amberger M, et al. Contemporary Transposon Tools: A Review and Guide through Mechanisms and Applications of Sleeping Beauty, piggyBac and Tol2 for Genome Engineering[J]. International Journal of Molecular Sciences, 2021,22(10):5084.
[12] RUSSELL S J, PENG K-W. Viruses as anticancer drugs[J]. Trends in Pharmacological Sciences, 2007, 28(07): 326-333.
[13] TOGNARELLI E I, PALOMINO T F, CORRALES N, et al. Herpes simplex virus evasion of early host antiviral responses[J]. Frontiers in Cellular and Infection Microbiology, 2019,30(09):127.
[14] DENG M, GUI X, KIM J, et al. LILRB4 signalling in leukaemia cells mediates T cell suppression and tumour infiltration[J]. Nature, 2018, 562(7728): 605-609.
[15] DUAN Q, ZHANG H, ZHENG J, et al. Turning Cold into Hot: Firing up the Tumor Microenvironment[J]. Trends in Cancer, 2020, 6(07): 605-618.
[16] LIU Z, RAVINDRANATHAN R, KALINSKI P, et al. Rational combination of oncolytic vaccinia virus and PD-L1 blockade works synergistically to enhance therapeutic efficacy[J]. Nature Communications, 2017, 8(01): 14754.
[17] RIBAS A, DUMMER R, PUZANOV I, et al. Oncolytic virotherapy promotes intratumoral t cell infiltration and improves Anti-PD-1 Immunotherapy[J]. Cell, 2017, 170(06): 1109-1119.
[18] MARTIN N T, BELL J C. Oncolytic Virus Combination Therapy: Killing One Bird with Two Stones[J]. Molecular Therapy, 2018, 26(06): 1414-1422.
[19] SHI G, YANG Q, ZHANG Y, et al. Modulating the tumor microenvironment via oncolytic viruses and CSF-1R inhibition synergistically enhances Anti-PD-1 immunotherapy[J]. Molecular Therapy, 2019, 27(01): 244-260.
[20] KONTERMANN R E, UNGERECHTS G, NETTELBECK D M. Viro-antibody therapy: engineering oncolytic viruses for genetic delivery of diverse antibody-based biotherapeutics[J]. mAbs, 2021, 13(01): 1982447.
[21] HONG B, SAHU U, MULLARKEY M P, et al. Replication and spread of oncolytic herpes simplex virus in solid tumors[J]. Viruses, 2022, 14(1):118.
[22] PERERA MOLLIGODA ARACHCHIGE A S. Human NK cells: From development to effector functions[J]. Innate Immunity, 2021, 27(03): 212-229.
[23] MBIRIBINDI B, PENA J K, ARVEDSON M P, et al. Epstein–Barr virus peptides derived from latent cycle proteins alter NKG2A+NK cell effector function[J]. Scientific Reports, 2020, 10(01): 19973.
[24] HAMMER Q, DUNST J, CHRIST W, et al. SARS-CoV-2 Nsp13 encodes for an HLA-E-stabilizing peptide that abrogates inhibition of NKG2A-expressing NK cells[J]. Cell Reports, 2022, 38(10): 110503.
Construction of A Human Cervical Cancer Cell Line Containingthe Main Capsid Protein VP5 of Stable OncolyticHerpes Simplex Virus Type Ⅱ
FAN Jiaqi , ZHANG Hui, LI Le, ZHOU Qin, WANG Yang,HU Han, LIU Binlei
(School of Biological Engineering and Food Science, Hubei Univ. of Tech., Wuhan 430068, China)
Abstract: This paper aims to establish a human cervical cancer HeLa VP5 cell line stably expressing the main capsid protein (VP5) of oncolytic herpes simplex virus type Ⅱ, and to lay a foundation for exploring whether VP5 protein regulates the cytotoxicity of natural killer cells (NK). To this end, pPBDP-UL19 and pSPBT plasmids were transferred into HeLa cells by using piggyBac transposition system and lipofectamine 3000 TM liposome transfection method; Purinomycin (Puro) was used to screen stable cell lines; Monoclonal cells were obtained by finite dilution method; Western blot was used to identify the expression of VP5 protein in HeLa VP5 cell line; The expression of GFP in HeLa VP5 was detected by flow cytometry; Live cell real time monitoring method was used to compare the growth activity changes of cell lines before and after transformation. The results show that three HeLa VP5 monoclone cells were obtained by purinomycin resistance screening and limited dilution selection; Western blot showed that VP5 protein was expressed in three HeLa VP5 cell lines; The positive rate of GFP was 99% by flow cytometry; The live cell real time monitoring method showed that the HeLa" VP5 cell line had the same growth activity as the parent cell HeLa cells. The HeLa VP5 stably transfected cell line has been successfully constructed as a target cell to evaluate whether VP5 protein regulates the cytotoxicity of natural killer cells (NK), providing a theoretical basis for revealing the mechanism of oHSV2's anti-tumor effect.
Keywords: oncolytic herpes simplex virus type Ⅱ; Main capsid protein; Stable cell line
[责任编校: 张 众]

