单分子技术的i 基序DNA动态结构实验研究
顾江新, 侯锡苗
(西北农林科技大学a.资源环境学院;b.生命科学学院,陕西 杨凌 712100)
0 引言
生物大分子指生物体内的多糖、脂质、蛋白质和核酸等。生物大分子在生命过程中的功能与其结构的动态变化密切相关,“结构决定性质”是现代生命科学得以快速发展的思想基础[1]。以单个分子作为研究对象,对其行为(包括构象变化、相互作用和相互识别等)进行实时、动态检测以及在此基础上的操纵、调控等,有利于揭示生物大分子的作用机制[2-4]。生物大分子的空间尺度在几十纳米量级,无法使用传统光学显微镜检测其结构变化。单分子荧光显微镜利用荧光分子能量共振转移进行相对位置的测量,具有纳米级别的超高分辨率,可用于单分子研究[5-7]。
在人类基因组DNA的高级结构中,通过半质子化的胞嘧啶配对构成非典型四链体结构i 基序(intercalated motif,i-motif)受到广泛关注。i-motif结构多存在于端粒及癌基因的启动子区,对调节癌基因的表达具有重要作用,已经成为抗癌治疗的新靶点[8-9],i-motif结构的多变性和敏感的pH 依赖性使其在纳米机械及药物递送系统中获得应用[10-11],环境pH 值的变化对i-motif结构产生直接影响,但对于i-motif 的折叠状态及性质仍缺乏系统的研究。本文实验通过在含有i-motif结构的DNA 底物上标记荧光对,记录不同pH值条件下的荧光能量转移效率,旨在阐明i-motif结构的动态变化过程和作用机制。
1 实验原理与方法
1.1 实验原理
图1 所示为单分子荧光共振能量转移的基本原理。如图所示,在某一双链DNA分子的两端进行荧光标记时,供体(D)荧光分子受激发所发出的荧光通过诱导偶极,会部分被受体(A)荧光分子吸收,然后受体荧光分子被点亮的过程。在该过程中,能量转移效率与荧光分子间的距离有关,其关系表达式[12]为
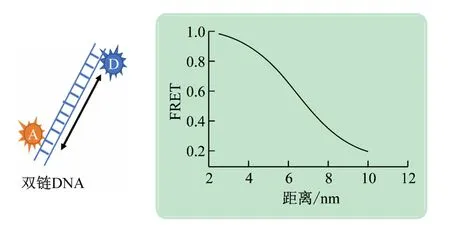
图1 单分子荧光共振能量转移理论示意图
式中:FRET为荧光能量转移效率;R和R0分别为2 个荧光分子的相对位置和特征距离,与光谱重叠面积、溶液离子环境等有关。通过测量反应过程中能量转移效率即可获得相对位置变化。
1.2 实验设备
图2所示为单分子荧光显微镜的光路及实物图。主要硬件为IX71 倒置显微镜(OLYPUS公司),所有器件均固定于其上;LC-605A固态激光器(Cohrent公司)产生特定波长的激光,经过光纤输入显微镜光学系统;通过电动千分尺调节激光的入射角度,使激光经过二色镜反射在P-545 载物台(Physik Instrumente公司)上固定的反应槽内部下表面形成全内反射;荧光分子受激发的荧光,经反射系统进入分色箱中,通过DU-897U-CS0-#BV 电荷耦合器件(Andor Technology 公司)转换成数字信号输出。
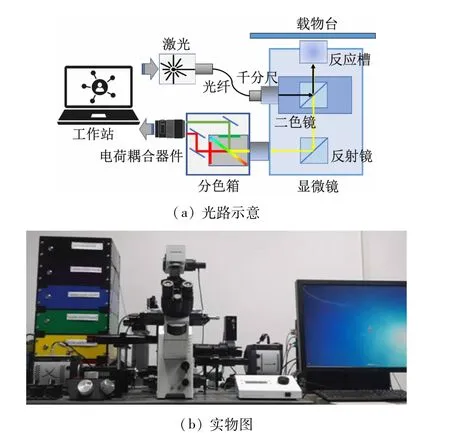
图2 单分子荧光显微镜
实验通过MetaMorph图像工作站对硬件进行管理和控制,可选择激光波长和强度,利用AutoShutter 功能实现录像和激光的同步打开、关闭及自动对焦,最终输出的数字信号也由图像工作站记录并进行可视化处理。
1.3 实验材料
实验使用PB 缓冲体系。分别将磷酸二氢钾与磷酸氢二钾试剂溶解于双蒸水(1 mol/L),调至不同的pH值(5.8,6.2,6.6,7.0,7.4,8.0),配制出PB 反应溶液(50 mmol/L),加入防止荧光淬灭或发生光漂白的除氧体系,除氧体系由奎诺二甲基丙烯酸酯(4 mmol/L)、D-葡萄糖(0.8%)、葡萄糖氧化酶(1 mg/mL)和过氧化氢酶(0.4 mg/mL)组成。
实验底物由一条含有i-motif 结构的bcl2 基因序列与一条短双链DNA 退火而成,短DNA 链的作用是将底物固定在反应槽表面,如图3 所示。以单链DNA为对照。底物的修饰选用花青素荧光分子Cy3 和Cy5,该荧光对具有荧光效率高、发光稳定和分子量小等优势。将Cy3 连接至bcl2 序列的3'末端和单链DNA的末端,将Cy5 连接至短DNA 链的第6 个核苷酸处。此时,bcl2 序列和单链DNA分别被夹在2 个荧光之间(见图3),其结构的轻微变化都将改变2 个荧光之间的距离,进而影响荧光能量转移效率。

图3 实验底物及荧光修饰示意图
1.4 实验方法
实验过程要求室温恒定为20 ℃,单分子荧光显微镜必须提前预热至稳定状态,待电荷耦合器件降温至-80 ℃后才能正常工作。将注射器和移液枪头连接至反应槽,抽入反应缓冲液对反应槽进行3 次润洗。将底物稀释至50 pmol/L,注入反应槽内孵育10 min,底物即被固定于反应槽表面。用反应缓冲液冲走游离的底物,抽入含有除氧体系的成像缓冲液。向物镜表面滴加香柏油,将反应槽固定于载物台上。选择532 nm的激发光,挑选连接均匀且密度适中的视野,每个检测视野内找到500 ~600 个荧光信号,于1 min 内录取600 帧数据。对获取的数据进行筛选、分析和可视化处理。
2 实验结果与分析
2.1 pH值的影响
图4 所示为bcl2 基因序列和单链DNA在不同pH值条件下的荧光传递效率分布(图中分子数占比表示具有该FRET值的分子数与全部分子数的比例)。由图可知,当pH =6.2 时,bcl2 序列的荧光能量转移效率分布在0.95 左右显示1 个单峰,说明i-motif结构处于均匀、完全的折叠状态;随着pH值增加至8.0,荧光能量转移效率分布逐步向左移动,效率峰最终停留在0.40左右,表明i-motif 结构在高pH 值条件下的部分去折叠过程。单链DNA 在不同pH 值条件下的荧光能量转移效率分布均没有发生移动,效率峰稳定在0.27 左右[见图4(b)],说明其结构呈现无规则卷曲状态。
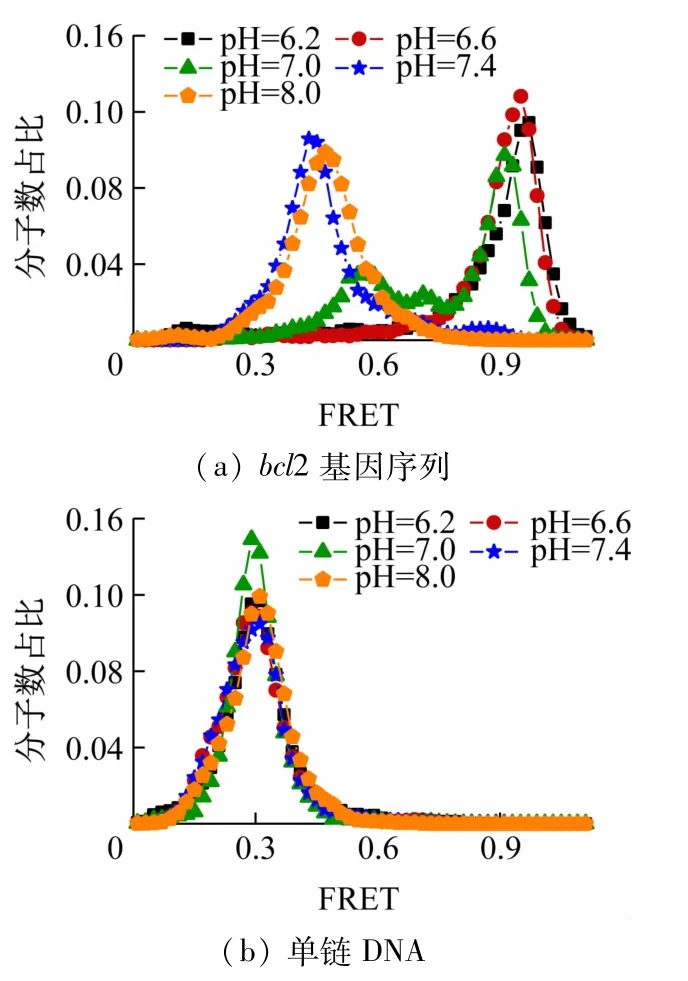
图4 在不同pH值下反应底物的荧光传递效率分布
2.2 折叠状态
图5所示为bcl2 基因序列的动态荧光传递效率曲线及形成的C-发夹结构。由图可知,bcl2 序列的荧光能量转移效率动态分布曲线拟合出6 个峰,表明imotif结构具有6 个折叠状态。除了完全折叠的i-motif(最高效率)和无规则卷曲状态(最低效率)之外,至少还存在4 个中间状态,分别对应于荧光能量转移效率峰在0.8、0.7、0.5 和0.4 处。这些是由部分C:C +碱基配对形成C-发夹结构,包括平行发夹、反平行发夹和不完全配对发夹等(见图5)。由此可见,当pH 值发生改变时,i-motif 可以在多种折叠状态间进行自发地变构与转换,推测各折叠状态可发挥不同的生理功能。

图5 反应底物荧光传递效率动态分布曲线及形成的C-发夹结构示意图
3 结语
本文实验利用单分子荧光共振能量转移技术,对含有i-motif结构的基因序列bcl2 在不同pH值条件下的动态变化进行检测。结果表明:i-motif 结构具有6个折叠状态,在低pH值条件下处于均匀、完全的折叠状态,而在高pH 值条件下部分去折叠;总之,i-motif结构随pH值的改变可在多种折叠状态间进行自发地变构与转换,为进一步探索i-motif 的生理功能提供参考。

