胍类氨基酸离子液体捕集烟气中CO2实验研究
王琪 李爱蓉 康洛铭 王军 廖铁 肖杨 王治红
1.西南石油大学化学化工学院 2.中国石油西南油气田公司天然气净化总厂
化石燃料燃烧产生的烟气是大气中二氧化碳(CO2)的主要排放源,其大量排放造成海平面升高、全球变暖、极地冰融化等环境问题,且烟气出口温度高,CO2分压低,导致捕集难度大。因此,我国于2020年9月提出了“碳达峰、碳中和”目标,明确对烟气中CO2进行捕集,碳捕集是实现“双碳”目标的重要技术手段[1-4]。现有碳捕集技术仍以燃烧后捕集为主,其中化学吸收法是捕集烟气中CO2的主要方法[5-8]。有机胺吸收能力强、吸收速率快和吸收工艺简单,是工业常用的吸收剂[9-10],但该类吸收剂在高温下存在易挥发、易氧化和成盐等问题,造成较大的溶剂损失及环境污染。因此,迫切需要寻找一种吸收容量高、热稳定性好的CO2新型吸收剂[11-12]。离子液体(ionic liquids,以下简称ILs)是室温下由阴、阳离子组成的有机熔盐,其具有蒸气压低、热稳定性高和阴阳离子结构可调等优点,被广泛用于气体分离、催化反应等领域[13-14]。1999年,Blanchard等[15]报道CO2能被离子液体大量吸收。自此,人们开始研究离子液体在CO2捕集领域的应用。2001年,Blanchard等[16]研究发现,[Bmim]PF6在40 ℃、93 bar(1 bar=100 kPa)的条件下饱和吸收容量为0.72 mol/mol,但当吸收压力降低至0.97 bar时,该离子液体对CO2几乎不具有捕集能力。常规离子液体捕集CO2过程是物理吸收,受压力影响较大,难以适用于烟气中CO2的捕集[17]。因此,研究者开始寻找功能化离子液体进行常压下CO2的捕集。
以四甲基胍为阳离子的胍类离子液体除了具有热稳定性高、不易降解、蒸汽压低、不易挥发、易功能化、可设计性强等离子液体的普遍优点外,胍盐阳离子电荷发散程度高,其胍基基团含有3个氮原子,具有明显的碱性和氢键受体性质,能与酸性气体发生较强的相互作用,在烟气脱碳领域展现出较大的应用潜力。张香平等[18]制备了以咪唑为阴离子的胍类离子液体[TMG][Im],在40 ℃和1 bar下进行脱碳实验,吸收能力可达0.83 mol CO2/mol IL,且经过4个吸收-解吸循环后仍具有良好的吸收性能,表明胍类离子液体具有良好的CO2捕集潜力。现有研究主要是针对常规阴离子胍类离子液体的脱碳性能进行研究。但是阴离子氨基功能化离子液体也在脱碳过程中起到重要作用,特别是天然氨基酸,由于其廉价易得,且带有氨基基团,其阴离子上的氨基基团与CO2反应生成氨基甲酸酯的反应机理被广泛证实。Jiang等[19]合成了9种季铵基氨基酸离子液体,在40 ℃、常压条件下,吸收量可达到0.5 mol CO2/mol IL,且证实离子液体中氨基酸阴离子的氨基对CO2起主要吸收作用。Zhang等[20]将四丁基氢氧化膦[P4444]与甘氨酸、丙氨酸、赖氨酸反应合成了新型四丁基膦氨基酸[P4444][AA]离子液体,实验结果表明:[P4444][Gly]的CO2吸收容量为0.6 mol CO2/mol IL,阴离子上的氨基起到了捕集CO2的主要作用。Brennecke等[21]报道了由季磷阳离子和氨基酸阴离子组成的[P66614][Pro]和[P66614][Met],在常压及22 ℃的条件下,CO2最大吸收载荷达到0.9 mol CO2/mol IL。由此可见,氨基酸作为阴离子的离子液体展现出了较好的CO2捕集能力。因此,本研究以四甲基胍(TMG)为阳离子,分别以赖氨酸(Lys)、丙氨酸(Ala)和天冬氨酸(Asp)为阴离子,开展新型胍类氨基酸离子液体捕集烟气中CO2的实验研究。
1 实验部分
1.1 试剂与仪器
实验试剂:1,1,3,3-四甲基胍、L-赖氨酸、β-丙氨酸、L-天冬氨酸,上述试剂质量分数均≥98%,上海达瑞精细化学品有限公司,用于离子液体制备。
模拟烟气:15%(φ) CO2+85%(φ) N2,成都科源气体有限公司,参考工业烟气(CO2体积分数:15%~20%)。
高纯氮气:N2(99.999%,φ),成都科源气体有限公司,用于离子液体气提再生。
实验仪器:电子天平(HX-T),慈溪市天东衡器厂;磁力搅拌器(84-1A),上海梅颖浦仪表仪器制造有限公司;数显智能控温磁力搅拌器(SZCL-2A),巩义市予华仪器有限责任公司;循环水多用真空泵(SHB-3A),郑州杜甫仪器厂;旋转蒸发仪(R1001-VN),郑州长城科工贸有限公司;真空干燥箱(D2F-6050),上海晶弘实验设备有限公司;烟气分析仪(FGA10),深圳市贝特分析仪器有限公司。
1.2 实验方法
1.2.1离子液体的制备
采用一步法进行离子液体的制备[22-24]。首先,将0.1 mol氨基酸溶解在水中,在剧烈搅拌状态下加入等摩尔的1,1,3,3-四甲基胍;在室温下混合搅拌48 h后,在55 ℃的条件下减压旋蒸;最后,在55 ℃的条件下真空干燥48 h至恒重,即得到所制备的离子液体,合成路线如图1所示。

1.2.2表征方法
(1) 结构表征:采用傅里叶红外光谱仪(北京瑞利分析仪器,WQF-520)测定特征官能团;采用核磁共振仪(瑞士布鲁克,AVANCE Ⅲ HD 400)测定其相对于内部TMS的1H-NMR化学位移。
(2) 物性测试:采用比重瓶法测定离子液体的密度;采用黏度计(美国博勒飞,DV2T)测定离子液体的黏度;采用pH计(成都鑫益,PHS-3C+)测定离子液体的酸碱性;采用同步热分析仪(德国耐驰,STA 449 F5)测定离子液体的热稳定性。
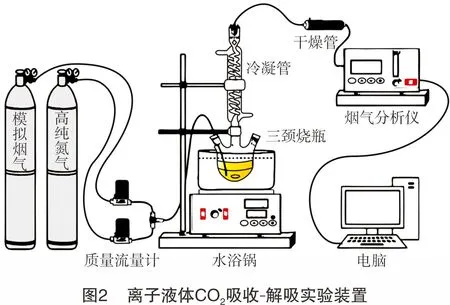
1.2.3吸收-解吸实验装置及操作步骤
离子液体吸收-解吸再生实验步骤:称取10 g离子液体于三颈烧瓶中,并将三颈烧瓶置于恒温水浴锅中。待离子液体温度稳定后,打开模拟烟气气瓶阀门,通过调节减压阀和转子流量计使气速稳定,通入三颈烧瓶,发生鼓泡吸收反应。利用烟气分析仪对净化气中CO2含量进行实时检测,每隔1 s记录一次数据,3 h后结束实验。
饱和吸收后的离子液体在高温下采用氮气气提的方式进行解吸,记录解吸温度和时间,多次进行吸收-解吸实验,考查离子液体循环性能。离子液体CO2吸收-解吸实验装置如图2所示。
2 结果与讨论
2.1 结构表征分析
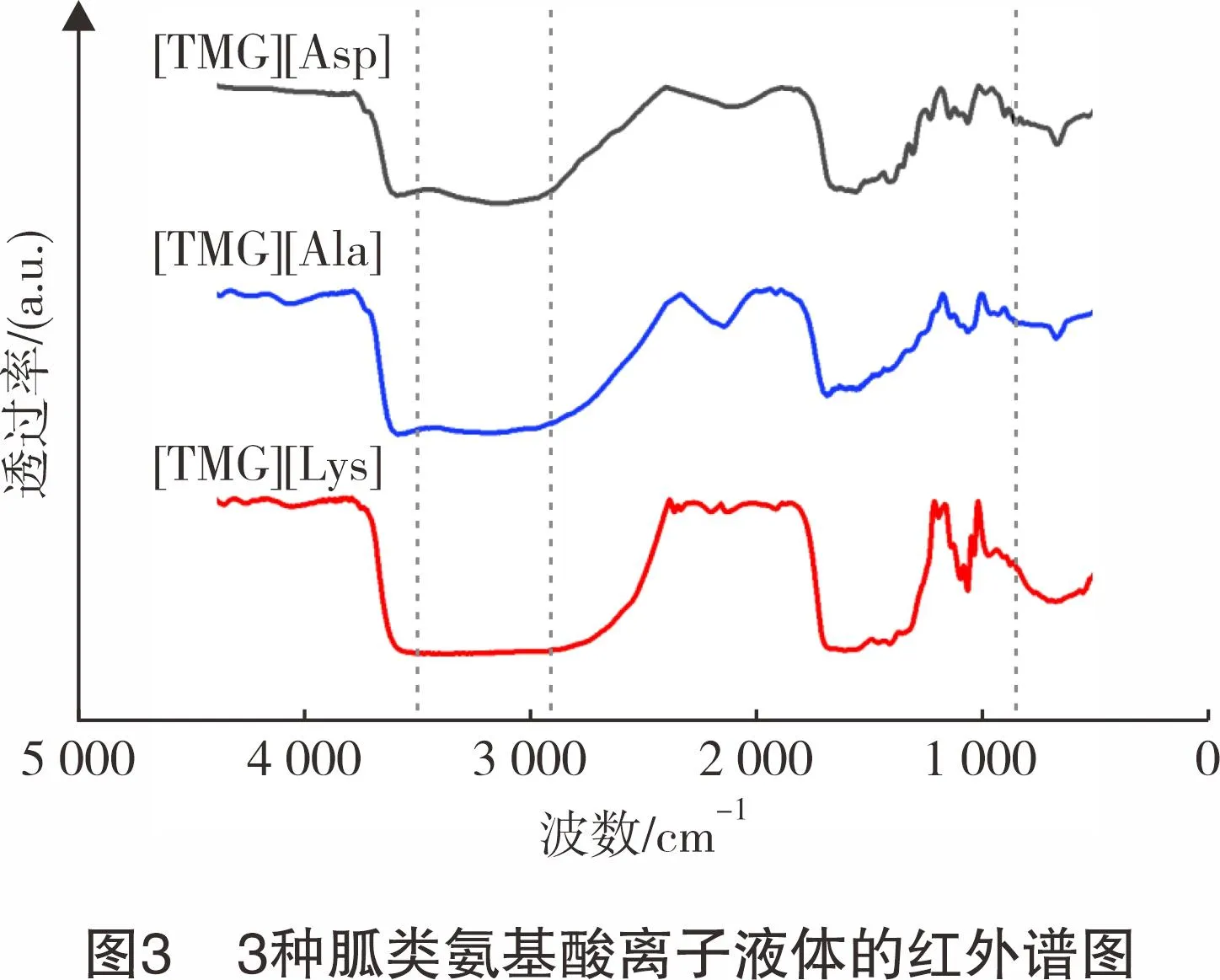
2.1.1FT-IR表征
对合成的胍类氨基酸离子液体进行FT-IR表征,结果如图3所示。在3 500 cm-1处的吸收峰归属于离子液体中存在的氢键,在2 900 cm-1附近的吸收峰归属于四甲基胍上的C-H的伸缩振动;在1 660 cm-1处的吸收峰归属于四甲基胍上的C=N键的伸缩振动峰以及氨基酸阴离子上的C=O键的伸缩振动峰;1 400 cm-1附近的强吸收峰为阴离子中羰基负离子(COO-)的对称伸缩振动峰;1 060 cm-1是C-N对应的振动吸收峰,这与胍类氨基酸离子液体的理论红外结构相符[22-24]。
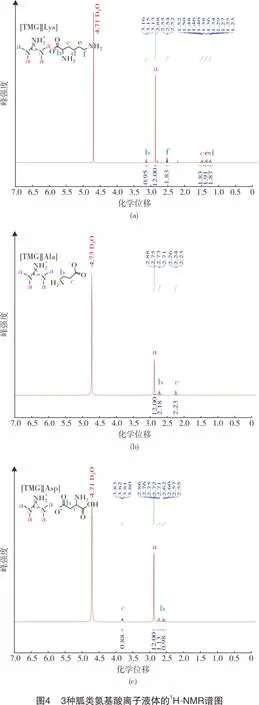
2.1.21H-NMR表征
为了进一步确定所制备胍类氨基酸离子液体的结构,以重水为溶剂,对3种胍类氨基酸离子液体进行了1H-NMR(400 MHz/500 MHz,D2O,25 ℃)分析,表征结果如图4所示。通过对3种胍基AA-ILs的1H-NMR谱图分析,所制备离子液体对应基团的质子氢原子个数以及对应的化学位移均符合理论核磁结构特征[22-25]。
2.2 物性测定结果
2.2.1基础物性测定
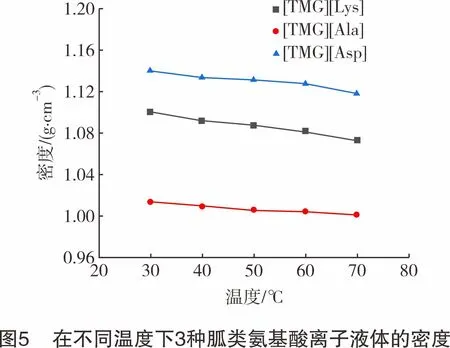
离子液体的密度、黏度、pH值等物性参数是影响吸收剂工业应用的重要参数。3种胍类氨基酸离子液体的密度随温度的变化趋势如图5所示,其密度由大到小的顺序为:[TMG][Asp]>[TMG][Lys]>[TMG][Ala],整体呈现随温度升高而减小的规律。这主要是由于离子液体受热时,内部分子的平均动能增加,导致分子间的相互作用力变弱、平均距离增加,从而使得单位体积内分子数减少,密度降低。在阳离子相同的情况下,阴离子的相对分子质量越大,离子液体密度越大。此外,碳链长度也会影响密度,[TMG][Lys]的相对分子质量虽然大于[TMG][Asp],但阴离子的碳链长,故其密度较小。
3种胍类氨基酸离子液体的黏度随温度变化的趋势见图6,整体呈现随温度升高而降低的规律。在30 ℃的条件下,[TMG][Lys]、[TMG][Ala]和[TMG][Asp]的黏度分别为88.08 mPa·s、56.17 mPa·s和22.63 mPa·s。

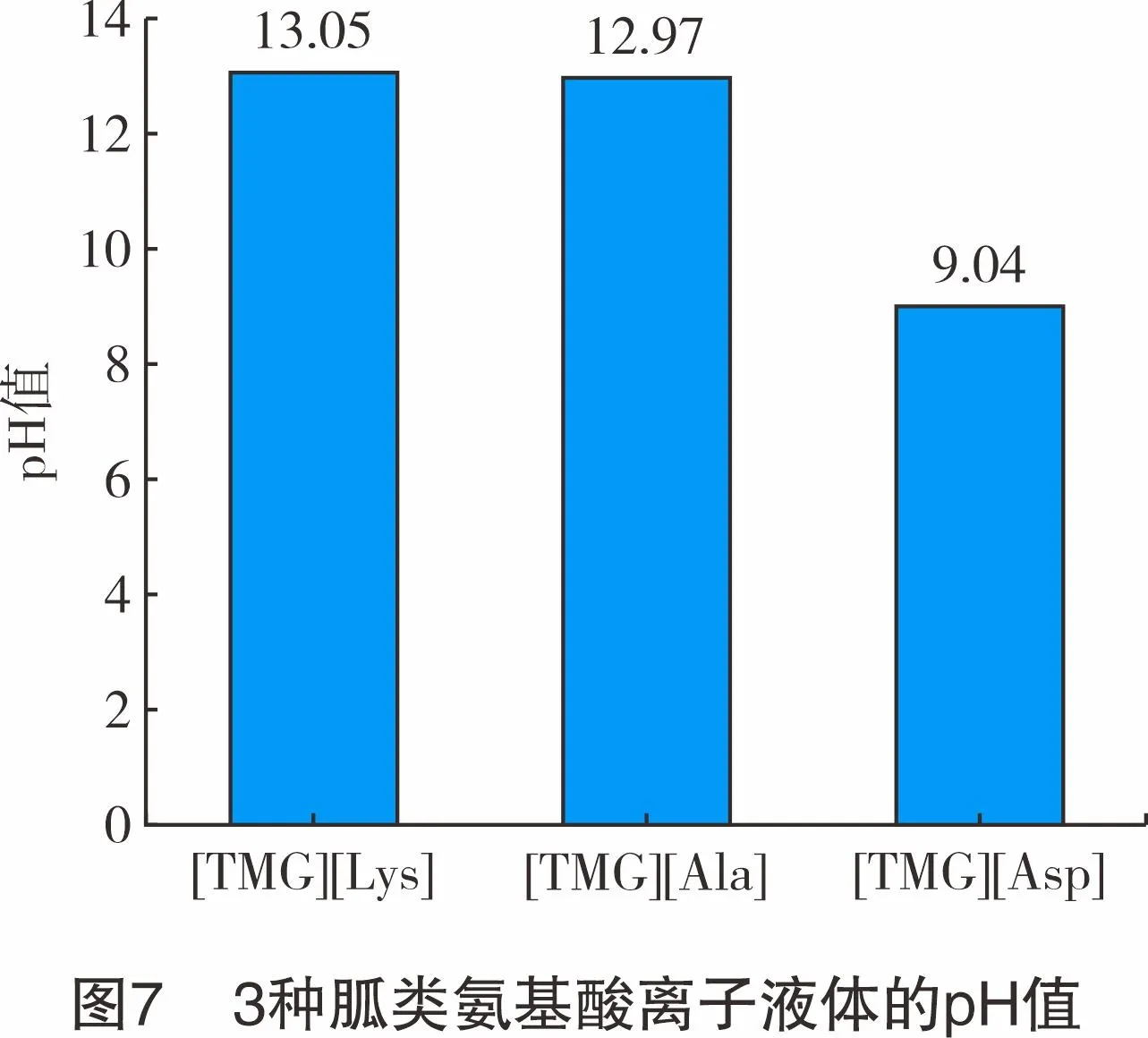
3种胍类氨基酸离子液体的pH值测定结果如图7所示,在常温下均为碱性,其碱性由强到弱为:[TMG][Lys]>[TMG][Ala]>[TMG][Asp]。[TMG][Asp]的pH值与其他两种离子液体差别较大,这是因为阴离子的碱性不同,赖氨酸([Lys])为天然碱性氨基酸,丙氨酸([Ala])为天然中性氨基酸,天冬氨酸([Asp])为天然酸性氨基酸。
2.2.2热稳定性测定
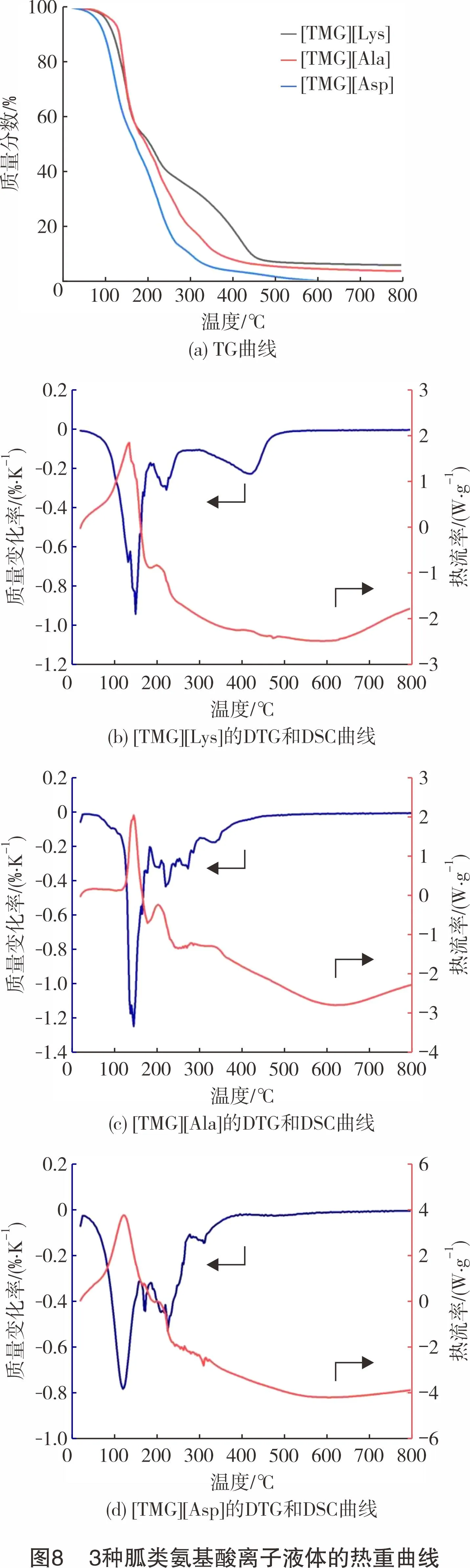
为明确3种离子液体的热稳定性,对3种胍类氨基酸离子液体进行了热重分析,结果如图8所示。[TMG][Lys]、[TMG][Ala]和[TMG][Asp]的分解温度分别为135 ℃、146 ℃和123 ℃。当温度低于120 ℃时,3种离子液体的质量损失较小,主要是离子液体中残留的溶剂和吸收的空气中水分,表明合成的胍类氨基酸离子液体热稳定性较好。
2.3 脱碳性能考查
2.3.1阴离子类型对脱碳效果的影响
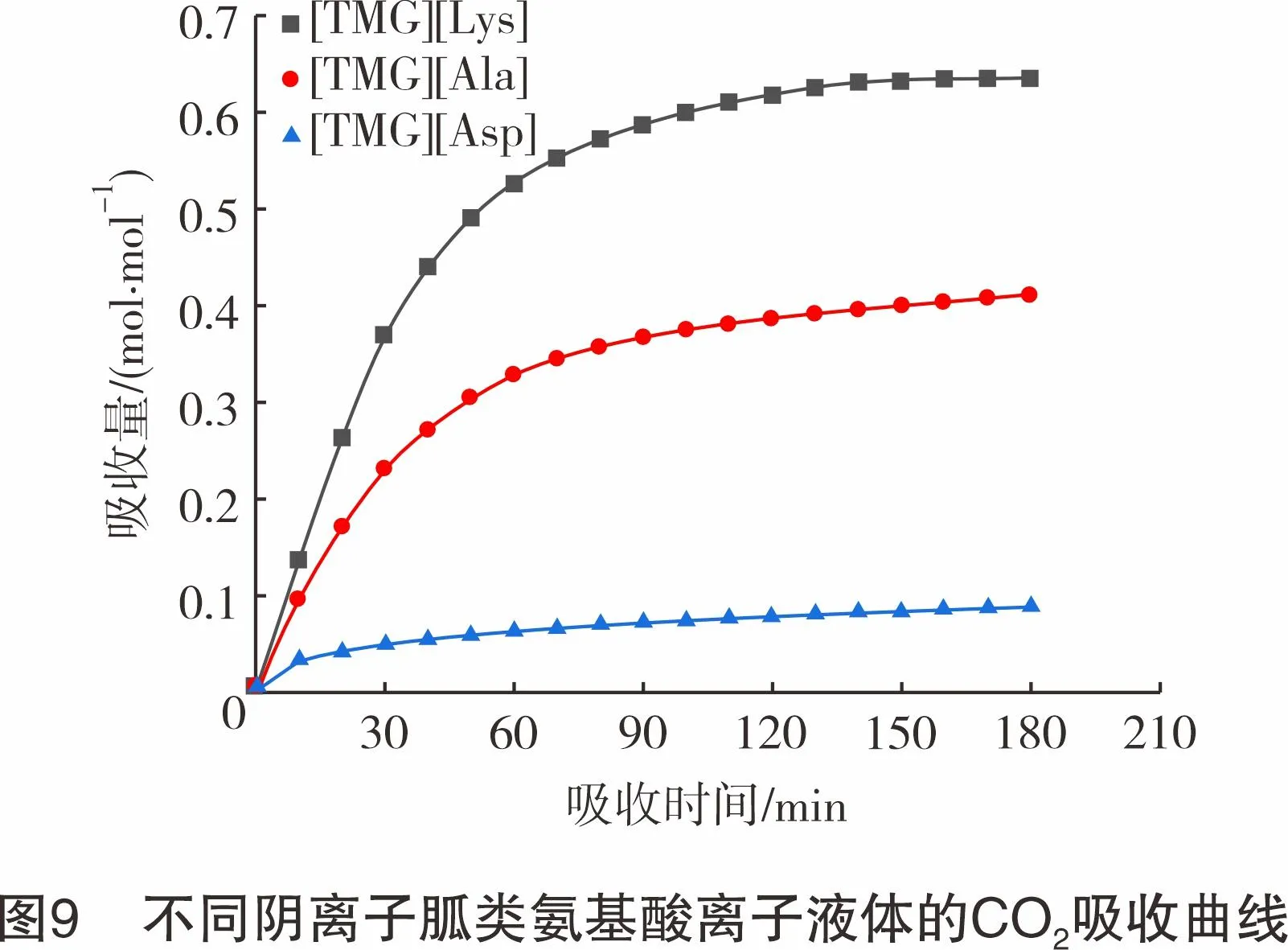
为考查阴离子类型对脱碳效果的影响,在常压、45 ℃、模拟烟气流量为80 mL/min的实验条件下测定了3种胍类氨基酸离子液体的脱碳性能,结果如图9所示。由图9可知,3种胍类氨基酸离子液体对CO2均表现出了一定的吸收能力,且吸收量随时间的增加呈现出先增大后趋于平衡的规律。相较于其他两种胍类氨基酸离子液体,[TMG][Lys]具有更好的吸收效果,为0.64 mol CO2/mol IL。这主要是由于[TMG][Lys]的碱性强于其他两种胍类氨基酸离子液体,且阴离子上含有两个氨基,具有更多的CO2结合位点,使其具有更高的CO2吸收量。
2.3.2模拟烟气流量对[TMG][Lys]脱碳效果的影响
为考查模拟烟气流量对脱碳效果的影响,在常压、45 ℃的实验条件下,测定模拟烟气流量在60~100 mL/min范围内[TMG][Lys]对CO2的吸收量,结果见图10。由图10可知,随着烟气流量的增大,吸收量随之提高,在80 mL/min时达到最高,为0.64 mol CO2/mol IL;随着模拟烟气流量的继续增大,吸收量减少。这是由于在该装置条件下,低流量下推动力较小,气体与吸收液接触不充分,吸收量较低,且模拟烟气流量过大,[TMG][Lys]与CO2反应时间减少,部分[TMG][Lys]未充分反应。因此,选择80 mL/min为最佳模拟烟气流量。

2.3.3温度对[TMG][Lys]脱碳效果的影响
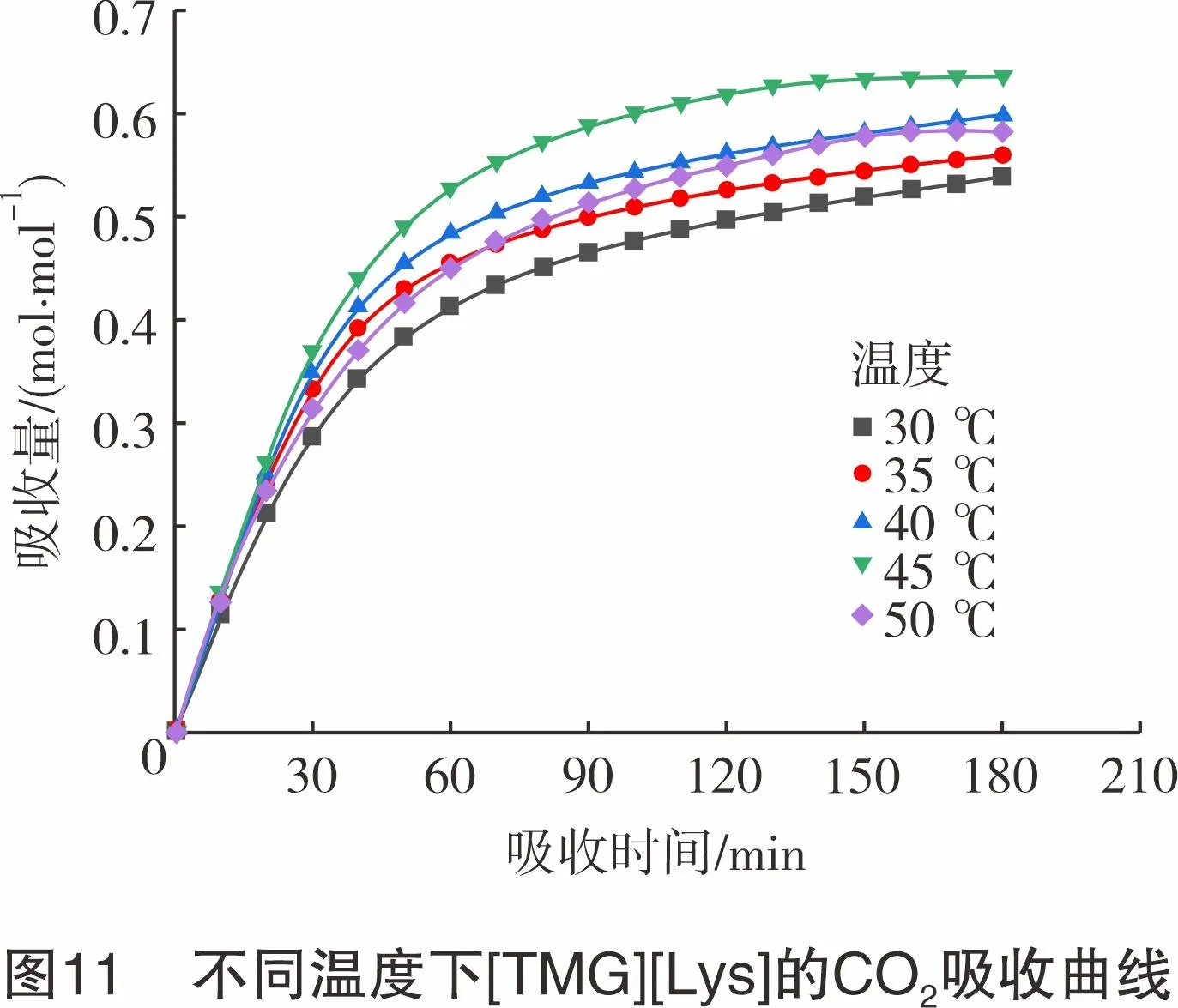
为考查温度对脱碳效果的影响,在常压、模拟烟气流量为80 mL/min的实验条件下,测定温度为30~50 ℃时[TMG][Lys]对CO2的吸收量,结果如图11所示。由图11可知,随着温度的上升,[TMG][Lys]对CO2的吸收量逐渐增大,在45 ℃时达到最大,为0.64 mol CO2/mol IL,继续升温,CO2的吸收量开始逐渐降低。由此可见,随着温度的升高,ILs黏度降低,传质阻力减少,CO2在ILs中扩散速率增大,吸收速率加快,吸收量随之增大;但由于CO2吸收是放热过程,当温度继续升高时,逆反应速率加快,反应将向解吸方向进行,导致CO2的吸收量降低。因此,选择45 ℃为最佳吸收温度。
2.3.4与30%MEA吸收性能对比
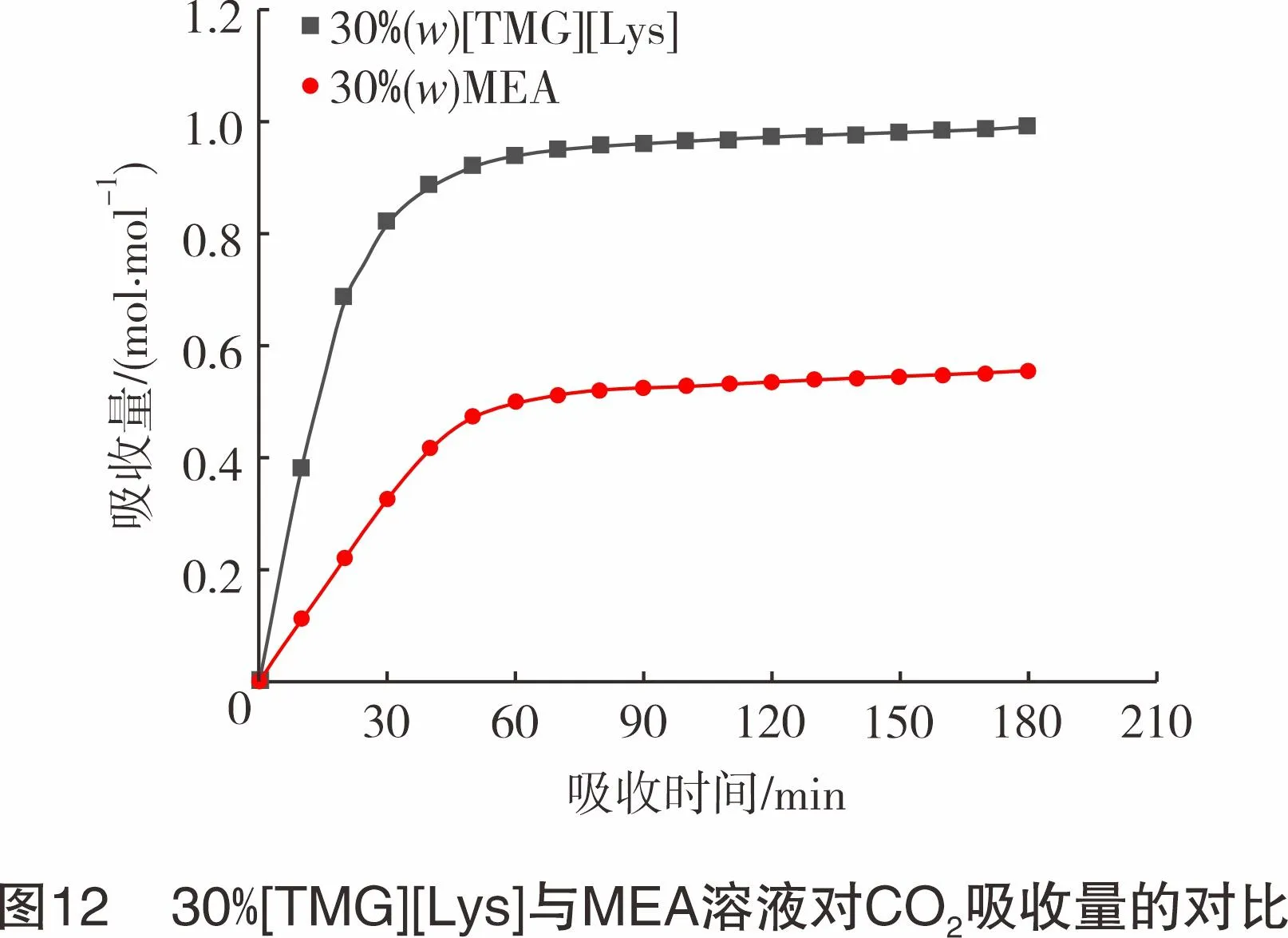
为了节约吸收液成本,考查[TMG][Lys]水溶液的吸收性能,在常压、45 ℃、80 mL/min的条件下,对比质量分数(下同)为30%的[TMG][Lys]水溶液与工业常用吸收剂MEA溶液的吸收效果,结果见图12。由图12可知,[TMG][Lys]水溶液比MEA溶液的吸收效果更好,其吸收量可达到0.99 mol CO2/mol IL,为30% MEA溶液吸收量(0.56 mol CO2/mol MEA)的1.77倍,也优于纯离子液体吸收的吸收效果,且由于水的加入,吸收液成本大幅降低,具备进一步工业化应用的可能性。
2.4 循环性能考查
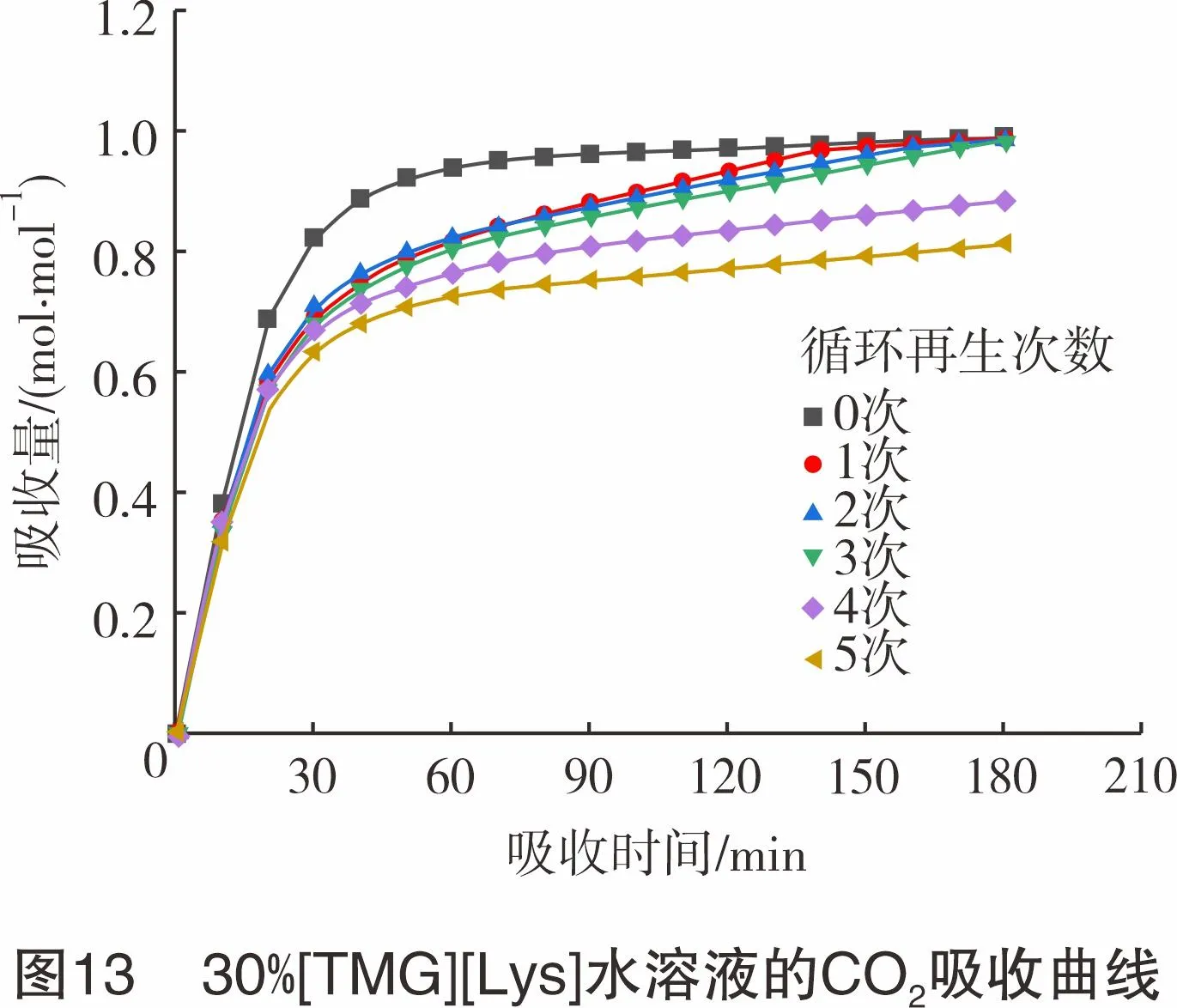
为考查[TMG][Lys]水溶液的循环再生性能,对30%[TMG][Lys]水溶液进行了5次吸收-解吸循环实验,结果如图13所示。由图13可知,在循环使用后,复配溶液对CO2的捕集能力呈现略微下降的趋势,这可能是由于在解吸过程中离子液体有损耗,导致有效脱碳组分含量降低;其次,在实验条件下,解吸过程中CO2未能完全被解吸,导致复配体系吸收容量略微降低。但循环使用5次后,30%[TMG][Lys]水溶液的吸收量仍能达到0.81 mol CO2/mol IL以上,优于30%MEA新鲜吸收液的吸收量,说明该离子液体具有较好的循环性能。
2.5 [TMG][Lys]-MEA-H2O复合吸收剂脱碳性能考查
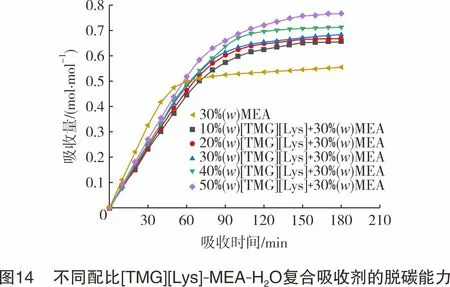
将[TMG][Lys]加入MEA水溶液中,配成5种不同配比的复合吸收剂,其中,MEA质量分数均为30%,[TMG][Lys]质量分数分别为10%、20%、30%、40%和50%。5种复合吸收剂在常压、45 ℃和80 mL/min的条件下对CO2的吸收性能见图14。由图14可知,5种复合吸收剂在3 h内的吸收量分别为:0.66 mol/mol、0.67 mol/mol、0.69 mol/mol、0.71 mol/mol和0.77 mol/mol。复合吸收剂对CO2的吸收量随着时间逐步增加,105 min后趋于平缓。随着离子液体质量分数的增大,吸收剂整体吸收量也随之增大,加入[TMG][Lys]后有效提高了吸收剂对CO2的吸收量。
2.6 [TMG][Lys]脱碳机理分析
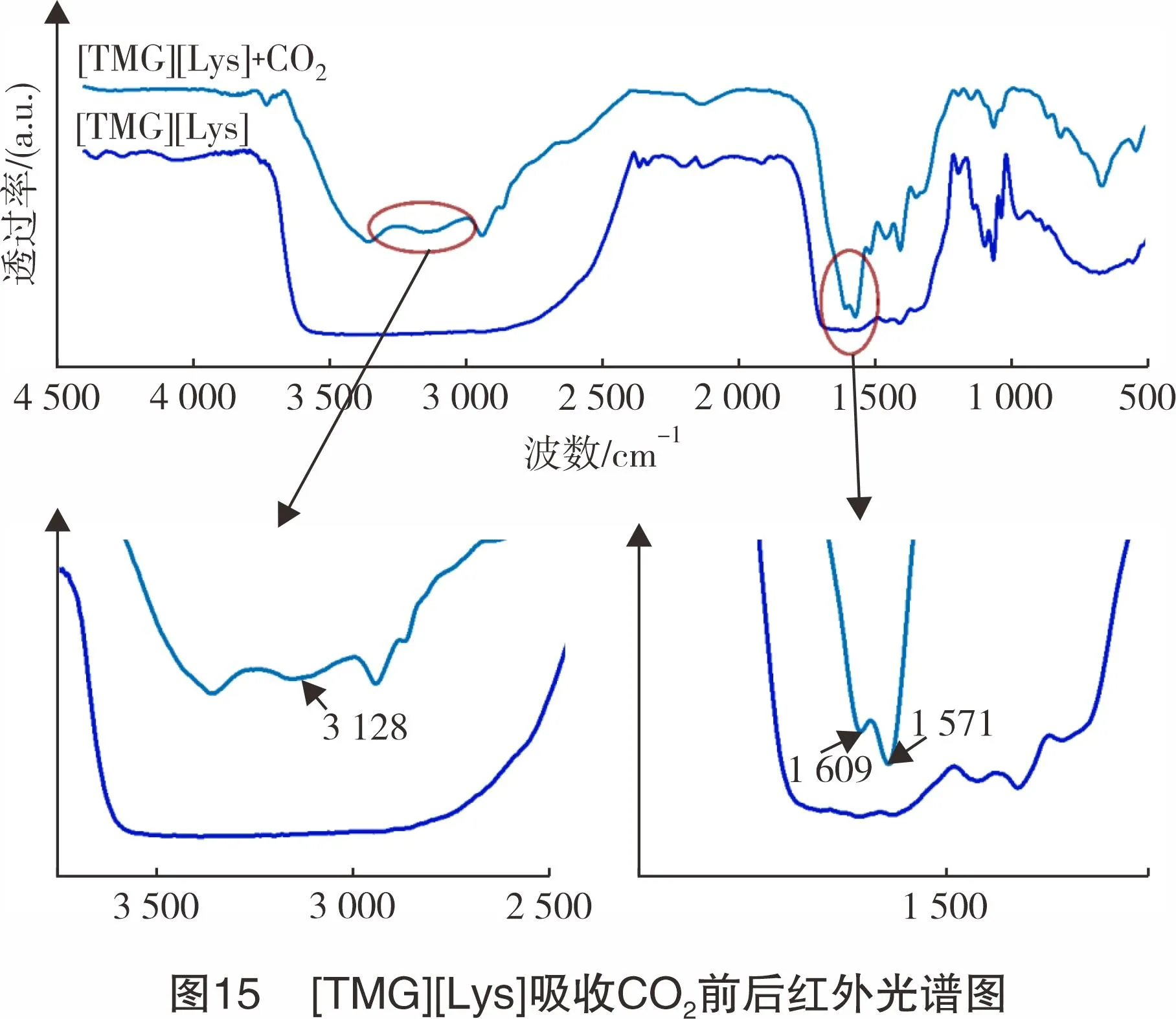
为了研究[TMG][Lys]离子液体吸收CO2的机理,将吸收CO2前后的[TMG][Lys]离子液体进行FT-IR分析,结果见图15。由图15可知,在FT-IR谱图中,3 128 cm-1处归属为-OH的伸缩振动吸收峰;1 609 cm-1处归属为氨基甲酸酯中C=O的伸缩振动吸收峰;1 571 cm-1处归属为氨基甲酸酯中-NH的特征吸收峰,其原因可能是[TMG][Lys]阴离子上的氨基与CO2结合,生成了氨基甲酸酯。
为了证实吸收后的产物,将吸收CO2前后的[TMG][Lys]离子液体进行核磁氢谱分析,见图16。
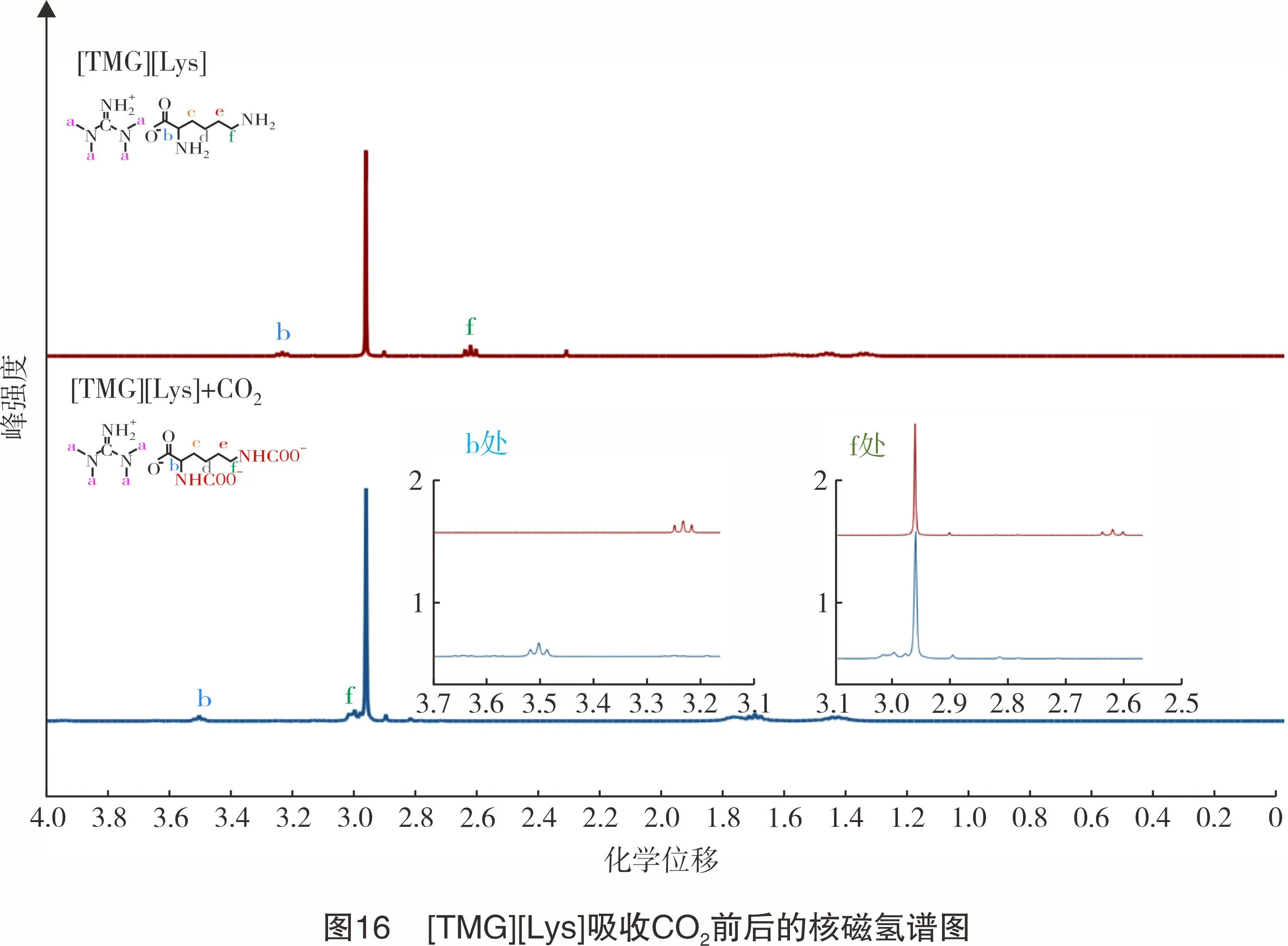
由图16可知,b处和f处的化学位移发生了明显的偏移,向低场移动,这可能是由于相邻支链上的-NH2基团与CO2反应生成了-NHCOO-,导致b处和f处相邻支链的基团不同、电负性改变,进一步证明了氨基甲酸酯的生成。[TMG][Lys]脱碳机理即阴离子上的氨基与CO2反应生成氨基甲酸酯,与文献所报道的脱碳机理类似[25-27]。
3 结论
(1) 通过一步法成功合成了低黏度、高热稳定性的3种胍类氨基酸离子液体。
(2) 阴离子碱性较大的[TMG][Lys]纯离子液体对CO2吸收达到0.64 mol CO2/mol IL。对吸收CO2后的[TMG][Lys]离子液体进行表征分析,表明[TMG][Lys]吸收CO2主要是由于阴离子上的氨基与CO2反应生成氨基甲酸酯。
(3) 在45 ℃和80 mL/min的条件下,30%的[TMG][Lys]水溶液对CO2的吸收量可以达到0.99 mol CO2/mol IL,优于工业吸收剂30%的MEA,在5次循环吸收后仍有较好的吸收效果。
(4) 将[TMG][Lys]离子液体加入MEA水溶液中可以强化模拟烟气中CO2的吸收,增大CO2的吸收量。

