ZnFe2O4光催化还原Cr(Ⅵ)及其机理研究
王宏斌,侯岳茹,蒋良兴, ,刘芳洋, ,贾明,张宗良
(1. 中南大学 冶金与环境学院,湖南 长沙,410083;2. 有色金属增值冶金湖南省重点实验室,湖南 长沙,410083)
在电镀、制革、抛光和印刷等行业废水中,铬元素主要以Cr(Ⅵ)和Cr(Ⅲ)的形式存在[1-2],Cr(Ⅵ)具有毒性、致癌性和诱变性,而Cr(Ⅲ)通常毒性较低且在碱性溶液中容易析出。目前,用于处理水体中的Cr(Ⅵ)的方法很多,如吸附法[3-4]、离子交换法[5]、电化学还原法[6]、膜过滤法[1]和光催化法[7]。其中,光催化法操作简单、成本低廉、可重复使用,被认为是一种理想的处理含Cr(Ⅵ)废水的方法。XU 等[8]采用水热法合成了具有较大比表面积和优异光催化性能的p 型半导体纳米CuFeO2,在60 min 内对Cr(Ⅵ)的还原效率可达96%。KENFOUD 等[9]采用硝酸还原法制备了尖晶石CaFe2O4纳米粒子,在优化条件下,Cr(Ⅵ)的还原率可达到86%。WANG等[10]综述了MOFs材料在光催化还原Cr(Ⅵ)的研究进展,认为MOFs 在Cr(Ⅵ)还原和有机污染物降解方面具有广阔的应用前景。然而,目前常见光催化剂的制备方法复杂、成本高昂且难以回收利用,需要一种制备简单、性能优越且能够大规模使用的光催化剂。
ZnFe2O4是一种对可见光敏感的n 型磁性半导体材料,禁带宽度较窄(1.96 eV 左右),具有良好的光化学稳定性和可回收性,是一种很有潜力的光催化剂[11-12]。文献中报道了多种ZnFe2O4光催化剂的制备方法,包括水热法[13]、共沉淀法[14]、静电纺丝法[15]和溶胶凝胶法[16]等,但其制备工艺复杂、成本高等缺陷仍未得到解决,影响了其实际应用。传统湿法炼锌的工艺流程为焙烧—浸出—电积,在焙烧过程中,铁、锌氧化物在高温条件下反应生成铁酸锌(ZnFe2O4)[17],采用常规浸出难以溶解,目前多采用火法还原和热酸浸出处理。以湿法炼锌中浸渣为原料制备ZnFe2O4光催化剂用于还原水体中的Cr(Ⅵ),可同时实现资源的高效利用和污水处理。
但ZnFe2O4在可见光下载流子复合严重的问题导致其光催化活性低。TAO 等[18]采用溶剂热法制备了Bi2WO6/ZnFe2O4异质结,光生电子空穴对在异质结构中有效分离,大幅提升了ZnFe2O4纳米纤维的光催化性能。LIU等[19]采用水热法制备了负载Ag 纳米线的ZnFe2O4纳米颗粒,Ag 和ZnFe2O4之间产生的肖特基界面提高了光生载流子的分离效率,大幅提升了光催化还原Cr(Ⅵ)的性能。ISLAM等[20]以0.40%(质量分数)的甲酸作为空穴消耗剂提升ZnFe2O4的光催化还原效率,在反应4 h内,ZnFe2O4纳米颗粒对Cr(Ⅵ)的还原效率达到95.4%。除甲酸外,柠檬酸、草酸和甲醇等均可用作空穴消耗剂来提升光催化还原效率,但对于乙二胺四乙酸(EDTA)的研究较少。
本文作者以传统湿法炼锌过程产生的中浸渣为原料,通过一定的预处理得到纯度较高的ZnFe2O4光催化剂,用于水体中Cr(Ⅵ)的光催化还原;同时,为解决单相ZnFe2O4光生电子空穴对复合严重导致的光催化活性低的问题,加入EDTA作为空穴消耗剂提升其光催化还原Cr(Ⅵ)的效率,并研究反应时间、EDTA 浓度、光催化剂用量、Cr(Ⅵ)溶液初始浓度和pH 等参数对还原效率的影响,测试材料的循环稳定性。
1 实验
1.1 实验材料
ZnFe2O4中浸渣取自株洲冶炼集团有限公司;盐酸(HCl,纯度37%)购自国药控股化学试剂有限公司,乙醇(CH3CH2OH,纯度≥99.5%);氢氧化钠(NaOH,纯度97%)、硫酸钠(Na2SO4,纯度99%)、重铬酸钾标准溶液(K2Cr2O7,浓度1/60 mol/L)、EDTA 缓冲液(C10H16N2O8,浓度0.5 mol/L)、二甲基亚砜(C2H6SO,纯度99%)均购自阿拉丁(中国上海);实验用水为去离子水。
1.2 材料表征
采用X射线衍射仪(XRD,X'Pert PRO MPD)对预处理前后的ZnFe2O4进行物相分析,采用扫描电子显微镜(SEM,Zeiss Sigma 300)对材料进行形貌表征,采用X 射线光电子能谱(XPS,Thermo ESCALAB 250XI)分析材料中元素化学态,采用傅里叶变换红外光谱仪(FT-IR,Nicolet Nexus 470)分析材料表面的分子结构和基团,采用紫外可见分光光度计(UV-vis)测试Cr(Ⅵ)溶液和ZnFe2O4薄膜的吸光度。
1.3 实验过程
1.3.1 材料预处理
对传统湿法炼锌过程产生的主要成分为ZnFe2O4的中浸渣进行除杂。取一定量ZnFe2O4浸出渣,加入过量的浓盐酸搅拌反应20 min,转速为400 r/min,通过离心的方式水洗除杂3~5次,直至上层液pH 为中性,最后用乙醇冲洗2~3 次并高温烘干备用。
1.3.2 光学性能测试
首先,采用滴涂工艺制备ZnFe2O4薄膜。将10 mg 的粉末样品分散在1 mL DMSO 溶剂中,超声振荡1 h,将悬浮液滴在FTO 基底上,于100 ℃烘干。然后,以ZnFe2O4薄膜光电极为工作电极、饱和甘汞电极为参比电极、铂电极为对电极,浓度1.0 mol/L 的Na2SO4溶液为电解质, 在PARSTAT4000 电化学工作站中采用三电极体系检测材料的平带电位。
1.3.3 光催化还原Cr(Ⅵ)
将一定量(10~60 mg) ZnFe2O4放至50 mL K2Cr2O7(10~50 mg/L)水溶液中,并加入0.1 mL EDTA溶液,暗态搅拌30 min,反应体系达到吸脱附平衡。采用氙灯光源,并控制光强为100 mW/cm2,搅拌器转速300 r/min,进行光催化反应。每隔20 min 取上层液3 mL,在8 000 r/min 转速下离心5 min,取上清液。用紫外可见分光光度计在Cr(Ⅵ)特征波长(350 nm)处测溶液的吸光度,进而确定浓度。根据式(1)计算Cr(Ⅵ)的还原率:
式中:η为溶液中Cr(Ⅵ)的还原率,%;C0为Cr(Ⅵ)溶液的初始浓度,mol/L;Ct为反应t时刻Cr(Ⅵ)溶液的浓度,mol/L。
2 结果与讨论
2.1 ZnFe2O4光催化剂的表征
预处理前后ZnFe2O4的XRD 图谱如图1(a)所示。从图1(a)可见:中浸渣的特征峰分别对应尖晶石相ZnFe2O4(JCPDS:89-1012)、ZnO(JCPDS:76-0704)和CaSO4·2H2O(JCPDS:33-0331),与大部分文献报道的主要成分一致[21]。经过预处理后,ZnO、CaSO4·2H2O 和其他杂质均被除去,衍射图谱中除ZnFe2O4和SiO2的特征峰外,并未观察到其余衍射峰;2θ为18.20°、29.96°、35.27°、42.86°、53.16°、56.29°、62.23°和73.59°的特征峰分别对应ZnFe2O4的(111)、 (220)、 (311)、 (400)、 (422)、(511)、(440)和(533)晶面。

图1 预处理前后ZnFe2O4的XRD图谱和傅里叶红外光谱图Fig. 1 XRD patterns and Fourier transform infrared spectra of ZnFe2O4 before and after pretreatment
图1(b)所示为预处理前后ZnFe2O4在400~4 000 cm-1范围内的傅里叶红外光谱图。通常,具有尖晶石结构的ZnFe2O4在400~800 cm-1范围内能观察到2个主要的吸收峰,分别与占据四面体和八面体空隙位置的金属离子与氧离子相互作用引起的伸缩振动有关[22]。在443.9 cm-1和608.49 cm-1处的吸收峰分别与Fe—O 和Zn—O 键的伸缩振动有关,且预处理后ZnFe2O4的特征吸收峰明显增强。在871.03 cm-1处微弱的吸收峰是由C—H弯曲振动引起的[23],在1 154.30 cm-1处的吸收峰与C—O 拉伸振动有关[24],表明预处理前后ZnFe2O4表面存在有机基团。在1 626.26 cm-1处尖锐的吸收峰是由O—H的对称振动引起的,在3 410.67 cm-1处峰形宽钝的吸收峰与O—H 拉伸振动有关,均与ZnFe2O4表面吸附H2O 有关,经过高温烘干后,峰强明显减弱[25-26]。
预处理前后ZnFe2O4的形貌如图2 所示。由图2(a)~(c)可见:预处理前,中浸渣形状不规则,大小不均匀,这与其成分复杂有关;经过预处理后,中浸渣中的杂质基本被去除,ZnFe2O4呈不规则的块状结构,表面分散有大量的颗粒,粒径分布在0.001~100 nm 之间。从图2(d)可见,Zn 和Fe 的原子比接近1∶2,且Zn、Fe 和O 的元素分布完全一致,进一步证明样品的主要成分为ZnFe2O4。

图2 中浸渣预处理前后的SEM照片及所选区域及其对应的EDS面扫描Fig. 2 SEM images of mid-leaching slag before and after pretreatment and EDS surface scanning of selected area
采用X 射线光电子能谱(XPS)进一步确认了预处理后ZnFe2O4的元素化学态,结果如图3 所示。从图3(a)可见样品主要含Zn、Fe、O和Si元素;从图3(b)可见,531.98 eV处的峰与表面晶格氧有关,包括Zn—O和Fe—O键[27];从图3(c)可见,Fe 2p3/2可以拟合成710.98 eV 和713.82 eV 两个峰,而719.09 eV 和724.31 eV 的峰对应Fe 2p1/2,证明了ZnFe2O4中Fe3+的存在[4,28]。从图3(d)可见,1 044.53 eV 和1 021.63 eV 处的峰分别对应Zn 2p1/2和Zn 2p3/2[29]。
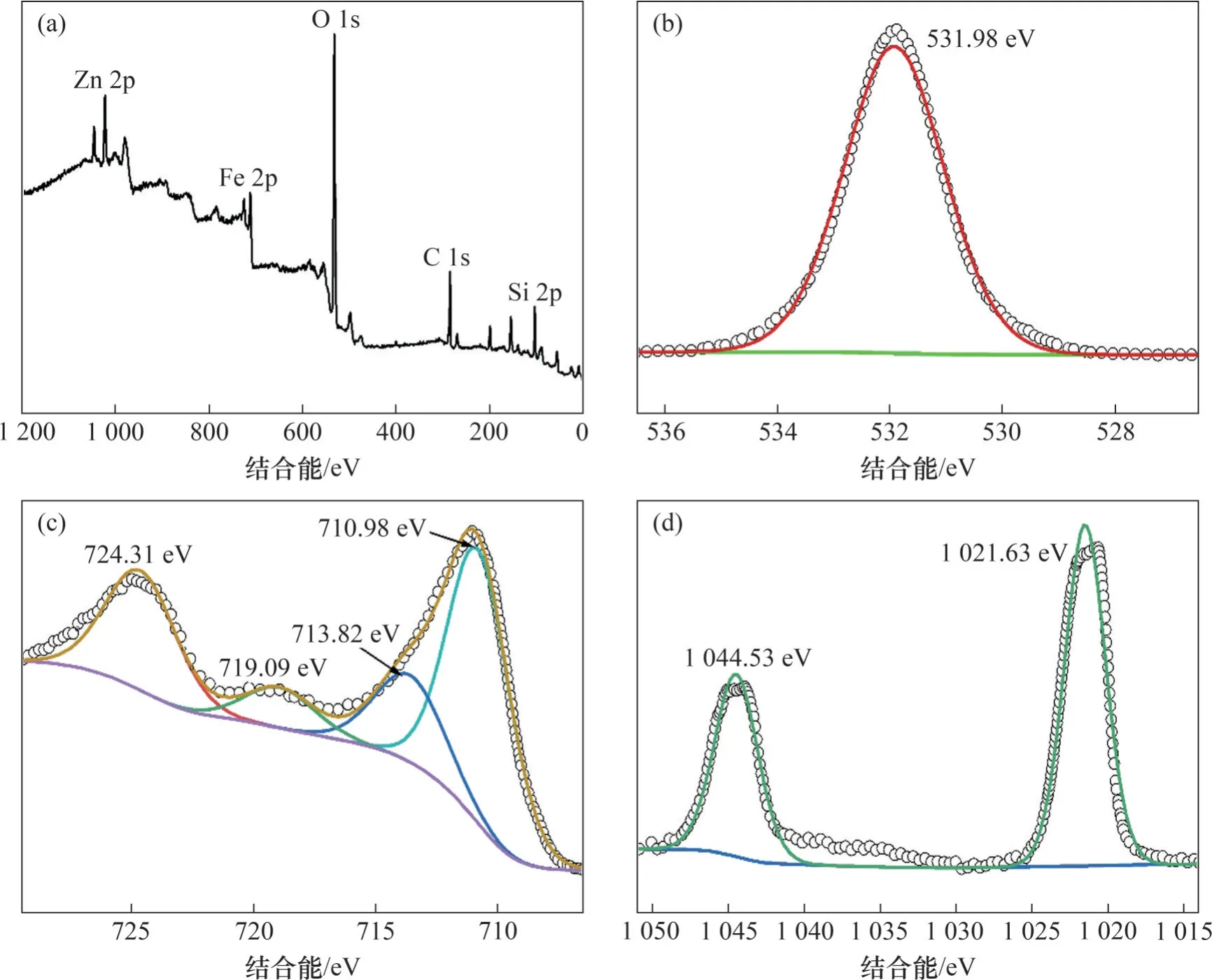
图3 ZnFe2O4的XPS谱图Fig. 3 XPS spectra of ZnFe2O4
2.2 ZnFe2O4光催化还原Cr(Ⅵ)的性能
2.2.1 EDTA的影响
在ZnFe2O4添加量为50 mg、Cr(Ⅵ)溶液初始质量浓度为20 mg/L、pH=6.7 的条件下,研究ZnFe2O4、EDTA 和光源对Cr(Ⅵ)还原的影响,结果如图4(a)和4(b)所示。从图4(a)和4(b)可见:单相ZnFe2O4在光照2 h 后,Cr(Ⅵ)的还原率仅为11.12%,光催化性能差;在没有ZnFe2O4光催化剂或光源照射的条件下,观察到类似情况,Cr(Ⅵ)的还原率均可以忽略不计,这与文献报道的一致[30-31];而加入EDTA 后,Cr(Ⅵ)的还原率显著提高,说明ZnFe2O4/EDTA 溶液体系有利于Cr(Ⅵ)的光催化还原。进一步研究EDTA加入量对Cr(Ⅵ)还原的影响可知,随着EDTA 加入量从0.025 mL 增加至0.1 mL,Cr(Ⅵ)的还原率从37.78%提升至96.76%;当EDTA 的加入量增加至0.2 mL 时,Cr(Ⅵ)的还原率降低至84.67%,这是由于过量的EDTA 会吸附在ZnFe2O4光催化剂表面,影响ZnFe2O4在溶液中的有效分散,导致固液传质发生改变,进而减弱了光催化还原性能[32-33]。
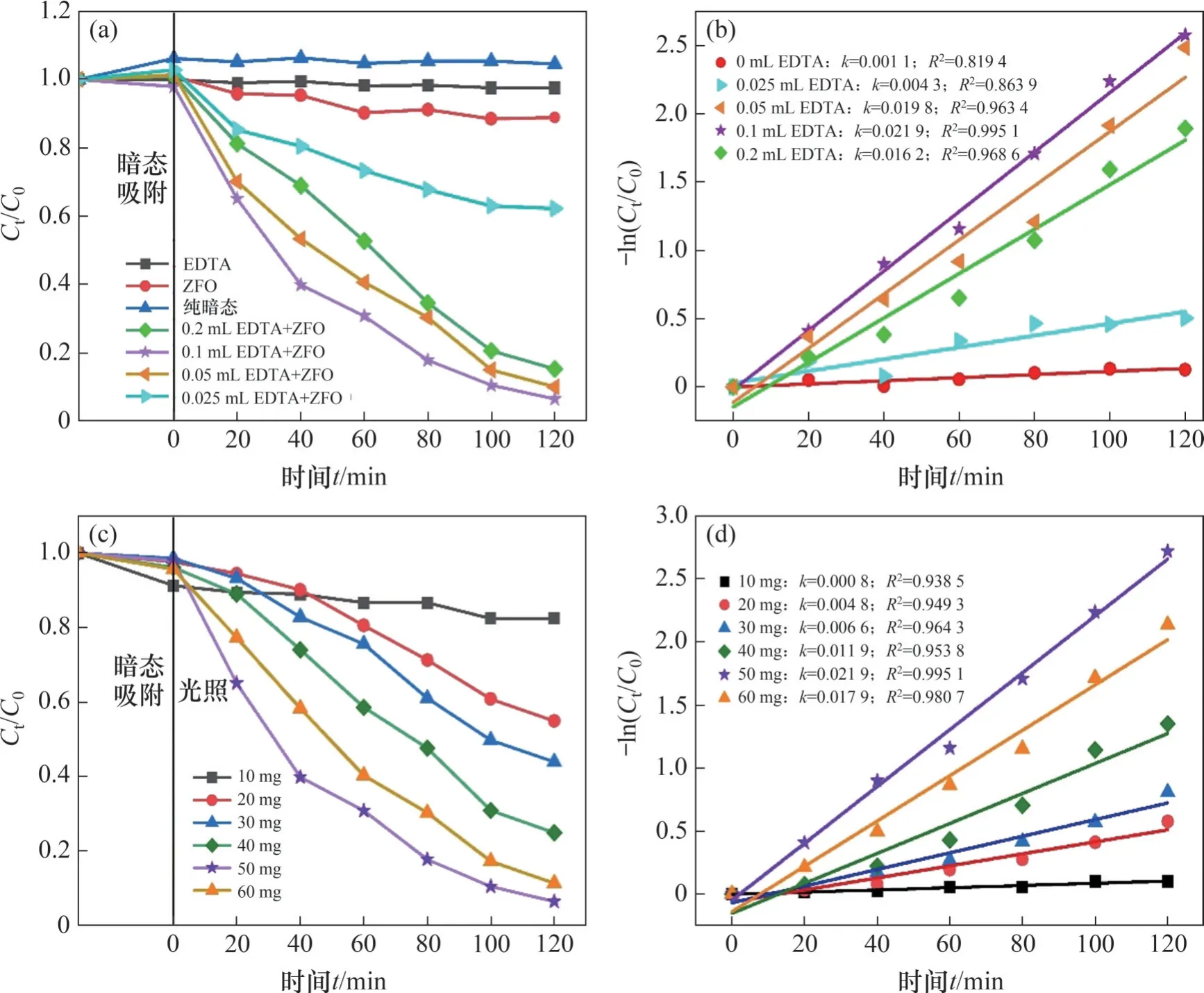
图4 EDTA和ZnFe2O4用量对ZnFe2O4光催化还原Cr(Ⅵ)的影响Fig. 4 Effects of EDTA and ZnFe2O4 dosage on photocatalytic reduction of Cr(Ⅵ) by ZnFe2O4
为了定量比较不同EDTA 加入量下ZnFe2O4对Cr(Ⅵ)的光催化还原性能,基于准一级动力学模型得到Cr(Ⅵ)的还原反应速率常数k[34]:
根据-ln(Ct/C0)与t的线性关系,得到了反应速率常数k和相关系数R2,如图4(b)所示,可见R2接近1,说明不同体系下光催化还原反应均符合一级动力学。加入0.1 mL EDTA 时,反应速率常数最大,为0.021 9 min-1。
2.2.2 ZnFe2O4用量的影响
在Cr(Ⅵ)溶液初始质量浓度为20 mg/L、pH=6.7、EDTA加入量为0.1 mL的条件下,ZnFe2O4的用量对光催化还原Cr(Ⅵ)的影响如图4(c)和4(d)所示。从图4(c)和4(d)可见:随着ZnFe2O4用量从10 mg 增加到50 mg,还原效率从17.59%提升至96.76%,还原速率常数也从0.000 8 min-1增加到0.021 9 min-1。然而,ZnFe2O4用量的进一步增加会导致光催化还原效率降低。这些归因于在多相光催化反应中,适量的光催化剂能够提供反应所需的活性位点,同时不影响可见光的透射;过量的光催化剂会发生颗粒聚集、活性位点重叠,导致光的散射和屏蔽效应[35-36]。
2.2.3 Cr(Ⅵ)溶液初始质量浓度的影响
Cr(Ⅵ)初始质量浓度对还原效率的影响如图5(a)和5(b)所示。从图5(a)和5(b)可见:当Cr(Ⅵ)初始质量浓度为10 mg/L 和20 mg/L 时,还原效率基本一致,速率常数略有不同;随着C0的增加,Cr(Ⅵ)的还原效率从96.76%下降至47.05%,还原速率常数从0.021 9 min-1减小到0.004 8 min-1。这是由以下原因引起的:1) 溶液中Cr(Ⅵ)质量浓度越小,Cr(Ⅵ)吸附在光催化剂表面并参与还原反应的比例越高;2) Cr(Ⅵ)还原产生的Cr(Ⅲ)越少,对ZnFe2O4表面活化中心的占据越少;3) 较低的Cr(Ⅵ)质量浓度有利于可见光照射到光催化剂[37-39]。然而,Cr(Ⅵ)的质量浓度过低也会对光催化还原效率造成影响,Cr(Ⅵ)对活性位点的竞争占主导地位,反应迅速发生,但后期由于Cr(Ⅵ)的质量浓度过低导致吸附驱动力不足,Cr(Ⅵ)在ZnFe2O4表面难以吸附并还原[40]。
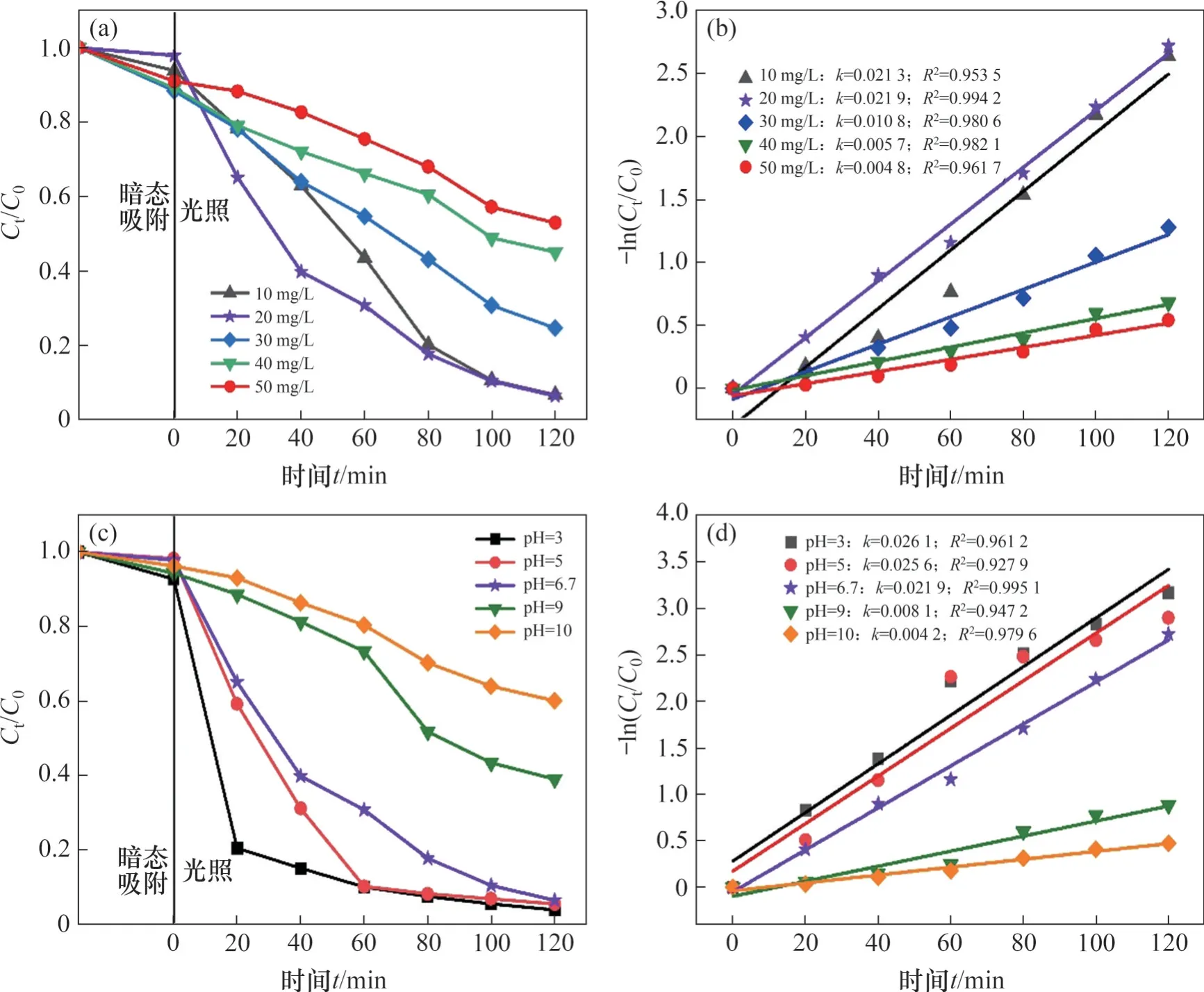
图5 Cr(Ⅵ)溶液初始浓度和pH对Cr(Ⅵ)还原性能的影响Fig. 5 Effects of initial concentration of Cr (Ⅵ) solution and pH on photocatalytic reduction performance
2.2.4 pH的影响
溶液的pH 对Cr(Ⅵ)光催化还原性能的影响如图5(c)和5(d)所示。从图5(c)和5(d)可见:溶液的pH 越低,ZnFe2O4对Cr(Ⅵ)的光催化还原率越高;当还原速率常数从0.004 2 min-1增加至0.026 1 min-1时,还原效率提升至97.95%。通常,Cr(Ⅵ)在溶液中依赖于pH 以HCrO-4、Cr2O2-7或CrO2-4的形式存在。在酸性溶液中,HCrO-4占主导地位,并随着pH 的增加转变为[41]。据报道,ZnFe2O4的零电荷点(pHpzc)在4 左右,当pH>4 时,表面带负电荷,pH<4 时表面带正电荷[42]。因此,在不同pH下,ZnFe2O4表面电荷与不同存在形式的Cr(Ⅵ)之间存在静电相互作用,pH越低,ZnFe2O4对Cr(Ⅵ)的吸附趋势越强。Cr(Ⅵ)还原为Cr(Ⅲ)的过程取决于pH,可通过以下方程描述:
在酸性条件下,大量的H+有利于光催化还原反应(3)的正向进行;在碱性条件下,主要发生反应(4),生成的Cr(OH)3会沉淀在ZnFe2O4表面,减小了光催化剂对光的吸收并抑制了反应的进行[43-44]。
2.2.5 循环性能
ZnFe2O4的循环稳定性是评价其光催化性能的重要指标。每个循环周期包括30 min 暗态吸附和120 min 可见光照射,每个循环周期结束后,离心分离ZnFe2O4,用1 mol/L的HNO3溶液和去离子水分别清洗2~3 次,在100 ℃下干燥备用。ZnFe2O4光催化剂的循环性能曲线和Cr(Ⅵ)溶液的吸光度曲线如图6 所示。从图6(a)可见:前2 次循环对Cr(Ⅵ)的还原效率均达90%以上,经过5 次循环,还原效率仍然能够达到约65%,表现出较好的循环性能。
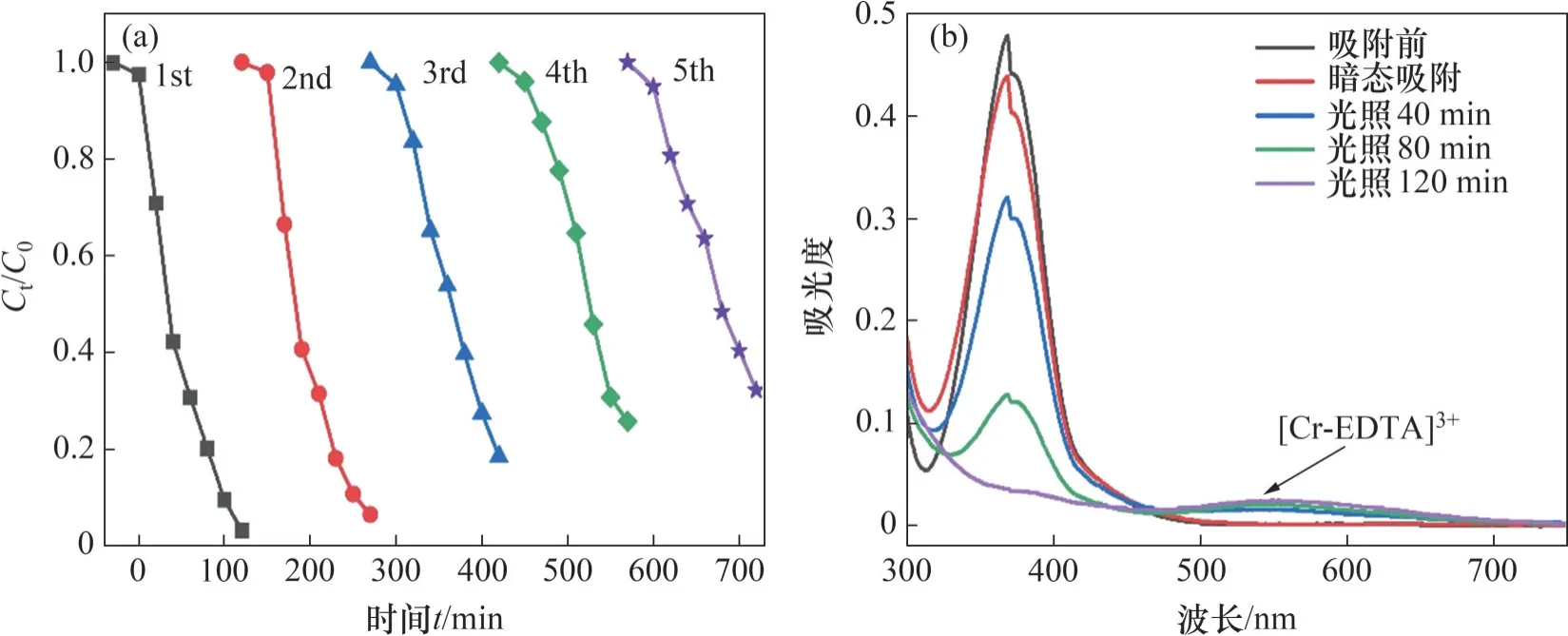
图6 ZnFe2O4光催化剂的循环性能曲线及Cr(Ⅵ)溶液的吸光度曲线Fig. 6 Cyclic performance curve of ZnFe2O4 photocatalyst and absorbance curve of Cr(Ⅵ) solution in reaction process
2.3 ZnFe2O4光催化还原Cr(Ⅵ)的机理分析
ZnFe2O4预处理前后的紫外可见吸收光谱如图7(a)所示。从图7(a)可见:预处理前后,ZnFe2O4样品均在紫外和可见光区域表现出良好的光吸收,预处理后的ZnFe2O4在450~800 nm 范围内具有更高的吸收值。这种优势归功于预处理后ZnFe2O4表面的杂质被除去,ZnFe2O4直接裸露,其块状结构、表面分散的颗粒及边缘网状结构,使得入射光多次散射和折射。半导体光催化剂的吸收系数与禁带宽度之间存在以下关系:
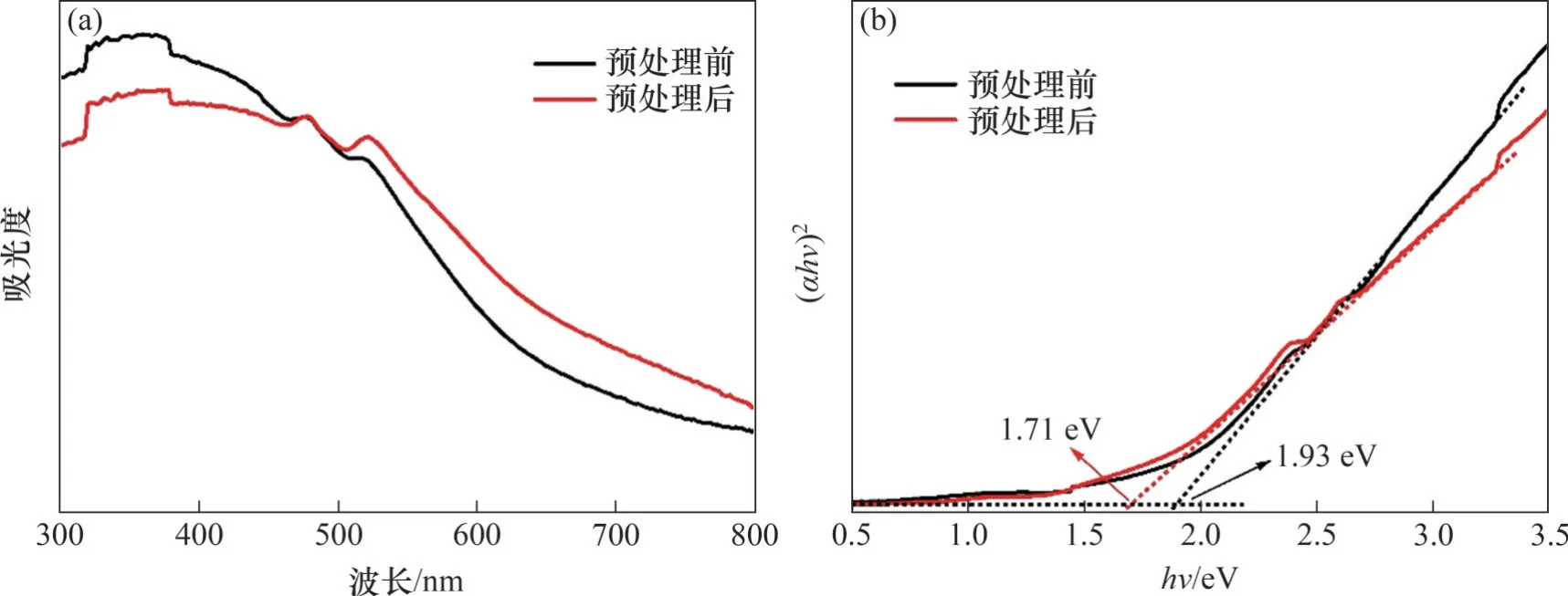
图7 ZnFe2O4预处理前后的紫外可见吸收光谱和Tauc图Fig. 7 UV-vis absorption spectrum and Tauc diagram of ZnFe2O4 before and after pretreatment;
式中,A0为材料的特征常数;α为光吸收系数;hv为光子能量;Eg为材料的禁带宽度;指数n为与材料内能带电子跃迁方式有关的常数。当材料为直接带隙半导体时,n=1/2,当材料为接带隙半导体时,n=2[26-45]。ZnFe2O4为直接带隙半导体,因此,n取1/2。材料的吸收系数α与吸光度成正比,通过式(5)计算Eg时,不论采用吸光度还是α,对Eg并无影响,为简单起见,用吸光度代替α[46]。Tauc图如图7(b)所示,通过将(αhv)2对hv的线性关系外推至(αhv)2=0 取截距,得到直接带隙半导体ZnFe2O4预处理前后的禁带宽度分别为1.93 eV 和1.71 eV。为了确定预处理后ZnFe2O4的导电类型和平带电位Efb,进行了莫特-肖特基测试:
式中:C为半导体材料的微分电容;ε和ε0分别为相对介电常数和真空介电常数;NA为载流子浓度,V为电极电位;Efb为平带电位;kT/e通常可忽略不计[47]。
不同频率下ZnFe2O4的M-S曲线如图8(a)所示。从图8(a)可见:M-S曲线的线性部分为正斜率,说明ZnFe2O4属于n型半导体[48]。将M-S曲线的线性部分外推至横坐标,交点处电位即为ZnFe2O4的平带电位,不同频率下所得平带电位(vs.RHE)均为0.21 V左右。据报道,n型半导体的导带电位通常比平带电位高0.2 V,结合禁带宽度计算可得材料的导带(CB)电位(vs.RHE)为0.01 V,与文献[49]中结果一致。
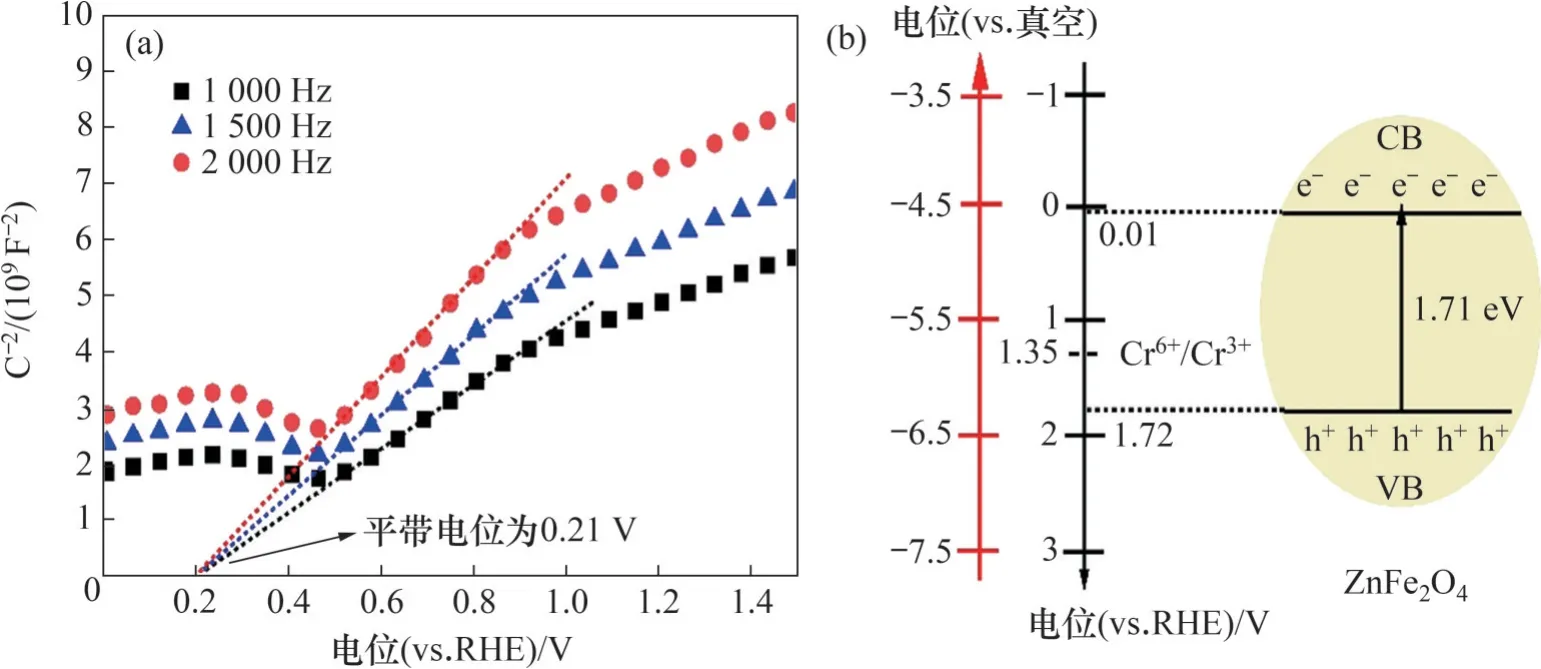
图8 ZnFe2O4不同频率下的M-S曲线和能带结构图Fig. 8 M-S curves of ZnFe2O4 at different frequencies and band structure diagram
作为半导体光催化剂,ZnFe2O4价带(VB)中的电子在可见光照射下激发并跃迁至导带(CB),同时在价带保留相同数目的空穴(h+),如图8(b)所示。据报道,Cr(Ⅵ)/Cr(Ⅲ)的氧化还原电位(vs RHE)为1.35 V,明显高于ZnFe2O4的导带电位[8]。因此,Cr(Ⅵ)能够被ZnFe2O4光催化还原为Cr(Ⅲ)。然而,ZnFe2O4禁带宽度窄(1.71 eV),光生电子和空穴迅速复合,导致单相ZnFe2O4的还原效率低。MEICHTRY 等[50]研究表明,作为一种有机酸和螯合配体,EDTA 容易与金属阳离子(Mg2+、Mn2+、Fe3+等)形成配合物。如图6(b)所示,EDTA 与Cr3+形成配合物[Cr-EDTA]3+,并在540 nm 波长处可观察到吸收峰。
同时,在ZnFe2O4/EDTA/可见光体系下,EDTA可以捕获价带空穴,阻止光生电子和空穴的瞬间复合。导带电子将Cr(Ⅵ)还原为Cr(Ⅲ),部分EDTA 与Cr(Ⅲ)形成配合离子有效抑制了Cr3+在ZnFe2O4表面沉积,进一步促进了Cr(Ⅵ)的还原[51]。ZnFe2O4在EDTA 辅助下光催化还原Cr(Ⅲ)的反应如下:
3 结论
1) 采用酸洗除杂方法制备了ZnFe2O4光催化剂,其禁带宽度为1.71 eV,导带电位(vs RHE)为0.01 V,能够实现对水体中Cr(Ⅵ)的光催化还原。
2) 优化了ZnFe2O4光催化还原Cr(Ⅵ)的过程。在pH=3、EDTA加入量为0.1 mL、固液比为1 g/L、溶液初始质量浓度为20 mg/L 的最优条件下,ZnFe2O4在120 min 内对Cr(Ⅵ)的还原率可达97.95%。
3) ZnFe2O4/EDTA 体系光催化还原Cr(Ⅵ)的机理如下:EDTA 与Cr(Ⅲ)形成的配合离子[Cr-EDTA]3+有效抑制了Cr3+在ZnFe2O4表面的富集,同时,EDTA 可捕获空穴抑制光生电子-空穴的复合促进了Cr(Ⅵ)的光催化还原反应的进行。

