常见肉制品动物源性的环介导等温扩增高分辨熔解鉴别检测方法
代欣,张月绒,澹台玮,李艳妮,徐秦峰
(陕西科技大学 食品科学与工程学院,陕西 西安,710021)
随着国家综合实力的增强,国民对于食品的需求已经从最开始的满足基本温饱,转变为选择更加营养、美味的食物。近年来,食品安全问题频发引起消费者对肉制品感官和营养品质的重视。混淆肉类成分已成为动物源性食品质量和安全的重大挑战,不法分子用较廉价的猪、鸭、鸡肉冒充高价的牛羊肉。为保护消费者的权益,建立一种高效、准确的肉类掺假检测方法显得尤为重要,不仅可以在进出口肉制品检测、市场的定期抽查发挥作用,还可以为中小型肉制品企业生产提供强有力的支持。
针对食品的真实性评估,较为传统的是检测人员依据经验从形态上、感官特征上对肉制品进行分析,结果容易受加工过程的影响,局限性较大[1]。现代分析方法是以核酸、蛋白质、脂肪等作为目标物进行定性定量分析。基于蛋白质的免疫分析方法[2]主要用于生肉样品,因蛋白质在加工过程中稳定性差而受到限制。色谱、质谱[3]等大型仪器能够提供准确的检测结果,但由于仪器价格昂贵、检测耗时长、样品前处理复杂和数据分析复杂的特点,这些检测方法主要用于实验室精密痕量检测而不适用于现场快速分析。
核酸扩增方法现已十分成熟,这类方法特异性强、灵敏度高,通常使用凝胶电泳、比色法等判断实验结果。主要有传统聚合酶链式反应(polymerase chain reaction, PCR)技术[4]、环介导等温扩增(loop-mediated isothermal amplification, LAMP)法[5-6]、重组聚合酶扩增反应[7-8](recombinase polymerase amplification, RPA)等等。LAMP技术的发展与应用能够实现对低浓度DNA进行扩增,并实时检测出其含量,摆脱PCR技术对温控设备的依赖,使得LAMP技术为检测DNA提供一种可行且经济的途径,适用于现场检测和基层应用[9-10]。
但以上方法只针对一种动物源性成分进行检测[11-13],难以满足实际应用中同时检测多种肉类成分的需求。通过对LAMP技术的改进或与其他技术结合可以实现多重LAMP扩增技术检测,充分利用LAMP技术的优势,扩展其应用场景。多重检测的常用方法之一是通过在探针上标记不同颜色的荧光标记,通过比色来得到实验结果[14],缺点是荧光标记探针价格昂贵,引物间存在相互干扰、扩增效率存在差异且结果解析复杂。除此之外还可以通过空间分隔的方式实现多重同时检测,例如ZHANG等[15]将LAMP技术与微流控芯片结合,实现对猪、牛、羊及鸭子的掺假肉制品进行检测,检测限可达到0.1%(质量分数),这样的方法不受不同物种引物之间相互干扰影响,但需要具备专业的芯片设计制作技术。高分辨熔解曲线(high-resolution melting, HRM)是一种在扩增反应完成后监测扩增子熔解行为的分析方法,常被应用在基因分型、突变扫描和甲基化检测领域可以区分目标基因序列的微小差异,具有灵敏、快速、高通量的优点[16]。HRM方法无需开管即可对DNA序列信息进行分析,核酸扩增中的气溶胶污染的问题得以克服。已有文章设计通用型PCR引物扩增与HRM结合,实现对山羊、绵羊、水牛和牛4个物种的鉴别检测[17]。本实验室前期采用了牛羊特异性LAMP引物对牛羊乳掺假进行区分[18],但是2种靶标需要8条特异性引物,进一步增加至3种靶标将需要12条引物,这些引物间相互干扰、扩增效率存在差异,因此限制了靶标数量的增加[19]。为了克服这种局限,本方法仅采用一对通用引物,对猪、牛、羊3个物种线粒体DNA进行LAMP扩增,避免引物过多对反应造成干扰以及扩增效率不同的问题,通过分析HRM熔解曲线实现牛、羊肉制品中掺入猪肉成分的检测。
1 材料与方法
1.1 材料与试剂
动物DNA(猪、牛、羊)标准样本,四川华汉三创有限公司;牛肉卷、羊肉卷、猪肉等实际样品,陕西科技大学附近某大型商场。
甜菜碱,Sigma公司;dNTP混合液、Bst 2.0 Warm Star DNA聚合酶和MgSO4等,NEB公司;EvaGreen,Biotium公司;磁珠法血液基因组DNA提取试剂盒、2×Taq PCR Master Mix、DNA marker,天根生化科技有限公司。
1.2 仪器与设备
MyGo Pro 荧光定量PCR仪,IT-IS Life Science Ltd;电热恒温水槽(DK-8D),上海精宏实验设备有限公司;高速冷冻离心机(5424R),Eppendorf有限公司;超微量紫外分光光度计(NanoDrop 2000),Thermo Scientific。
1.3 实验方法
1.3.1 LAMP方法建立
1.3.1.1 DNA的提取
使用磁珠法血液基因组DNA提取试剂盒,可以从大型商超随机购买的牛肉卷、羊肉卷以及猪肉中提取到相应的基因组DNA。通过超微量紫外分光光度计对样品DNA浓度进行精确检测后,将DNA溶液稀释到20 ng/μL,-20 ℃贮存以备后续使用。
1.3.1.2 LAMP引物设计及筛选
本研究中,根据GB/T 21104—2007《动物源性饲料中反刍动物源性成分(牛,羊,鹿)定性检测方法PCR方法》设计一种LAMP通用型引物,如表1所示。生工生物(上海)有限公司成功合成并通过高效液相色谱技术纯化。
参考文献[20]报道的引物序列并稍做修改,以牛、羊线粒体保守序列为靶基因,并在PrimerExplorer V5网站进行多次筛选比对来设计PCR特异性引物,如表2所示。PCR引物由生工生物(上海)有限公司合成并经高效液相色谱纯化。

表1 实验中所用的LAMP通用引物序列Table 1 The sequence of the primers used in LAMP
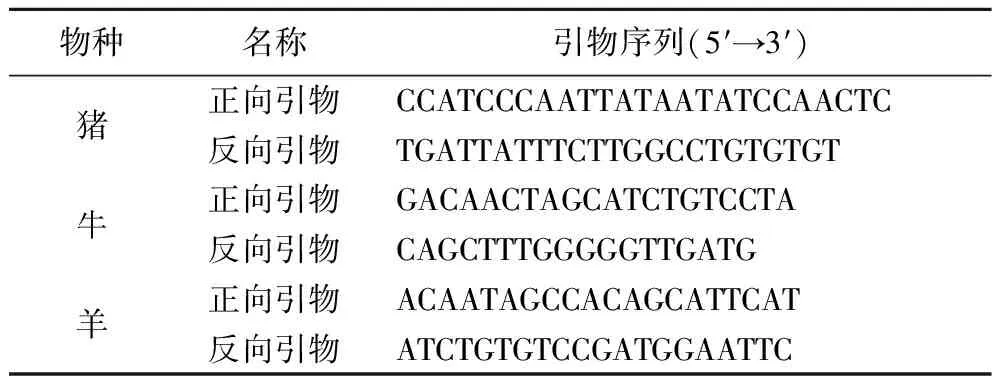
表2 实验中所用的PCR引物序列Table 2 The sequence of the primers used in PCR
1.3.1.3 LAMP-HRM 反应体系建立及条件优化
LAMP反应体系的组成及浓度如下:1×ThermolPol 缓冲液、1.4 mmol/L dNTPs、0.8 mol/L甜菜碱、4 mmol/L MgSO4、外引物F3和B3各0.4 μmol/L、内引物FIP和BIP各1.6 μmol/L、8 U Bst 2.0 Warm Star DNA聚合酶0.4 μL、20×EvaGreen荧光染料0.25 μL和DNA模板20 ng,总反应体系为10 μL。在64 ℃下,将混合体系放入MyGo pro中反应60 min,结束后在60~97 ℃完成熔解分析。通过琼脂糖凝胶电泳技术对扩增产物进行准确表征。
1.3.2 LAMP体系灵敏度测定
通过10倍梯度稀释,将猪、牛、羊的DNA提取液分别稀释至30、0.3、0.03、0.003、0.000 3 ng/μL,并以每个梯度的稀释液为基准,建立标准曲线,进行LAMP反应检测,以评估单个物种DNA检测的灵敏度的。
1.3.3 混合动物物种的检测
通过LAMP-HRM实验,研究了3种不同物种的DNA,分别是单组分3种、双组分3种和三组分1种,以及7种混合物,以评估这种检测方法的分类效果。
为了更好地分析这种方法的检测限,选择了30 ng/μL的牛DNA作为原液,并分别掺入了不同体积比例的猪DNA。这些混合物的体积比例分别为100%、80%、50%、10%、5%和0%。最后,选择了1.2 μL 的混合物作为模板进行了LAMP扩增。通过将羊DNA与猪DNA按照100%、80%、50%、10%、5%和0%的比例混合,以确定该混合方法的最佳检测范围。
1.3.4 实际样品的检测
对市售的5种肉制品进行鉴定,分析LAMP-HRM方法的实际应用能力,与已有的实时PCR方法进行对比,验证LAMP-HRM方法的准确性。
2 结果与分析
2.1 通用引物的设计
使用BioEdit软件,可以比较6个物种的完整扩增序列,其中以牛的扩增序列为基准,以此来确定它们的特征。由图1可以看出,黑框内的碱基序列属于通用型外引物,而红框内的碱基序列属于通用型内引物,而6个物种之间与引物互补的碱基序列完全一致,用圆点标记出来。通过对6种物种的碱基序列进行比较,可以发现它们之间存在一定的差异,其中牛和羊的差异为9.12%,而猪和牛的差异最大,达到 11.22%。经过测定,6种物种的碱基序列差异为9.19%。本方法对猪、牛、羊进行扩增,理论上以下6种以及其他序列匹配的物种均可以通过此方法进行区分。

图1 通用引物对应的6个物种的核苷酸序列差异对比Fig.1 Sequence alignment of nine species corresponding to universal primers注:*表示一致。
2.2 LAMP-HRM方法可行性验证
为了验证方法的可行性,本实验采用通用引物,以猪、牛及羊DNA为模板进行LAMP检测。由图2-a所示,只有在模板存在的情况下,才可观察到明显的扩增曲线。扩增产物进行琼脂糖凝胶电泳后,观察发现电泳结果与扩增结果基本一致。而且由于靶标序列的长度和目标片段的GC比例与Tm值(melting temperature,Tm)相关。因此,图2-b进一步对不同靶标DNA的LAMP产物实行高分辨熔解曲线分析,猪、牛、羊这3个物种的峰有重叠,并不能很好地区分开来。但图2-c归一化熔解曲线中的猪、牛、羊DNA熔解曲线没有出现交叉重叠,可明确对其进行区分和鉴定。WITTWER等[21]的研究文章中,对15种不同样本对应的差异化曲线进行分析,差异化曲线的区分效果更好,区分能力优于归一化熔解曲线,图2-d结果与文献报道一致。因此,采用LAMP-HRM方法对猪、牛、羊源性成分进行区分是可行的。
2.3 LAMP灵敏度测定
为了明确该方法的灵敏度,将其更好地应用于猪、牛、羊动物源性成分的测定。本实验将依照10倍梯度稀释3个物种的DNA模板。最后,分别进行LAMP反应。图3结果表明,建立的LAMP-HRM方法能够检测到0.3 pg/μL、0.03 pg/μL、0.3 pg/μL的猪、牛、羊DNA。其他LAMP方法难以检测DNA质量浓度在1 pg/μL以下的样品[22],此方法将检测灵敏度从10 pg/μL提高到0.3 pg/μL,具有较高的灵敏度。
2.4 混合物种的检测
采用通用引物扩增单组分(猪、牛、羊)、二元混合物(猪+牛、猪+羊、牛+羊)、三元混合物(猪+牛+羊),并对以上7种样本进行高分辨熔解。在二维主成分分析图4-a中,每个样品的3个平行被划为一个聚类,混合物种样品的聚类处于2个纯品的聚类之间,证明该方法可以对7种目标物进行鉴别,适合多元混合物的掺假检测。
将牛和羊物种分别和猪物种的DNA按照不同比例混合,进行LAMP-HRM检测。检测结果如图4-b所示。当牛DNA中掺入5%猪DNA时,通过差异化曲线仍可观察到明显的区分效果。图4-c结果表明,对于羊DNA中掺入猪DNA,通过差异化曲线分析,可以达到1%的检出限。通过差异化曲线仍可观察到明显的区分效果。根据文献报道[22],通过掺假5%外源物即可牟取经济利益,因此本实验证明基于LAMP-HRM的方法可以实现对牛肉和羊肉中分别掺入猪肉DNA的相对定量,且能够达到5%的最低检测标准。
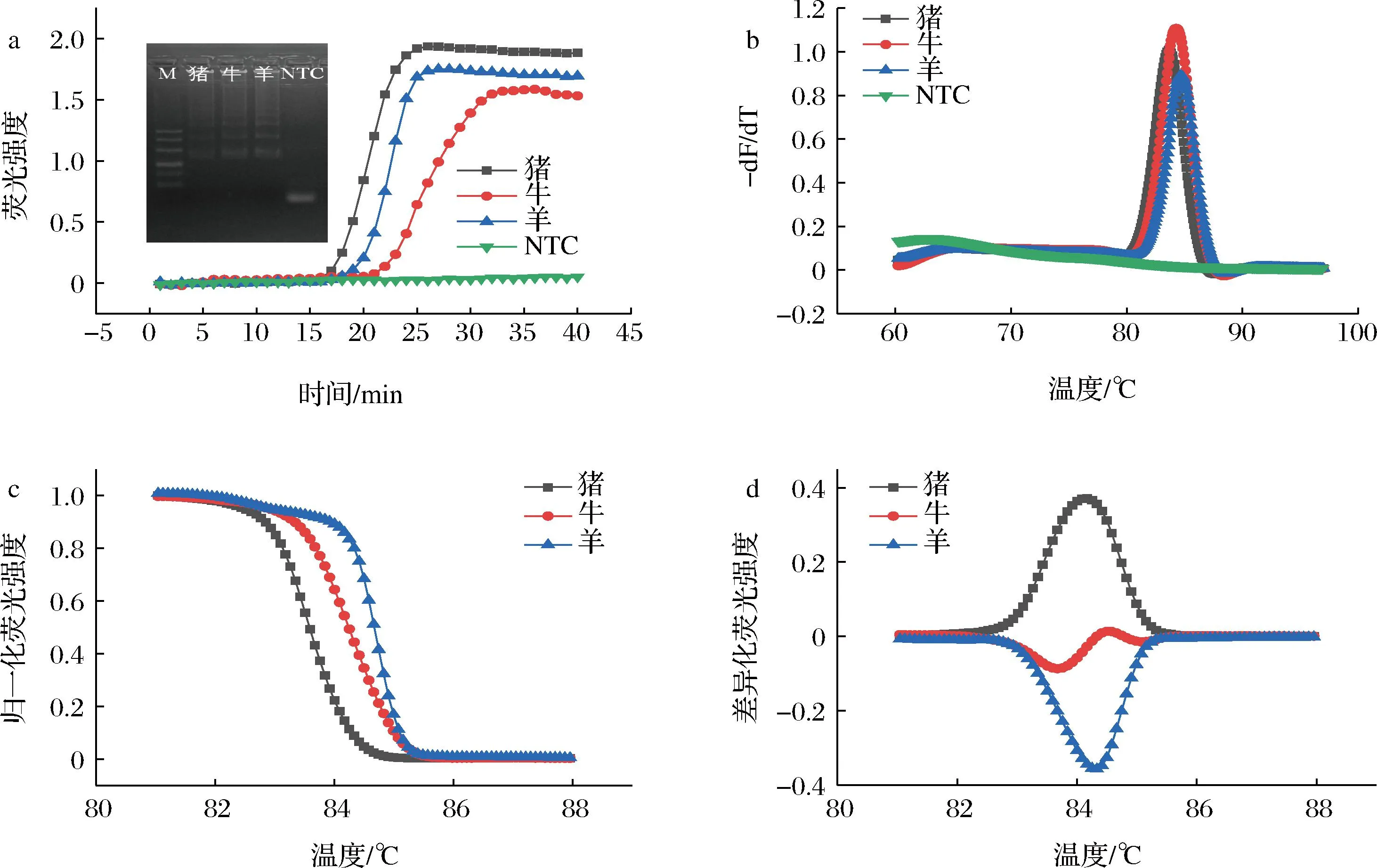
a-实时扩增曲线;b-熔解曲线;c-归一化熔解曲线;d-差异化熔解曲线图2 基于通用引物的LAMP-HRM方法的可行性验证Fig.2 Verification of LAMP-HRM feasibility
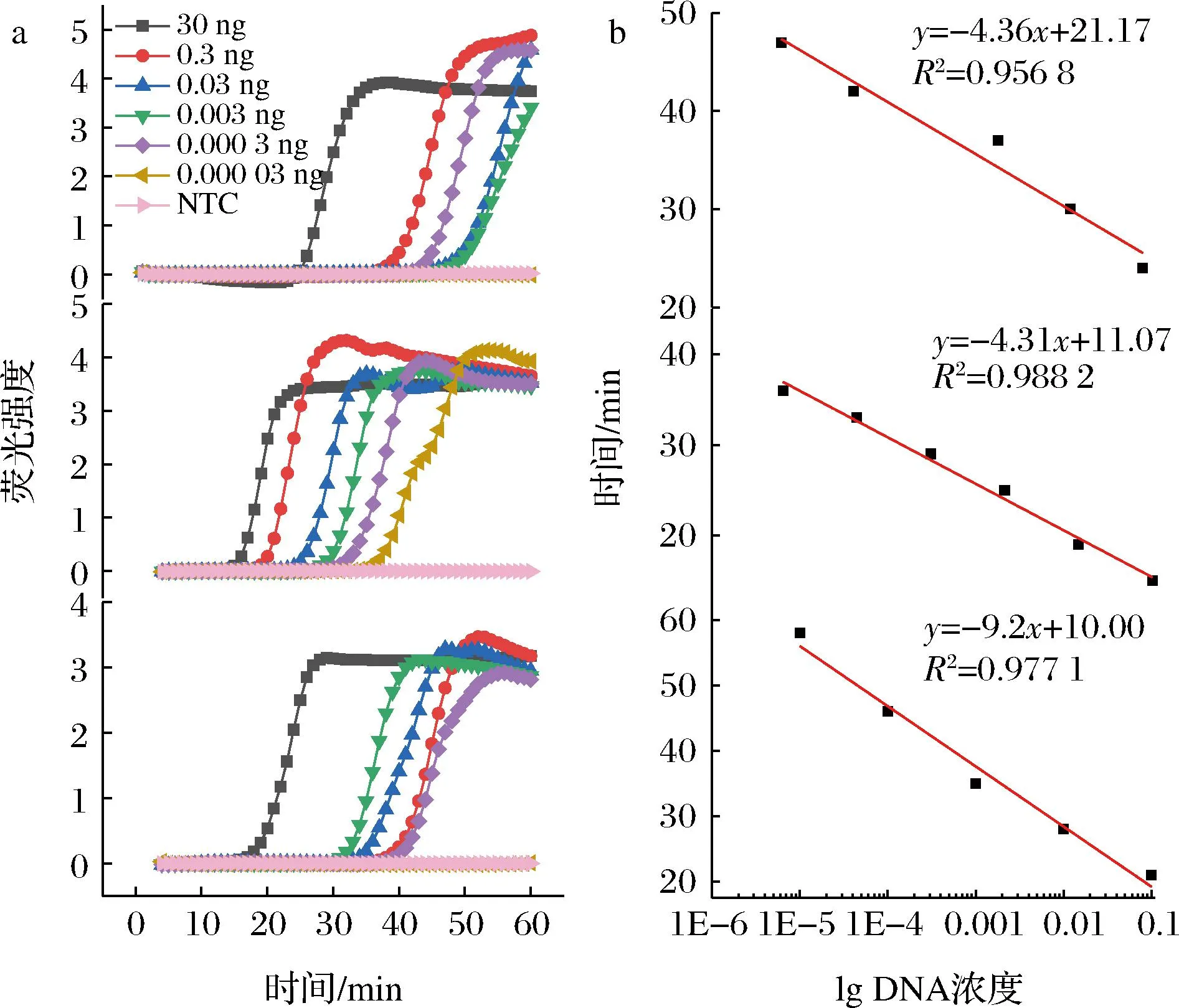
a -扩增曲线;b-灵敏度检测标准曲线;图3 猪、牛、羊源性成分的LAMP-HRM灵敏度检测Fig.3 Sensitivity detection of pig, cattle, and sheep derived ingredients by LAMP-HRM注:从上到下依次为猪源性成分、牛源性成分、羊源性成分。
2.5 实际样品检测
为了进一步验证LAMP-HRM方法对实际样品的适用性,本实验选择购买市售的新鲜牛肉卷、羊肉卷这两种实际样品,采用所设计好的通用性引物对这些样品的猪、牛、羊源性成分进行LAMP扩增后采用高分辨熔解。如图5-a所示,牛肉卷和羊肉卷样品采用通用引物均有明显的扩增曲线,通过图5-b差异化曲线可以观察到羊肉卷和牛肉卷样品与猪、牛、羊标品具有明显的区分。羊肉卷和牛肉卷均检测出掺入猪源性成分,与标签标识不符(表3),同时利用实时荧光PCR方法进行对比验证,其结果与LAMP-HRM一致,证明LAMP高分辨熔解鉴别检测方法在实际样品检测中的适用性良好,且检测结果可靠。

a-二维PCA分析图;b-牛物种中掺入不同比例猪物种的差异化熔解曲线;c-羊物种中掺入不同比例猪物种的差异化熔解曲线图4 LAMP-HRM混合物种的检测Fig.4 Detection of LAMP-HRM mixed different derived ingredients
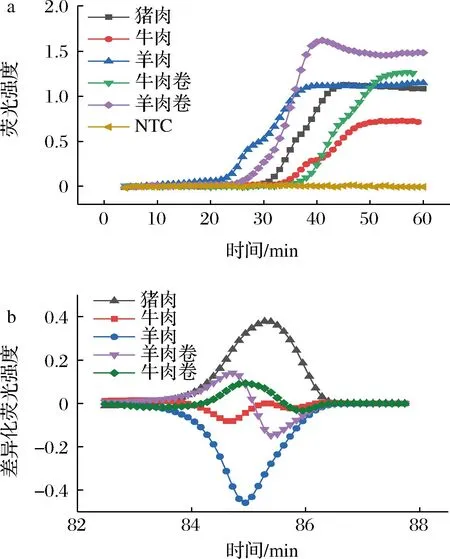
a-实际样品扩增曲线;b-实际样品差异化曲线图5 实际样品检测Fig.5 Detection of commercial products

表3 市售样品检测成分标签判断表Table 3 Judgment table of composition labels of commercially available samples
3 结论
本研究通过对猪、牛、羊3个常见动物源性肉制品进行LAMP-HRM测定,通过设计一组通用性引物对目标物种的线粒体DNA进行LAMP扩增,结合高分辨熔解曲线分析技术,对样品的主成分进行分析,建立了一种可以检测判定这3种动物源性成分的方法。本研究设计使用的通用性引物不仅减少同时加入多对特异性引物影响扩增反应的可能,而且能减少实验人员的工作量,操作过程更加方便快捷,提高工作效率。同时在理论上该通用引物可扩增的物种不止实验中进行区分的3种,也可用于区分其他序列满足条件的物种。该方法满足定量要求,具有基本的定量能力,可实现牛肉、猪肉中分别掺入5%和1%猪肉的鉴别。使用此研究体系对牛肉卷、羊肉卷这2种市售样品进行测定,通过实验数据分析发现此方法在定性上具有一定的准确性,具有一定的实际应用价值。
相对于现有的基于特异性引物LAMP扩增的方法,该方法具有简便快捷、灵敏、高效以及高通量污染小的优点,能够有效提高检测的效率,扩展检测的范围,且具备基本定量能力,在肉及肉制品动物源性成分检验的快速检测中具有良好的发展前景。

