红细胞体积分布宽度与淋巴细胞绝对值比值在结外NK/T细胞淋巴瘤患者中的预后价值
徐添姿,李 怡,刘艺欣,毛明玉,宁 彪,魏永长
武汉大学中南医院胃肠肿瘤放化疗科(武汉 430071)
结外NK/T 细胞淋巴瘤(extranodal NK/T-cell lymphoma,ENKTL)是一种较为罕见的非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)亚型,在亚洲和南美洲相对多见,ENKTL 发病率占上述地区全部NHL 的10%以上[1]。ENKTL 常侵犯鼻咽部[2],与EB 病毒(Epstein-Barr virus,EBV)感染密切相关[3-4]。约70%~90%ENKTL 患者的肿瘤分期为I 或II 期,5 年生存率约为70%[5]。目前尚无治疗ENKTL 的标准化疗方案,尽管基于天冬酰胺酶类药物化疗联合放疗的策略已较大改善了患者的预后,但仍有部分复发或难治性ENKTL 患者无法从中获益[6]。目前,常见的ENKTL 预后模型,如国际预后评分(international prognostic index,IPI)、韩国预后指数(Korean prognostic index,KPI)、NK/T 细胞淋巴瘤预后指数(prognostic model of natural killer lymphoma,PINK)、列线图修订风险指数(nomogram-revision risk index,NRI)等均未整合分子生物标志物,其风险识别能力存在缺陷。基因表达谱也逐渐被证实对预测ENKTL 预后有着重要价值[7-8],但因其昂贵、耗时和费力的缺点,难以在临床推广。因此,急需开发廉价、可靠的预后生物标志物以优化预后模型,为临床决策提供信息。
既往研究证实全身炎症在癌症的发生和进展中发挥重要作用[9]。全身炎症的外周血指标,如红细胞体积分布宽度(red cell volume distribution width,RDW)[10-13]、淋巴细胞绝对值(absolute lymphocyte count,ALC)[14-15]和中性粒细胞-淋巴细胞计数比值[16](neutrophil-lymphocyte ratio,NLR)等也被证实与多种癌症的预后密切相关。新型生物标志物 RDW 与ALC 比值(red cell volume distribution width to absolute lymphocyte count ratio,RLR)近年来也显示出了在恶性肿瘤预后预测上的潜在价值[12,17-18]。但迄今为止,有关RLR 在ENKTL 预后方面的研究较少。本研究旨在评价RLR 与ENKTL 患者预后的关系,探讨其作为ENKTL 患者风险分层工具的临床可行性。
1 资料与方法
1.1 研究对象
回顾性收集2013 年4 月至2022 年5 月在武汉大学中南医院诊断为ENKTL 患者的临床资料。本研究已获得武汉大学中南医院医学伦理委员会审核批准(批件号:临研伦[2023144K]),符合《赫尔辛基宣言》。
纳入标准:①根据《WHO 造血和淋巴组织肿瘤的分类(第5 版)》,经病理诊断为ENKTL;②既往无恶性肿瘤病史或第二原发恶性肿瘤;③既往无抗肿瘤治疗史;④完整的随访资料和临床资料;⑤无活动性全身感染或慢性炎症疾病。排除标准:①随访时间不足1 个月或院内死亡者;②HIV 病毒感染。
1.2 资料收集
本研究通过回顾性查阅电子病例数据库,收集基线数据如下:年龄、性别、乳酸脱氢酶水平、美国东部肿瘤协作组活动状态(Eastern Cooperative Oncology Group Performance Status,ECOG PS)评分、Ann Arbor 分期、骨髓受累、B症状(具备以下之一或多条:不明原因发热大于38 ℃,持续3 d 以上;不明原因盗汗;体重于诊断前6 个月内下降>10%)、区域淋巴结(regional lymph node,RLN)侵犯情况、远处淋巴结(distant lymph node,DLN)侵犯情况、EBV 感染情况、RDW 水平、ALC 等。RLR 由RDW 值除以ALC值获得。RLR、RDW 以其中位数作为截断值。采用既往ENKTL 研究提出并验证的ALC 临界值(1.0 × 109/L)[19-20]作为本研究ALC 的截断值。采用定量PCR 法检测血浆中的EBV-DNA 水平,并将高于500 拷贝/mL视为EBV-DNA阳性。此外,基于表1 相关模型和其风险的评分定义,计算患者IPI 评分、KPI 评分、PINK 评分及NRI 评分。
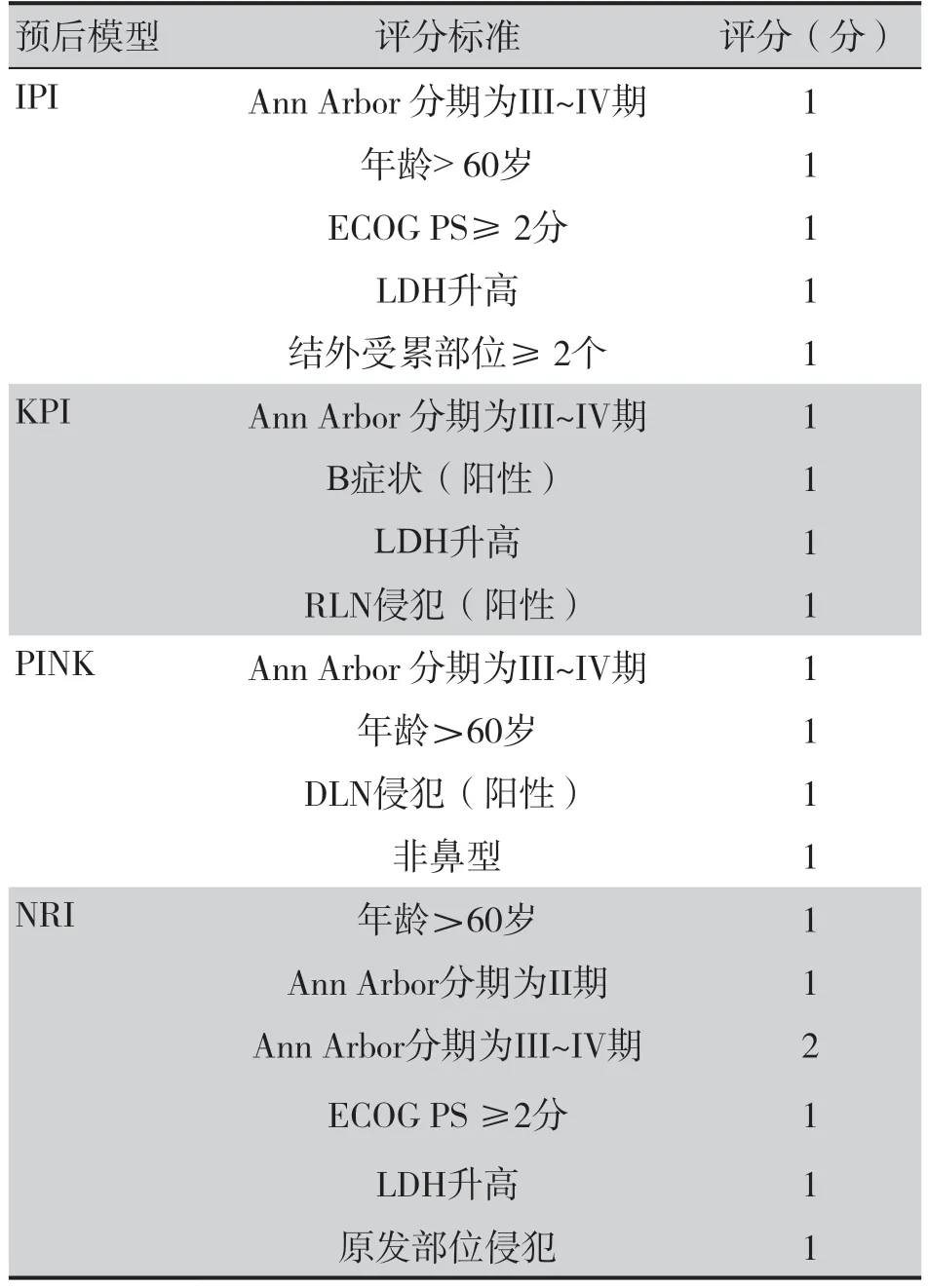
表1 不同预后模型中的变量定义及其评分Table 1. The variables definitions and the scores of different models
回顾性收集患者治疗方案,包括单纯化疗、单纯放疗、化疗+放疗三类。化疗方案包括天冬酰胺酶和非天冬酰胺酶两类方案,其中,天冬酰胺酶方案包括DDGP 方案(吉西他滨+培门冬酶+地塞米松+顺铂)、P-Gemox 方案(培门冬酶+吉西他滨+奥沙利铂)、天冬酰胺酶联合其他非蒽环类药物方案;非天冬酰胺酶方案包括CHOP(环磷酰胺+阿霉素+长春新碱+强的松)或CHOP 样方案。放疗方案中放疗剂量均未超过56 Gy,剂量范围为34 ~ 56 Gy。
1.3 随访与结局指标
随访从初次诊断后开始,第1 年每3 个月随访1 次,第2~3 年每6 个月随访1 次,此后每年随访1 次,末次随访时间为2022 年10 月,本研究纳入患者均已完成末次随访。结局指标包括3年无进展生存(progression-free survival,PFS)率和总体生存(overall survival,OS)率,其中PFS 定义为从首次确诊到复发、进展、任何原因的死亡或最后一次随访,OS 定义为从首次确诊到死亡或最后一次随访日期的时间间隔。
1.4 统计学分析
采用SPSS 26.0 和R 4.0.5 软件进行统计学分析。分类变量比较采用卡方检验或Fisher 精确检验,采用Kaplan-Meier 法生成生存曲线,logrank 检验评价组间差异。基于最大似然估计的向前逐步回归法,采用Cox 比例风险回归模型进行影响预后的危险因素分析。鉴于本研究样本量较少,且RLR 与ALC、RDW 存在共线关系,若将这些指标均纳入多因素回归,可能导致预测结果不稳定、不可靠,因此本研究对ALC、RDW 以及RLR 分别构建多因素模型。此外,采用分层分析评估RLR、ALC、RDW 在不同治疗方案患者中的预后价值。统计学检验均为双侧检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 患者一般资料及分组情况
本研究共纳入72 例ENKTL 患者,其RLR 值范围为8.1~16.2,中位数为10.2;RDW 值范围为11.8~23.7,中位数为13.6。基于RLR、RDW 中位数将患者分为高RLR 组(RLR ≥10.2,n=36)和低RLR 组(RLR <10.2,n=36),高RDW 组(RDW ≥13.6,n=37)和低RWD 组(RDW <13.6,n=35)。基于已被验证的ALC 临界值(1.0 × 109/L)将患者分为高ALC 组(ALC ≥1.0×109/L,n=48)和低ALC 组(ALC <1.0×109/L,n=24)。
本研究中,男性56 例(77.8%),女性16例(22.2%)。患者确诊时的中位年龄为51 岁,72.2%的患者年龄在60 岁及以下,34.7%的患者在确诊时或之前出现B 症状,52 例(72.2%)患者分期为I~II 期,仅10 例患者初诊时未出现鼻腔受累。49 例(68.1%)患者在初诊时进行了EBV-DNA 检测,其中34 例(69.4%)表现为阳性。IPI、KPI、PINK、NRI 评分为0~1 分的患者分别为49 例(68.1%)、38 例(52.8%)、56 例(77.8%)、27 例(37.5%)。45 例(62.5%)患者进行了化疗+放疗,22 例(30.6%)患者进行了单纯化疗,5 例(6.9%)患者进行了单纯放疗。化疗患者中1 例患者接受了DDGP 方案、33 例接受了P-Gemox 方案、3 例接受了天冬酰胺酶联合其他非蒽环类药物方案、28 例接受了CHOP 或CHOP 样方案(表2)。
2.2 不同RLR水平患者临床特征比较
不同RLR 水平患者年龄、ECOG PS 评分、IPI 评分、NRI 评分、乳酸脱氢酶(LDH)水平和B 症状差异具有统计学意义(P<0.05),见表2。
2.3 ENKTL患者的生存分析
本研究中位随访时间为43 个月,随访期内41 例(56.9%)患者出现疾病进展或复发,25 例(34.7%)患者死亡,患者3 年PFS 率和OS 率分别为40.2% 和59.7%( 图1-A、 图1-B)。Kaplan-Meier 生存曲线显示,低RLR 组患者3年PFS 率(50.6% vs. 28.8%,P= 0.032)和3 年OS 率(79.2% vs. 40.8%,P= 0.001)显著高于高RLR 组的患者(图1-C、图1-D)。

图1 ENKTL患者的Kaplan-Meier生存曲线Figure 1. Kaplan-Meier curve for ENKTL patients
2.4 ENKTL患者的预后影响因素分析
单因素Cox 风险比例模型分析显示,RLR ≥10.2[HR=4.120,95%CI(1.643,10.333),P=0.003]、ALC < 1.0×109/L[HR=3.793,9 5%C I(1.7 1 2,8.4 0 3),P=0.0 0 1]、RDW ≥13.6[HR=2.874,95%CI(1.199,6.886),P= 0.018] 均与ENKTL 患者OS 的预后不良相关(表3)。在对RDW、ALC 以及RLR 的多因素分析中,分别调整了单因素分析中与OS 相关的预后指标后,结果仍显示ALC <1.0×109/L[HR=2.766,95%CI(1.140,6.710),P= 0.024]和RLR ≥10.2[HR=4.318,95%CI(1.711,10.898,P= 0.002] 与患者OS 的预后不良相关(表3)。
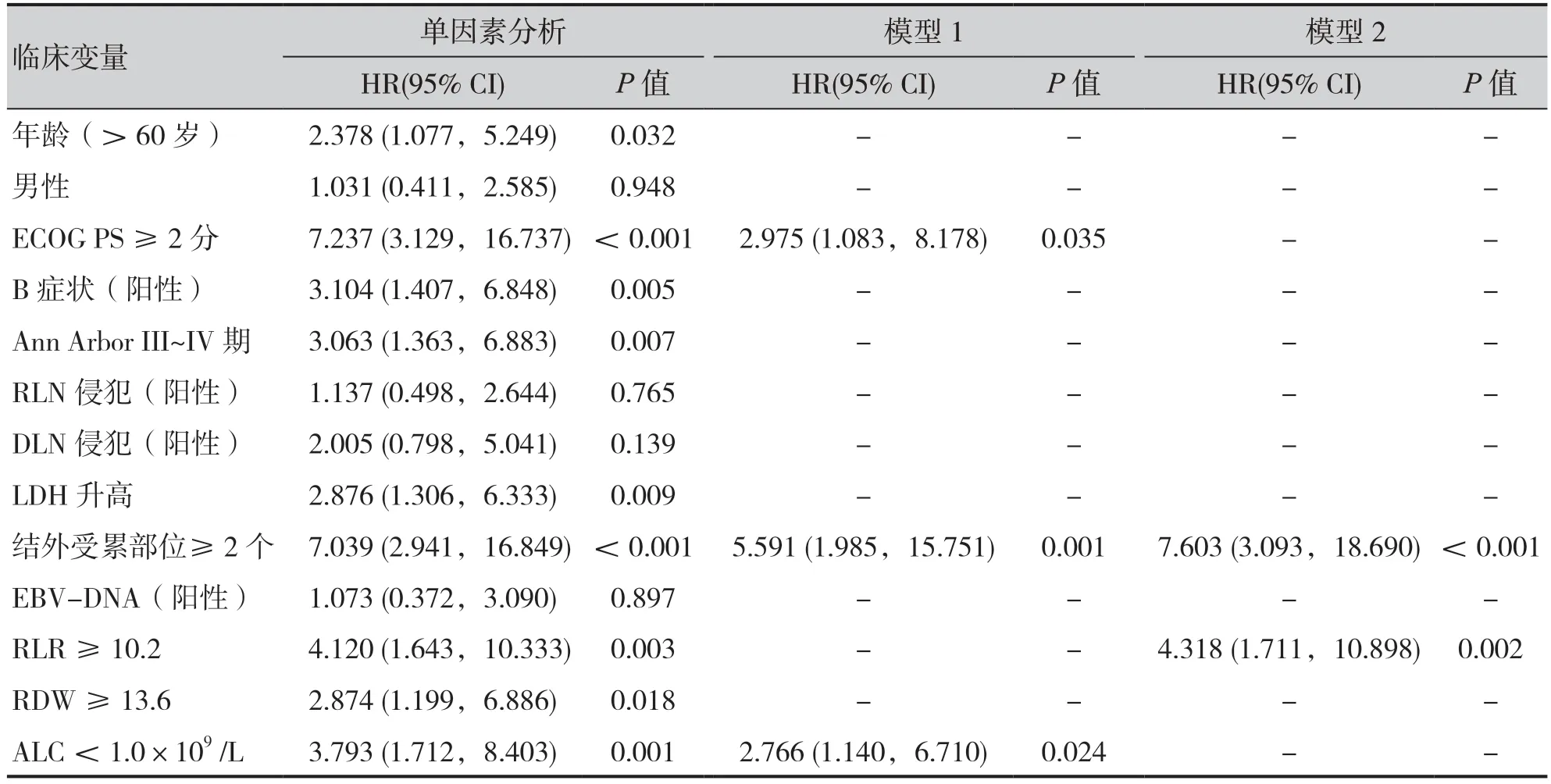
表3 ENKTL患者OS影响因素分析Table 3. Analysis of factors associated with OS in ENKTL patients
2.5 不同治疗方案ENKTL患者预后的影响因素分析
在67 例化疗患者中,调整化疗方案(是否包含天冬酰胺酶)以及其他预后相关因素,分别对RDW、ALC 以及RLR 进行多因素分析。结果表明,与未调整化疗方案的结果类似,即 ALC<1.0×109/L [HR=3.146,95%CI(1.249,7.924),P= 0.015] 和RLR ≥10.2[HR=3.228,95%CI(1.077,9.680),P= 0.036] 仍与化疗患者的OS 显著相关,而RDW 未展现出其统计学意义(表4)。此外,由于放疗是早期ENKTL 患者不可或缺的根治性治疗,也是影响预后的强干扰因素,因此本研究在Ann Arbor 分期I~II 期患者的生存分析中调整了放疗因素的影响,多因素结果显示ALC <10×109/L [HR=3.970,95%CI(1.173,13.436),P= 0.027]、ECOG PS ≥2 分[HR=4.261,95%CI(1.219,14.900),P=0.023]是早期患者OS 的独立危险因素,而RLR 与RDW 则未展现出明确的预后价值(表5)。

表5 Ann Arbor I~II期 ENKTL患者的生存分析Table 5. Survival analysis of ENKTL patients with Ann Arbor stage I~II
2.6 RLR的风险分层价值
将RLR ≥10.2 作为高风险组,分配为1分,分别添加到IPI、KPI、PINK 和NRI模型评分中,以生成新的预后改良模型(mIPI,mKPI,mPINK,mNRI)。ROC 曲线显示整合RLR 后的改良模型(mIPI,mKPI,mPINK,mNRI)比相应原始模型的3 年AUC 值(0.750 vs. 0.770;0.710 vs. 0.735;0.670 vs. 0.693;0.765 vs. 0.767)及5 年AUC 值(0.726 vs. 0.778;0.628 vs. 0.697;0.700 vs. 0.754;0.738 vs. 0.753)均略有升高,这与时间依赖性AUC 曲线的结果表现一致(图2)。因此,推测RLR 可能具有风险分层的能力,能进一步提高原有预后模型的预测价值和临床意义。
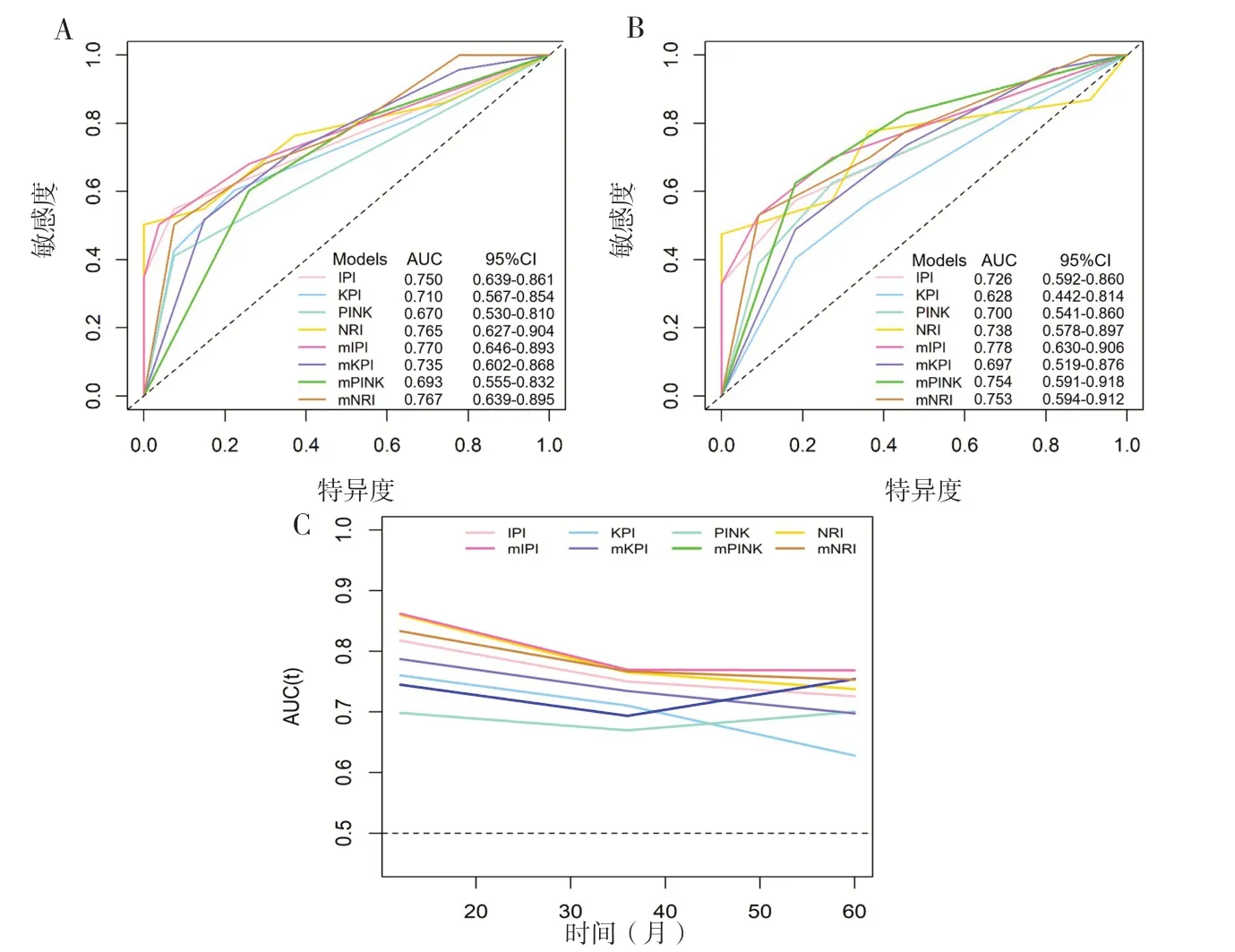
图2 整合RLR前后的预测模型的受试者工作特征(ROC)曲线和时间依赖性AUC曲线Figure 2. The receiver operating characteristic (ROC) curve and time-dependent AUC curve of the predictive model were integrated before and after the RLR
在IPI、KPI 和PINK 模型中,分别有68.1%、52.8%和77.8%的患者被分配为低风险组(评分为0~1),生存曲线提示这些模型未能进一步区分低风险患者的生存差异(P>0.005),详见图3。为了进一步评估RLR 对IPI、KPI 和PINK 评分定义的高、低风险亚组的风险鉴别能力,基于这三种模型进行分层分析。Kaplan-Meier 生存分析表明,RLR 能够进一步区分KPI 模型低风险组患者的生存差异,RLR<10.2 和RLR ≥10.2 组患者的5 年总体生存率分别为86.4%和56.3% (P= 0.026)。同样,在PINK 模型中,RLR 也显示出显著的风险识别能力(P= 0.020)。此外,尽管无统计学上的意义,仍在IPI 低危组的分层分析中观察到RLR 能部分识别生存差异(图4)。

图3 低风险ENKTL患者分层分析的生存曲线(原模型)Figure 3. Survival curves of the stratified analysis of low-risk ENTKL patients (original model)

图4 低风险ENKTL患者分层分析的生存曲线(增加RLR的模型)Figure 4. Survival curves of the stratified analysis of low-risk ENKTL patients (model that add RLR)
3 讨论
本文旨在探讨RLR 在ENKTL 患者中的临床价值,研究结果表明RLR 升高与ENKTL 患者的不良预后密切相关,整合RLR 可提高IPI、KPI、PINK 和NRI 模型的预后预测能力。此外,RLR还可以进一步识别无法通过预后模型区分的患者的生存差异。总之,本研究提示,RLR 可能是ENKTL 患者预后的评估指标,并有助于风险分层。
有研究发现RDW 升高与全身炎症反应增加和营养状况受损密切相关[2,21],提示其异常升高可能是癌症预后不良的潜在预测因子[13,22]。在一项纳入191 例患者的研究中,高RDW 患者表现为更短的OS 和PFS,且RDW 被证实是ENKTL 患者的独立预后因素[13]。淋巴细胞浸润作为免疫监测的关键媒介,是抗肿瘤免疫反应发生的前提[23-24]。CD8+和CD4+ T 淋巴细胞通过诱导肿瘤细胞凋亡在免疫系统抗肿瘤反应中发挥重要作用[23,25-26]。与之对应,淋巴细胞数量减少往往与免疫反应减弱有关,从而导致肿瘤的增殖和转移。虽然对淋巴细胞减少的定义不一致,但多数研究均表明了低ALC 可能是恶性肿瘤的不良预后因素[27],其中也包括对ENKTL 在内的研究[19-20]。值得注意的是,本研究对Ann Arbor I~II 期患者的预后分析结果表明,ALC 可能是影响早期ENKTL 患者总体生存期的有力因素。
近年来,多项研究表明RLR 具有作为肿瘤预后评估指标的潜能。一项研究发现结直肠癌患者RLR 水平高于健康人群,且指出RLR 或许可作为结直肠癌诊断的一种候选标志物[12]。另有研究表明RLR 与肾细胞癌[18]、恶性黑色素瘤[17]的预后密切相关。本研究显示RLR 不仅是影响ENKTL患者OS 的重要因素,也是低危患者风险分层的有效工具。
目前,IPI、KPI、PINK 和NRI 评分模型已被广泛应用于ENKTL 患者的预后评估,为临床决策提供额外的信息。虽然IPI 预后价值已在部分NHL 亚型中得到验证,但可能低估了部分患者存在的风险,故在ENKTL 中的作用仍存在争议[6]。而针对ENKTL 提出的KPI 评分,虽显示出了比IPI 更佳的预测鉴别力[28],然而,随着含天冬酰胺酶药物化疗方案的广泛应用,基于蒽环类药物所开发的KPI 模型也被认为存在一定的局限性。尽管PINK 评分在接受非蒽环类化疗方案的患者中也得到了验证[29],但其在早期患者中的风险识别能力也存在固有缺陷。最近开发的NRI 评分在鉴别、风险分层、预测准确性等方面均显示出优于IPI、KPI、PINK 模型的能力[30]。在本研究中,NRI 模型比IPI、KPI 和PINK 模型能更好地平衡了患者在不同风险组中的分布,并且做到区分各风险组之间的生存差异。然而,其他三个模型未能进一步鉴别低风险组(评分为0~1 分)患者的生存差异。通过生存和分层分析,本研究发现RLR 可能拥有良好的区分低危患者生存差异的能力和风险分层能力。
本研究纳入了多项ENKTL 相关的危险因素,包括年龄>60 岁、ECOG PS 评分≥2 分、B 症状阳性、LDH 升高、RLN 侵犯、EBV 感染等。在单因素分析中,这些危险因素有一半与OS 显著相关,但其中3 个因素(RLN 侵犯、DLN 侵犯、EBV-DNA 升高)没有显示出其统计学上的预后意义。本研究未发现RLN 侵犯与ENKTL 患者OS 的相关性,这与其他研究的结果不一致[1,6],可能与初步治疗差异有关,当RLN 包括在放疗范围内时可能获得更好的局部控制效果。此外,有研究探讨了DLN 侵犯作为ENKTL 危险因素的价值[6,31],但也有研究未发现DLN 侵犯与生存结果之间的显著关联[32]。与Li 等人的研究结果一致[6],在本研究中EBV 感染同样不是OS 的显著预测因子,这可能与本研究根据病毒DNA 的可检测性而非更为准确的病毒滴度对患者进行分组有关。值得注意的是,这些危险因素显示为阴性结果还可能与ENKTL 的临床异质性、纳入的病例数量较少、随访时间相对较短有关。此外,本研究发现ECGO PS 评分在纳入RLR 的多因素分析中没有显示出其预后价值,这可能是由于本队列患者的PS 评分与RLR 存在一定的相关性。
本研究存在一定的局限性。首先,本研究为单中心的回顾性研究,且由于ENKTL 的罕见性,患者数量较少。其次,治疗方案与预后之间的相关性尚未得到验证。第三,不同研究的RLR 没有一致的截断值,导致本研究结果与其他研究难以进行比较,因此有必要进一步设计良好的前瞻性研究,并扩大样本量,以进一步验证研究结果。总之,本研究结果表明,ALC 可作为早期ENKTL患者预后的评估指标,RLR 可能有助于ENKTL患者风险分层和临床决策。

