基于网络药理学和分子对接技术分析川楝子致肝毒性机制
何山,欧水平,叶林虎,王森*,吴大章,
1.遵义医科大学 药学院,贵州 遵义 563000
2.遵义医科大学附属医院 药剂科,贵州 遵义 563000
3.华南理工大学附属第六医院,广东 佛山 528000
4.太极集团重庆桐君阁药厂有限公司,重庆 401366
川楝子又名川楝实,是楝科植物川楝Melia toosendanSieb.et Zucc.的干燥成熟果实,主要分布在我国的四川、湖南、湖北、贵州等地区,因入药以四川产为道地药材,故名为川楝子[1]。川楝子中富含萜类、黄酮类、有机酸以及多糖等多种活性成分[2],具有抗炎、抗肿瘤、抗菌、消炎镇痛、驱虫等广泛药理作用[3]。随着对川楝子的研究,发现其除了具有药理作用,还具有一定的毒性作用,在川楝子毒性方面的研究中,早期有报道称,在用川楝子进行驱虫时,发现有28 例发生中毒现象,10 例死亡病例[4]。近年来,通过对其毒性研究发现其具有肝毒性、妊娠毒性、肌无力、神经肌肉毒性[5]、消化系统[6]等,主要表现在胃肠道刺激和肝毒性方面。胃肠道刺激方面,有报道称服用川楝子的患者通常在服药后1~2 h 内就会发生胃肠刺激反应[7]。肝毒性方面,近年来,越来越多的文献研究表明川楝子确实可导致肝毒性,在报道的92 例中药致药物性肝损伤的病例中,其使用的有大部分中药及制剂含有川楝子等成分[8];赵筱萍等[9]快速筛查川楝子肝毒性成分并鉴定发现,川楝子中的meliasenin B、trichilinin D、1-O-tigloy-1-O-debenzoylohchinal 可能引起肝毒性,王昆阳等[6]研究中报道这3 者是川楝子致肝毒性的物质基础。大多数认为毒性蛋白和川楝素类化合物是川楝子的毒性来源[10],但目前针对川楝子毒性物质基础和毒性机制尚未完全明确,因此,本研究通过网络药理学[11]及分子对接技术探讨川楝子致肝毒性的物质基础和机制,以期为临床研究提供理论依据。
1 方法
1.1 川楝子候选毒性化合物的筛选
在中药药理数据库及分析平台(TCMSP)中输入“川楝子”进行搜索,获取川楝子活性化合物,并通过设置口服生物利用度(OB)≥30%,类药性(DL)≥0.18,对川楝子活性成分进行筛选,然后将从TCMSP 数据库中筛选出的化合物在PubChem(https://pubchem.ncbi.nlm.nih.gov)数据库中下载候选成分的化学结构。并将其上传至Swiss ADME 平台(http://www.swissadme.ch),以肠胃吸收为“high”和类药性五原则(Lipinski、Ghose、Veber、Egan、Muegge)中至少有2 个结果是“Yes”为标准进行筛选,得到川楝子的活性成分,将活性成分输入CTD 数据库进行毒性筛选,结合文献报道[9,12,13,14]的毒性成分补充,最终确定川楝子潜在毒性成分。
1.2 川楝子潜在毒性成分靶点的预测
通过 PubChem(https://pubchem.ncbi.nlm.nih.gov)数据库下载毒性成分的2D 结构的sdf 格式文件,并将下载的毒性成分的2D 结构式或标准的Smiles 号导入SwissTargetPrediction(http://www.swisstargetprediction.ch/)数据库中,属性设置为“homo sapiens”,分别进行不同毒性成分的靶点基因预测,并用TCMSP 中已有的靶点进行补充。
1.3 肝脏相关靶点的获取
在 GeneCards 数据库中输入主题词“liver toxicity”进行检索,以score 值中位数为标准,筛选score 值大于中位数的靶点,即为肝脏相关靶点。
1.4 川楝子肝脏毒性潜在作用靶点预测
将川楝子毒性成分的靶点与肝脏损伤相关靶点上传到在线韦恩图(www.bioinformatics.com.cn/static/others/jvenn/example.html),以川楝子毒性成分靶点和肝毒性靶点进行作图,二者的交集即为川楝子的肝脏毒性潜在作用靶点。
1.5 川楝子“毒性成分–预测靶点”“毒性成分–潜在作用靶点”网络的构建
整理川楝子毒性成分与对应靶点信息及1.4 项下的交集靶点信息,利用软件Cytoscape 3.8.2 版构建川楝子“毒性成分–预测靶点”“毒性成分–潜在作用靶点”网络图。
1.6 潜在作用靶点基因的蛋白质相互作用(PPI)网络的构建
将川楝子毒性成分靶点基因与肝脏损伤相关靶点基因的交集导入String 数据库(https://stringdb.org/)中,选定研究物种为“Homo Sapiens”,设置连接评分值>0.7,隐藏相互没有链接的蛋白,得到PPI 网络图。并应用软件Cytoscape 3.8.2 版对网络进行可视化处理和分析。
1.7 靶点蛋白的基因功能和通路分析
应用生物学信息注册数据库DAVID(https://david.ncifcrf.gov)对川楝子毒性成分肝脏潜在作用靶点进行基因本体(GO)功能富集分析及京都基因与基因组百科全书(KEGG)通路富集分析,获得川楝子毒性成分对肝脏作用的主要生物过程和主要信号通路。并利用微生信数据库(www.bio informatics.con.cn)在线构建GO 功能富集网络图,再利用软件Cytoscape 3.8.2 版以KEGG 分析结果中的显著通路数据信息构建川楝子致肝毒性的“毒性成分–潜在靶点–核心通路”网络图,对该网络进行拓扑学性质分析,筛选川楝子致肝毒性的核心成分及核心靶点。
1.8 分子对接
将待对接成分从PubChem 数据库中下载结构的sdf 格式文件,通过Open Babel(https://openbabel.org)软件将sdf 文件格式转化为pdb 格式文件,采用AutoDock Tools 1.5.6 软件对分子进行加氢和结构优化,并输出其格式为pdbqt 文件格式作为分子对接中的配体。从PDB(http://www.rcsb.org/)数据库下载带对接靶点3D 结构,对其结构进行预处理,去除水分子和配体残基,采用AutoDock Tools 1.5.6软件进行和加氢等操作,输出其pdbqt 格式作为分子对接中的受体。将受体与配体的pdbqt 格式文件导入AutoDock Tools 1.5.6 软件中获得相应毒性口袋,设置Gridbox 做标及大小,运行AutoDock Vina脚本进行分子对接,得到其结合情况评估参数affinity 值,并通过开源软件Pymol 对其对接结果进行可视化。
2 结果
2.1 川楝子的潜在毒性化合物的筛选
在TCMSP 数据库中共检索到33 个川楝子活性化合物,按照OB≥30%和DL≥0.18 筛选后得到9 个活性化合物,见表1。通过CTD 数据库和文献搜索共搜集到6 个毒性化合物(通过筛选发现表1中的9 个活性成分均没有肝毒性,因此,表2 中的6 个毒性成分均来自于文献报告,并通过CTD 数据库验证),见表2。
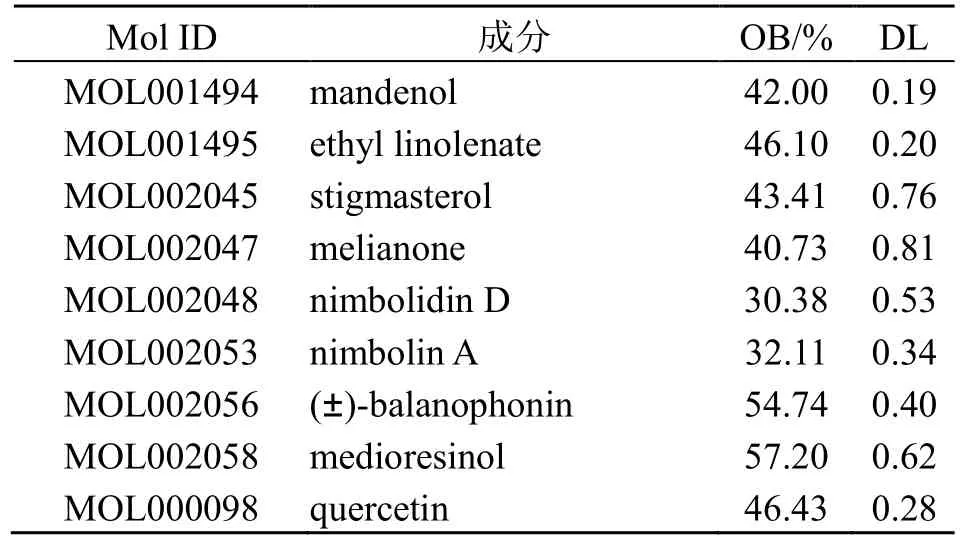
表1 TCMSP 数据库中川楝子的9 个活性成分Table 1 Nine active components of Toosendan Fructus in TCMSP database

表2 川楝子的毒性成分Table 2 Toxic components of Toosendan Fructus
2.2 川楝子“毒性成分–预测靶点”网络的构建
川楝子的毒性成分预测出350 个作用靶点,将毒性成分、靶点导入软件Cytoscape 3.8.2 版中,删除未连线靶点,从而得到川楝子“毒性成分–预测靶点”网络图,见图1。在该网络图中,共有263 个节点,686 条边,其中圆形节点代表川楝子毒性成分的预测靶点,棱形节点代表川楝子的毒性成分,中间“V”节点代表川楝子。degree 值代表与该节点相连的边的数量,在该网络图中,degree 值>2 倍中位数的靶点中前10 位的靶点有花生四烯酸5-脂氧合酶(ALOX5)、羧酸脂酶2(CES2)、羟基类固醇11-β 脱氢酶1(HSD11B1)、双微粒体2(MDM2)、脾酪氨酸激酶(SYK)、丝裂原活化蛋白激酶14(MAPK14)、大麻素受体1(CNR1)、大麻素受体2(CNR2)、磷酸二酯酶10A(PDE10A)。
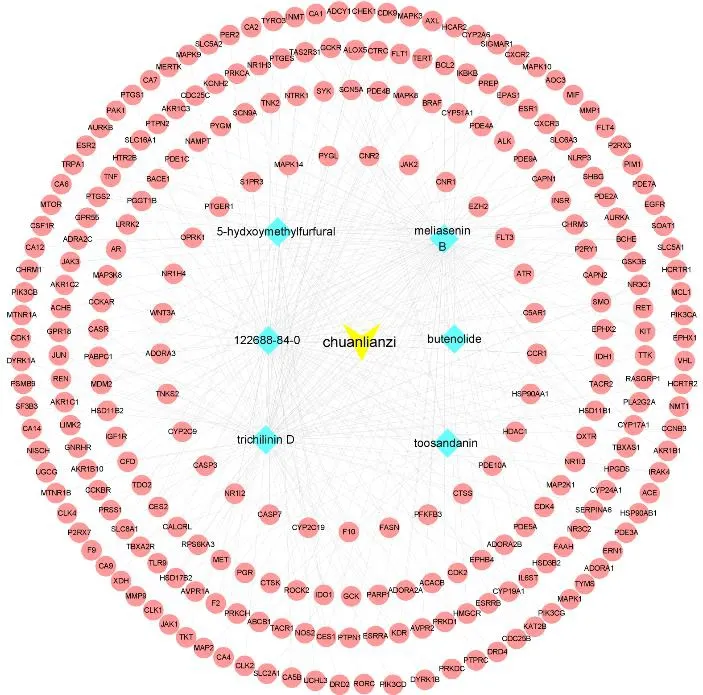
图1 川楝子“毒性成分–预测靶点”网络Fig.1 “Toosendan Fructus toxic component-predictive target” network
2.3 川楝子致肝毒性“毒性成分–潜在作用靶点”网络的构建
在GeneCards 中检索到关于肝脏损伤的基因,并筛选出score 值≥中位数的靶点,得1 295 个肝脏损伤靶点,与川楝子毒性成分预测靶点取交集,得到103 个交集靶点,即为川楝子致肝毒性的潜在作用靶点,见图2。
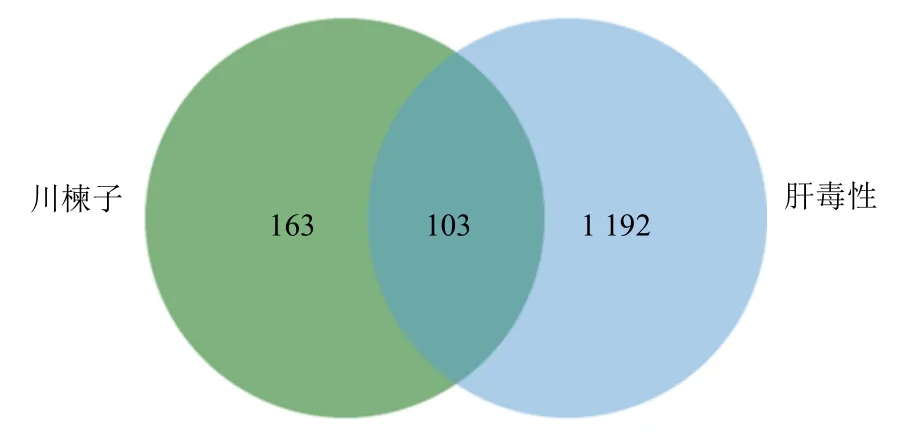
图2 川楝子毒性成分预测靶点与肝脏损伤靶点交集Fig.2 Intersection of predicted targets of Toosendan Fructus toxicity components with liver injury targets
根据103 个川楝子肝毒性潜在作用靶点,将其导入软件Cytoscape 3.8.2 版中构建得到川楝子“毒性成分–肝脏潜在作用靶点”网络图,见图3。在该网络图中,共有110 个节点,包括103 个靶点和6 个毒性化合物,301 条边,图中棱形节点代表川楝子毒性成分,方形节点代表川楝子毒性成分致肝脏毒性潜在作用靶点。节点的degree 值代表与该节点相连的边的数量,节点的大小与其degree值呈正比,该网络中degree>2 倍中位数即degree>2 的靶点有CES2、HSD11B1、MDM2、SYK、MAPK14、髓样细胞白血病蛋白1(MCL1)、表皮生长因子受体(EGFR)、磷脂酰肌醇激酶-3 催化亚单位α 基因(PIK3CA)、基质金属蛋白酶9(MMP9)、哺乳动物雷帕霉素靶蛋白(mTOR)。
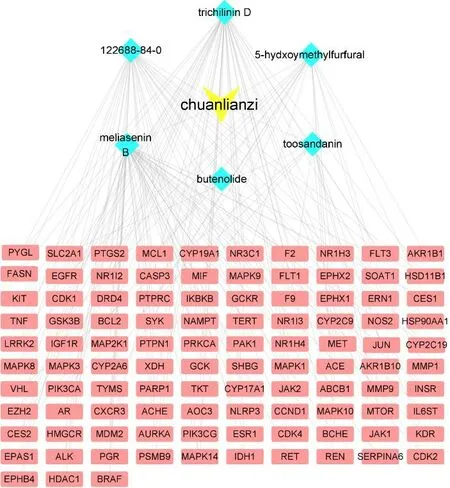
图3 川楝子“毒性成分–肝脏潜在作用靶点”网络图Fig.3 Network diagram of “toxic constituents-potential liver targets” of Toosendan Fructus
2.4 川楝子致肝脏毒性潜在作用靶点的PPI 网络的构建
将筛选出的川楝子肝脏毒性103 个潜在作用靶点导入STRING 数据库在线分析,将分析结果数据导入Cytocape 3.8.2 软件中构建PPI 网络,见图4。该网络中共有96 个节点,1 652 条边,网络中degree排名前10 位的靶点为热休克蛋白90α 家族A 类成员1(HSP90AA1)、MAPK3、转录因子AP-1(JUN)、EGFR、MAPK1、半胱氨酸天冬氨酸蛋白酶-3(CASP3)、PIK3CA、肿瘤坏死因子(TNF)、雌激素受体α(ESR1)、MAPK8,见表3。

图4 川楝子致肝毒性潜在作用靶点PPI 网络Fig.4 PPI network of potential targets of Toosendan Fructus hepatotoxicity
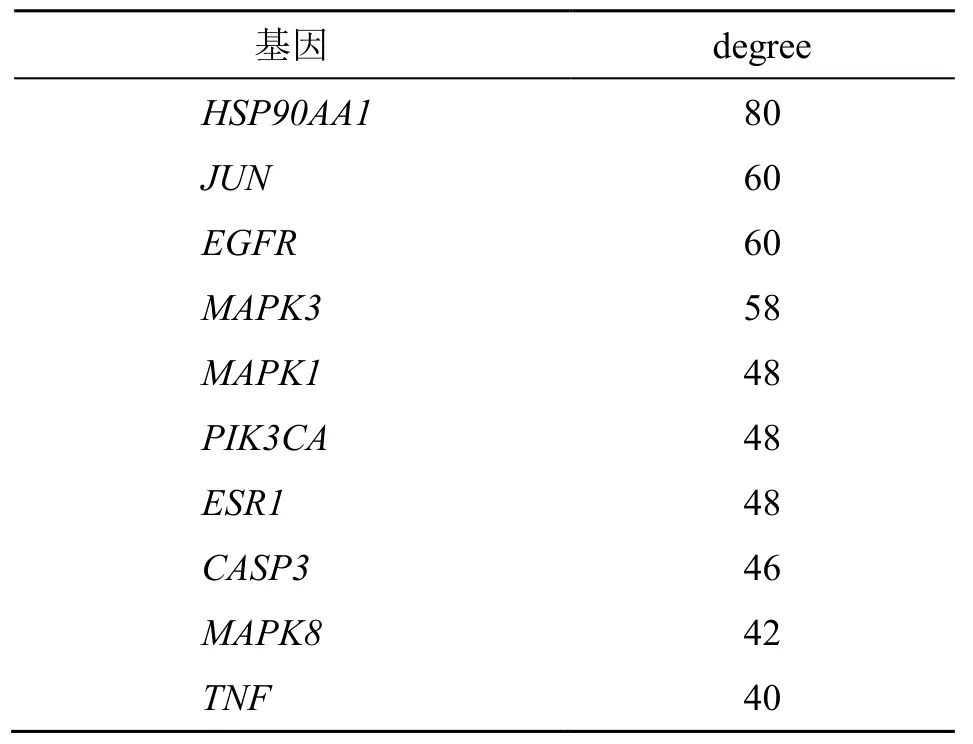
表3 PPI 网络中毒性潜在作用靶点degree 值排名前10 位的靶点Table 3 Top 10 targets in the PPI network in terms of degree value for toxicity potential effect targets
2.5 川楝子致肝毒性潜在靶点的GO、KEGG 富集分析
川楝子致肝毒性的103 个潜在毒性靶点在GO富集分析(P<0.05),其中生物功能(BP)共富集394 个条目,前20 个条目涉及凋亡过程的负调控、对激酶活性的正向调控、蛋白质磷酸化、基因表达的正向调节、MAPK 级联的正调节、对MAP 激酶活性的正向调节等过程;细胞组分(CC)共富集60个条目,前20 个条目涉及受体复合体、胞质、核质体、浆膜、大分子复合体、内质网腔体等部位;分子功能(MF)共富集108 个条目,前20 个条目包括蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性、蛋白酪氨酸激酶活性、蛋白酸激酶活性、ATP 结合、跨膜受体蛋白酪氨酸激酶活性、酶结合等功能,见图5。川楝子致肝毒性的103 个潜在靶点在KEGG 富集中共富集到154 条信号通路,前20 条通路包括癌症通路、前列腺癌通路、EGFR 酪氨酸激酶抑制剂抗性、磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号通路、卡波西肉瘤相关的疱疹病毒感染、乙型肝炎、癌症中的碳代谢、催乳素信号通路、白细胞介素-17(IL-17)信号传导等通路,见图5。
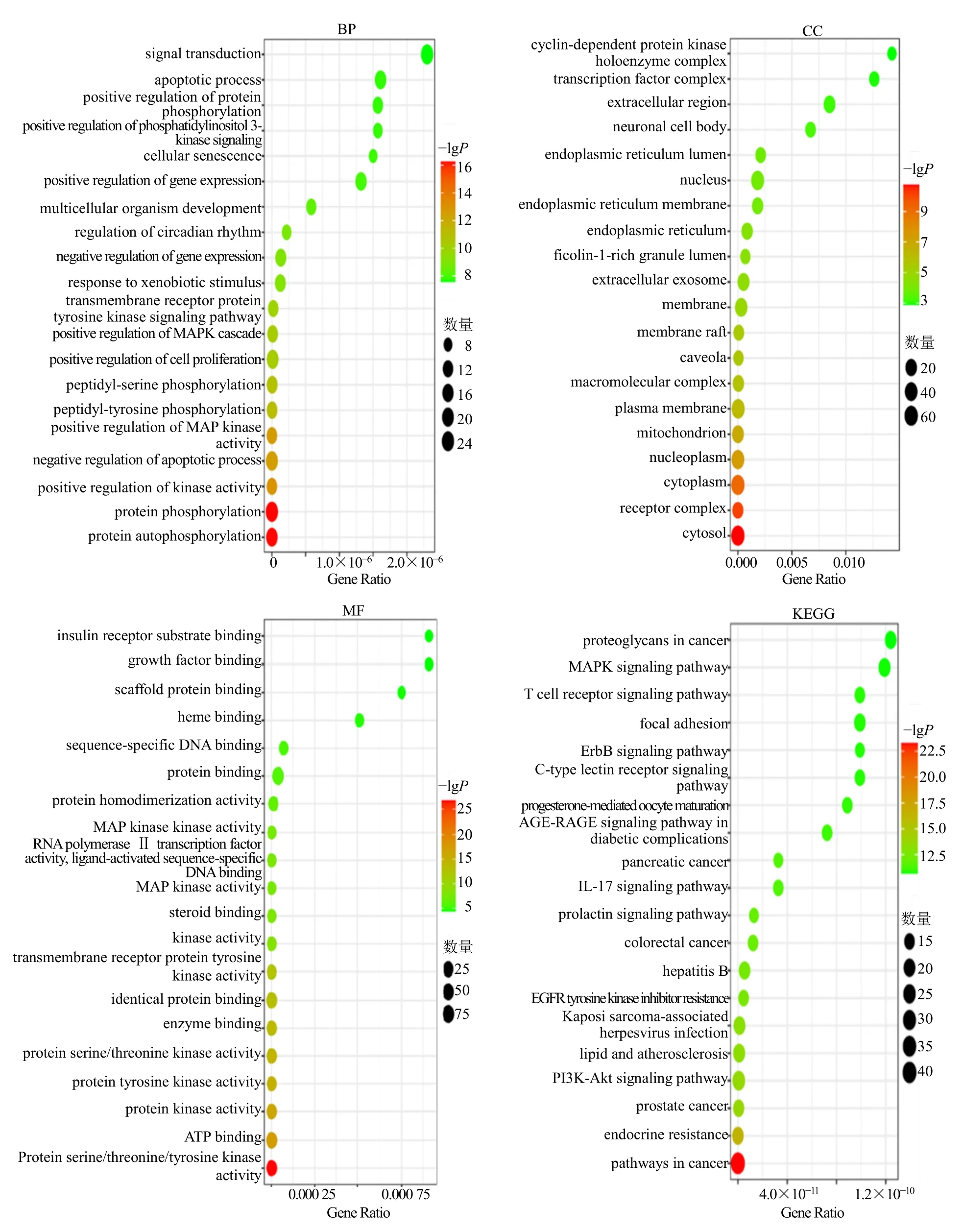
图5 川楝子致肝毒性潜在作用靶点GO 和KEGG 分析Fig.5 GO and KEGG analysis of potential targets of Toosendan Fructus hepatotoxicity
2.6 川楝子致肝毒性“毒性成分–潜在作用靶点–核心通路”网络的构建
以KEGG 富集分析中富集程度显著的通路构建川楝子致肝毒性“毒性成分–潜在作用靶点–核心通路”网络。该网络中共有128 个节点,1 004 条边,网络中四边形节点代表潜在作用靶点;圆形节点代表核心通路;棱形节点代表毒性成分,节点大小与其degree 值呈正比,见图6。
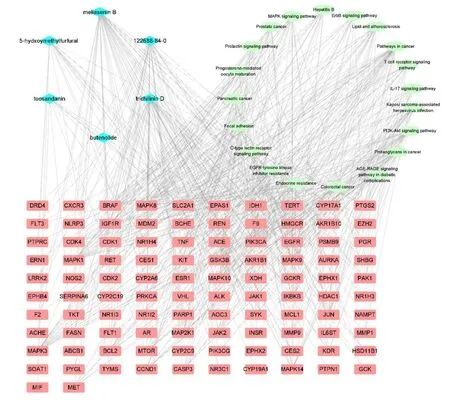
图6 川楝子致肝毒性“毒性成分–潜在作用靶点–核心通路”网络Fig.6 Toosendan Fructus hepatotoxicity “toxic component-potential target-core pathway” network
在“毒性成分–潜在毒性作用靶点–核心通路”网络中,毒性成分及degree 值见表4,网络中靶点degree 值排列在前10 位的靶点为MAPK1、MAPK3、PIK3CA、MAP2K1、EGFR、MAPK14、MAPK8、mTOR、MAPK10、JUN,见表5。

表4 关键毒性成分Table 4 Key toxicological components
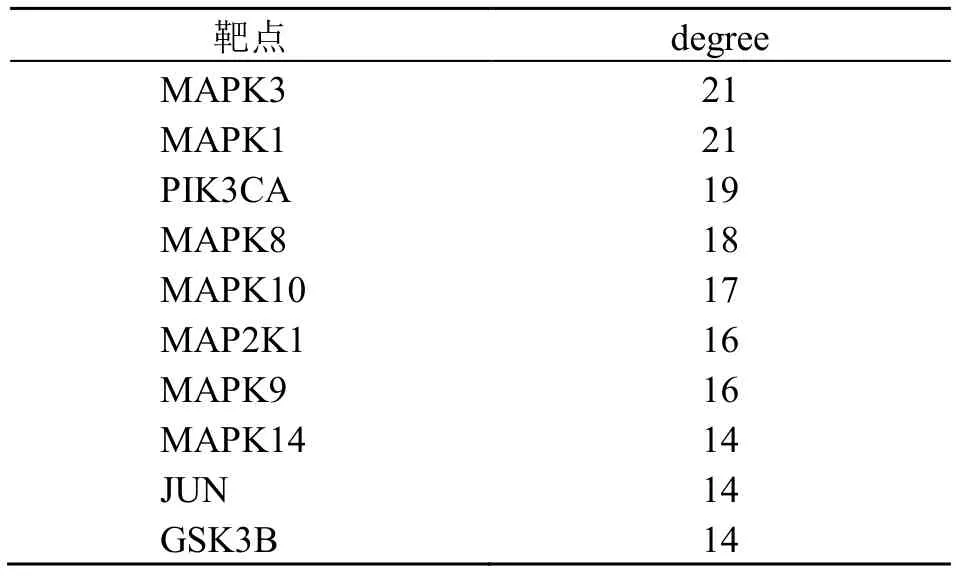
表5 关键靶点Table 5 Key targets
2.7 分子对接
将“毒性成分–潜在毒性靶点–核心通路”网络中degree 值前5 位的靶点作为受体,得到受体靶点为MAPK1(degree=21)、MAPK3(degree=21)、PIK3CA(degree=19)、MAPK8(degree=18)、MAPK10(degree=17),其PDB ID 分别是2y9q、4qtb、7jiu、2xrw、3oy1,并将与受体对应的毒性成分作为对接的配体,应用软件AutoDock 1.5.6 版进行分子对接,对接信息见表6。其中PIK3CA 和MAPK8 均分别与2 个毒性成分进行对接,5 个受体与trichilinin D 对接,以分子对接结合能作为评价对接结果验证的指标,在所有对接结果中,结合能均<-1.5 kcal/mol(1 kcal=4.2 kJ),表明关键毒性成分与关键靶点有较好的结合能力,可以在不需要外界能量的条件下进行对接。

表6 对接结合能Table 6 Docking binding energy
使用PyMOL 软件对对接结果进行可视化示例,图中主要显示为小分子配体和于其相结合的受体结合位点氨基酸,均选用棍状结构显示,见图7。

图7 核心节点对接结果的可视化处理Fig.7 Visualization of core node docking results
3 讨论
近年来,关于川楝子及其制剂肝毒性的文献报道越来越多,在动物实验、细胞实验、以及不同的炮制工艺等实验中均验证了川楝子具有肝毒性。乌日汉等[15]通过设计剂量差异验证了川楝子高剂量(2.571 4 g/kg)组导致小鼠肝脏的丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)显著升高,肝细胞发生明显的水胀以及出现大小不同的水泡;中剂量组的甘油三酯(TG)显著升高,个别肝细胞发生水胀、胞质疏松,提示川楝子具有一定的肝脏毒性且毒性作用存在一定的剂量相关性,随剂量的增加而毒性增强。通过代谢组学验证了川楝子肝毒性机制可能与ABC 转运蛋白紊乱,氨基酸、嘌呤、嘧啶代谢有关[16];刘伟等[17]和Yu 等[18]报道川楝子可能通过PI3K/Akt 信号、p53 信号和PTEN 信号3 种途径介导肝细胞凋亡而引起肝毒性;齐双岩等[19]报道川楝子的肝毒性机制可能与炎症因子有关。川楝子因其存在的肝脏毒性作用,导致其临床应用受到一定的限制。
本研究通过建立川楝子毒性成分–预测靶点、毒性成分–潜在作用靶点、蛋白质相互作用、生物功能和通路网络、毒性成分–潜在毒性作用靶点–核心通路网络以及分子对接技术探讨川楝子的肝毒性机制。本次筛选共得到6 个毒性相关成分,川楝素(toosendanin)、meliasenin B、trichilinin D、1-O-tigloy-1-O-debenzoylohchinal、丁烯酸内酯(butenolide)、5-羟甲基糠醛(5-hydxoy methylfurfural)。其中,对川楝素的肝毒性机制研究已有较多文献报道,目前已被报道的毒性机制包括(1)蛋白共价结合和修饰:Yu 等[12]的报道称,川楝素在体内的代谢途径主要是酯解和与氨基酸结合,川楝素被细胞色素P450 家族中的CYP3A4 酶激活后会生成顺丁烯-1,4-双环中间体,该中间体易与氨基酸中的氨基和谷胱甘肽发生加成反应,这可能是川楝素产生肝毒性的原因。(2)线粒体功能障碍:线粒体是合成能量物质ATP 的主要场所,ATP 在细胞的生长、繁殖、代谢过程中起着关键作用,Zhang等[20]的研究称,川楝素通过使线粒体发生功能障碍,使线粒体膜电位和细胞内ATP 水平降低,以及激活caspase-8、9、3,进而诱导大鼠原代肝细胞死亡。(3)细胞凋亡:细胞凋亡是由丝裂原活化蛋白激酶(MAPKs)的激活所介导发生的,有报道称,MiRNAs 可能是反映川楝素致肝毒性的潜在毒理学标志物[17]。以此为依据,Zheng 等[21]分析川楝子水提物染毒小鼠外周血中的miRNAs 探讨川楝子致肝毒性机制,分析表明,川楝子诱导的肝脏毒性可能与细胞凋亡、细胞周期紊乱和线立体功能障碍有关。(4)氧化应激:齐双岩等[19]通过川楝子大鼠给药与正常大鼠肝组织进行比较发现,川楝子给药大鼠的肝组织中的超氧化物歧化酶(SOD)显著下降,丙二醛(MDA)显著上升,γ-谷氨酰转肽酶(γ-GT)显著上升,谷胱甘肽过氧化物酶(GSH-Px)显著降低,肿瘤坏死因子-α(TNF-α)的含量升高,细胞间黏附分子-1(ICAM-1)阳性表达显著增强,提示川楝子的肝毒性机制可能与氧化应激和炎症反应有关。(5)溶酶体功能障碍:Luo 等[22]的研究报道称,川楝素通过抑制TFEB 介导的溶酶体功能障碍抑制自噬通量可能是导致肝脏毒性的机制。近期Chang等[23]的研究发现,肝细胞坏死、脂质代谢问题和线粒体功能障碍是川楝素致肝毒性的主要因素。除川楝素外,对其他毒性成分的机制研究较少,彭双清等[13]的研究报道称丁烯酸内酯可能导致粒细胞增加,血浆蛋白减少而引发肝损伤。El Bohi 等[14]的研究发现5-hydxoy methylfurfural 不仅会产生遗传毒性和细胞凋亡,还能抑制小鼠的抗氧化机制,从而改变肝脏的结构和功能。
关键靶点MAPK1、MAPK3、PIK3CA、MAPK8、MAPK10 涉及多条通路,其中MAPK1、MAPK3 和PIK3CA 均主要涉及PI3K/Akt 信号通路。PI3K/Akt信号通路可被细胞刺激或毒性损伤而激活,PI3K/Akt 通路与调控细胞生长增殖、细胞凋亡、代谢有关,PI3K 被激活后活化下游的Akt 磷酸化,进一步促进肝损伤[24-25]。MAPK3、MAPK1、MAPK8、MAPK10 均是MAPKs 家族的重要成员,在调控细胞生长、增殖、凋亡等生物过程中起着重要作用,倪佳等[26]通过克隆MAPK3 证明MAPK3 对肝、癌细胞的增殖、迁移以及侵袭具有促进作用。MAPK1与MAPK3 常共同组成MAPK1/3,研究表明,MAPK1/3 不仅与细胞的生理功能有关,还与细胞的生物过程(生长、增殖、分化、凋亡等)有关。MAPK8又称JNK1,Li 等[27]研究称,MAPK8(JNK1)在肝细胞癌中可以通过促进c-Myc 基因的表达和降低增值抑制因子p21 的表达来肿瘤的生长。MAPK10(JNK3)是多种生化信号的结合点,通过广泛影响细胞过程而在肿瘤的发生、发展过程中发挥着重要作用,Li 等[27]的研究报道称,MAPK10 的表达是肝癌病人生存的重要预后因素;Li 等[28]证实了Circ-0000515 通过降低MAPK10 的表达进而加重肝癌的恶性表达。PIK3CA 是PI3K 的α 亚基,是一种促癌基因[29],近年来,研究发现PIK3CA 在肝癌、胃癌、卵巢癌等多种恶性肿瘤中发生突变,是目前发现的在促癌基因中发生突变频率最高的基因之一[30]。提示川楝子中毒性化合物可能通过对PI3K/Akt 信号通路中相关靶蛋白的调控而引发肝毒性。
分子对接验证选择5 个关键靶蛋白分别于对应的潜在毒性化合物进行分子对接,结果显示,川楝子潜在毒性成分川楝素、trichilinin D、1-O-tigloy-1-O-debenzoylohchinal 与MAPK1、MAPK3、PIK3CA、MAPK8、MAPK10 具有较好的结合能力,结合文献对川楝子肝毒性和毒性成分的研究以及部分机制研究,提示网络药理学与分子对接预测川楝子致肝毒性的可靠性。
利益冲突所有作者均声明不存在利益冲突

