科尔沁沙地樟子松人工林土壤真菌共现网络及其与土壤因子的关系
刘明慧, 柳 叶, 任 悦, 高广磊,2,3,*, 丁国栋,2,3, 张 英,2,3, 赵珮杉, 刘 轩
1 北京林业大学水土保持学院, 林业生态工程教育部工程研究中心, 北京 100083
2 宁夏盐池毛乌素沙地生态系统国家定位观测研究站, 盐池 751500
3 水土保持国家林业和草原局重点实验室, 北京 100083
在生态系统中,土壤真菌发展出复杂的种间相互作用,包括协同、竞争和拮抗等关系[1],物种间通过这些关系直接或间接地联系在一起,维持生态系统的稳定性[2]。土壤真菌群落结构和功能动态,既与真菌的相互作用相关,也受环境影响[3]。土壤真菌群落不仅受植被恢复、凋落物和根系分泌物的直接影响,同时受土壤理化性质的间接影响[4—5]。因此,明确土壤真菌相互关系及土壤因子对其影响,对深入认识和理解土壤真菌群落结构有重要意义。但是,由于传统土壤真菌研究方法在识别和判定种间关系方面的局限性,对于土壤真菌相互关系的理解依然较为薄弱。
分子生态网络分析是一种新兴的探索性数据分析方法,该方法基于随机矩阵理论,依托基因测序技术,在合适的阈值选择下可以表征群落的相互关系并鉴别出群落关键种[6]。土壤真菌共现网络利用生态网络分析及高通量测序数据,解决真菌群落间复杂的相互关系[7]。共现网络为解释复杂的土壤真菌群落提供了一种新的方式不仅可以直观展示土壤真菌间复杂的相互作用,还可以有效表征土壤真菌群落对环境变化的响应,并在陆地生态系统中得到了广泛应用[8]。与传统的土壤真菌群落研究方法相比,网络分析对于发现真菌群落构建和维持稳定过程中的真菌相互关系提供了丰富的研究手段,而通过对群落的多样性分析很难得到这些结果[6]。研究发现,利用网络分析可以明确土壤深度增加后,微生物间的相互作用情况[9],此外,通过生态网络分析不同树龄林木土壤真菌群落结构和潜在功能变化,有利于制定良好的土壤管理措施,促进森林的可持续性,对提高林木生产力和健康具有潜在意义[10]。我国东部地区森林土壤中,高纬度地区土壤菌群共存关系更普遍,但相互影响强度却较低纬度地区土壤菌群小[11];我国沙地樟子松根系真菌网络对土壤含水量变化敏感[12]。因此,共现网络是研究揭示土壤真菌相互关系及其环境影响因素的有效途径[13]。
樟子松(Pinussylvestrisvar.mongolica)是欧洲赤松(P.sylvestris)在东亚的地理变种,原产于我国大兴安岭和呼伦贝尔红花尔基地区,具有耐寒耐旱耐贫瘠、适应性强和生长快等特性,是我国北方干旱半干旱地区防风固沙的重要树种[14—15]。同时,樟子松也是典型的外生菌根依赖型树种[16],其生长和健康状况受土壤真菌相互关系的影响。因此,土壤真菌在樟子松生长过程中发挥一定作用,并且在不同阶段发挥主要作用的土壤真菌并不相同。鉴于此,本研究以科尔沁沙地樟子松人工林为研究对象,采用分子生态网络分析方法,分析樟子松人工林土壤真菌群落种间相互作用,以及土壤理化性质对土壤真菌网络的影响,明确樟子松人工林土壤真菌种间关系及其对土壤因子的响应,并为樟子松人工林可持续经营管理提供科技支撑。
1 材料与方法
1.1 研究区概况
研究区位于科尔沁沙地东南部辽宁章古台沙地国家森林公园(42°23′N,122°22′E),该公园始建于20世纪50年代,1986年经彰武县政府批准建立县级自然保护区,2003年晋升为省级自然保护区,2012年晋升为国家级自然保护区。经过几代人努力,1951年到2021年林地面积由120 km2到2021年增加到1367 km2,森林覆盖率从2.9%提高到34.5%,平均风速由3.4 m/s降到1.9 m/s[17]。沙地总面积约为6.63万km2,处于内蒙古高原向东北平原的过渡带。研究区属温带亚湿润大陆性季风气候,昼夜温差大,光照充足。年均气温8.0 ℃,年均降水量526.5 mm,年蒸发量约1932.7 mm,年均日照时数为2615.2 h,海拔226.5 m。土壤类型主要为风沙土。研究区常见植物包括樟子松、胡枝子(Lespedezabicolor)、小叶锦鸡儿(Caraganamicrophylla)、狗尾草(Setariaviridis)、羊草(Leymuschinensis)和冰草(Agropyroncristatum)等[18]。
1.2 样品采集与处理
2017年7月,在研究区选取立地条件和管理措施相同的中龄(26 a)、近熟(33 a)和成熟(44 a)樟子松人工林为实验样地,在人工林中分别随机设置50 m×50 m样地(表1)。樟子松人工龄组根据国家林业行业标准中主要树种龄级与龄组划分(LY/T 2908—2017)确定,其中年龄范围21—30 a为中龄林,年龄范围31—40 a为近熟林,年龄范围41—60 a为成熟林[19]。每木检尺后,在每个樟子松人工林样地内随机选取5株间距在10 m以上的标准木,去除地表枯落物,采用五点取样法采集樟子松树冠投影下土壤样品[14,20]。由于研究区的樟子松是在未造林地上进行造林,因此以邻近地段未造林地为对照样地,在未造林地内随机选取3个1 m×1 m取样点,采用五点取样法采集土壤样品。各样地采样深度为0—10和10—20 cm土层的土壤样品,每个土层随机采集3份样本,并将其充分混合为一个样品。将采集的土样分别装入密封袋并编号,置于4 ℃便携恒温箱保存,带回实验室后,取一部分土壤自然风干后室温存放用于理化性质测定,剩余土样于-80 ℃冷冻保存用于真菌分子生态学鉴定。

表1 科尔沁沙地樟子松人工林样地概况
1.3 土壤理化性质测定


表2 科尔沁沙地樟子松人工林土壤真菌网络拓扑性质
1.4 土壤真菌的分离与鉴定
使用Power Soil®DNA Kit(Mo Bio Laboratories,美国)试剂盒对土壤真菌样品进行DNA抽提取,完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。以引物ITS1F(5′-CTTGGTCATTT AGAGGAAGTAA-3′)和ITS2(5′-GCTGCGTTCTTCATCGATGC-3′)采用Trans Gen AP221-02: Trans Start Fastpfu DNA Polymerase扩增真菌rDNA ITS区域。聚合酶链反应(PCR)扩增时,每个样本需做3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司,美国)切胶回收PCR产物,再用Tris_HCl洗脱;最后用2%琼脂糖电泳检测。凝胶成像后,合格的PCR产物使用Illumina MiSeq测序系统(Illumina,美国)进行测序。合格的PCR产物需满足以下两点:1)尽可能使用低循环数扩增;2)保证每个样本扩增的循环数一致。随机选取具有代表性的样本进行预实验,确保在最低循环数中使绝大多数样本能够扩增出浓度合适的产物。稀疏曲线见图1。

图1 样品稀释曲线图
使用Trimmomatic和FLASH对原始fastq文件进行质量过滤和合并。使用Usearch程序包(版本8.1.1861,http://www.drive5.com/usearch/)删除嵌合序列。测序结果对97%的相似水平上的操作分类单元(OTU)进行聚类,并进行生物信息统计分析[22]。
1.5 数据处理与分析
使用SPSS计算OTU间Pearson相关性(r>0.6)与显著性值(P<0.05),并用R 4.1.2建立土壤真菌相关性矩阵,使用R“igraph”包将相关系数矩阵转化为网络文件,计算网络拓扑属性并生成随机网络,拓扑属性包括网络节点数即网络中的物种数;平均聚类系数即节点与其他节点间连通度的好坏,反应了网络的凝聚性;平均路径长度即节点间最短路径的长度;模块化是用来衡量网络划分情况的;平均连通度即某个节点与其他相邻节点的连接数之和[23],反映了网络中能量流动和信息传递程度反映了网络中能量流动和信息传递程度,直观展示真菌间的作用关系[24],随机网络为随机生成的1000个节点和边数与共现网络相同的网络,比较其与共现网络的平均聚类系数和平均路径长度,判别土壤真菌网络是否有意义。为减少配对比较数量并降低网络复杂性,剔除相关系数过低且不显著的值,仅选择总频次大于10的OTU用于网络分析[25]。随后,计算模块内连通度(Zi)和模块间连通度(Pi)并判别网络节点,依据节点拓扑特征将节点属性分为模块中心点(在模块内部具有高连通度的节点,Zi>2.5且Pi<0.62)、连接节点(在两个模块之间具有高连通度的节点,Zi<2.5且Pi>0.62)、网络中心点(在整个网络中具有高连通度的节点,Zi>2.5且Pi>0.62)和外围节点(在模块内部和模块之间均不具有高连通度的节点,Zi<2.5且Pi<0.62)4种类型[26]。其中,模块中心点、连接节点和网络中心点在模块间和各自的模块内起重要作用,是维持网络结构稳定性的关键节点,Zi≥2.5或Pi≥0.62的节点为关键菌种。最后,对樟子松人工林土壤真菌网络中介中心性前50的OTU与土壤理化性质进行Pearson相关性分析并用R“vegan”包进行Mantel分析。利用Gephi 0.9.2软件进行土壤真菌网络构建和网络平均聚类系数、平均路径长度、模块化和平均连通度等拓扑属性的可视化处理。
2 结果与分析
2.1 不同林龄和土层樟子松人工林土壤真菌拓扑性质
科尔沁沙地樟子松人工林和未造林地土壤真菌网络模块化、平均路径长和平均聚集系数均大于随机网络的相应数值,表明土壤真菌网络符合网络特征,可用于研究土壤真菌群落相互关系(表2)。不同林龄土壤真菌网络拓扑性质无显著差异(图2)。不同林龄土壤真菌网络模块数量分别为22、21和18,变化不明显。随樟子松林龄增加,土壤真菌网络平均连通度分别为44.803、72.836、43.076,平均聚类系数分别为1.852、1.886、1.8,平均路径长度分别为10.35、6.051、12.044,土壤真菌网络节点数、平均连通度、平均聚类系数和正相关占比先增后减,平均路径长则先减后增;相比之下,未造林地土壤真菌网络中的平均连通度略低于近熟林,平均路径长低于樟子松人工林,正相关占比高于人工林。说明随林龄增加,中龄林到近熟林阶段,网络愈加复杂,而近熟林到成熟林阶段则相反;与人工林相比,未造林地土壤真菌网络更复杂(图3,表2)。
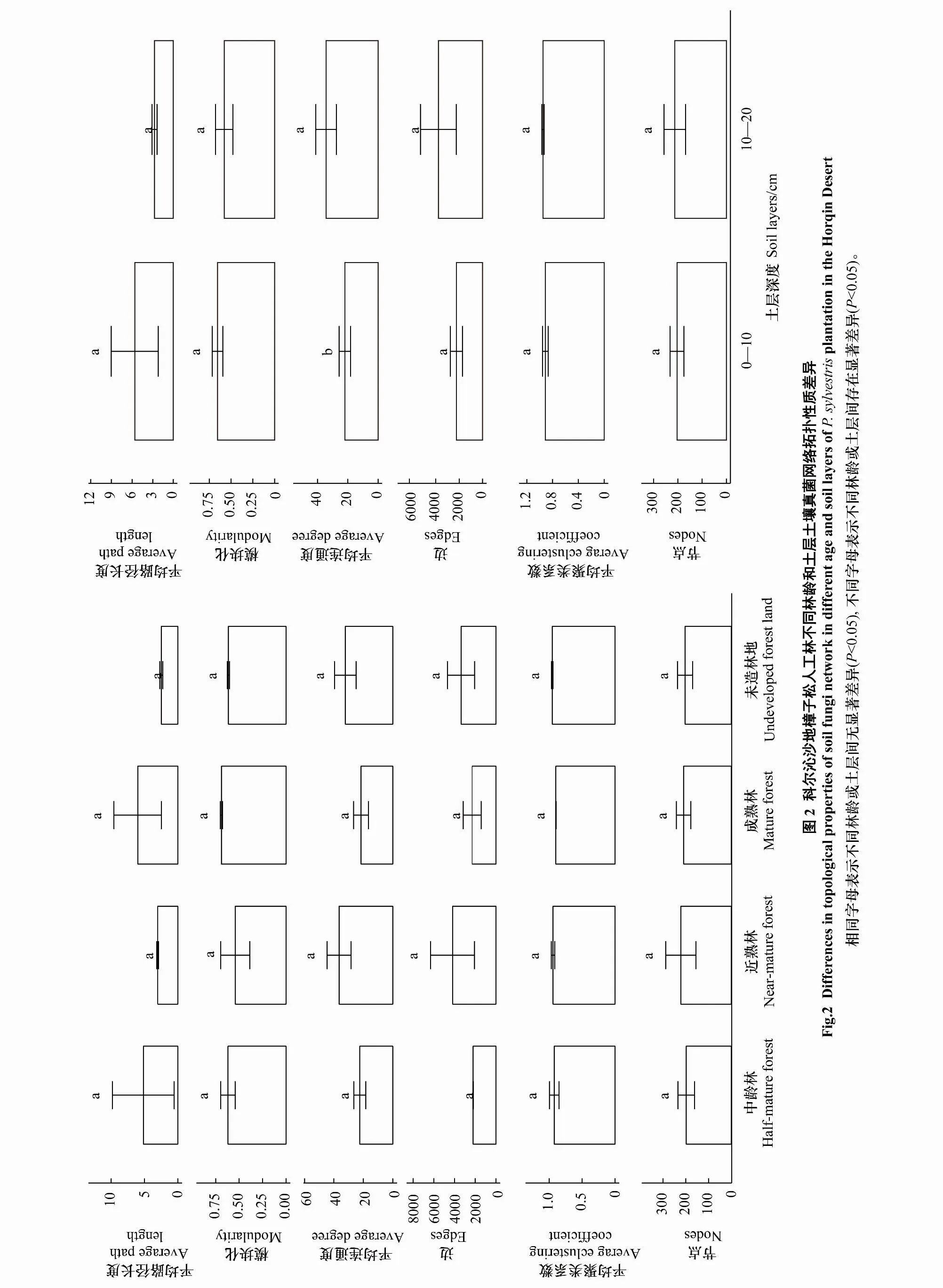
图3 科尔沁沙地樟子松人工林土壤真菌网络
在樟子松人工林中,不同土层间真菌网络平均连通度存在显著差异(图2)。上层土壤真菌平均路径长度分别为8.46、3.126和8.557,上层土壤真菌平均路径长度分别为1.89、2.925和3.487。10—20 cm土层土壤真菌平均路径长度小于0—10 cm土层,平均连通度和聚类系数大于0—10 cm土层,说明樟子松人工林土壤真菌间联系随土层增加而增加。在未造林地中,10—20 cm比0—10 cm土层土壤真菌网络边数、平均连通度和聚类系数更低,平均路径长度更高,说明未造林地土壤真菌间联系随土层增加而减少。此外,随土层深度增加,人工林和未造林地土壤真菌网络的负相关占比增加,但仍以正相关为主(图3;表3)。

表3 科尔沁沙地樟子松人工林土壤理化性质与酶活性
2.2 不同林龄和土层樟子松人工林土壤真菌的关键类群
樟子松人工林和未造林地土壤真菌网络关键OTU均属于连接节点,无模块中心点和网络中心点(图4)。不同林龄土壤真菌连接节点OTU数量波动较大,近熟林连接节点OTU数量最多(图5)。中龄林识别的关键菌种包括Guehomycessp.、木霉属真菌(Trichodermasp.)和未知菌,0—10和10—20 cm土层共有的关键菌种为Guehomycessp.,近熟林识别的关键菌种包括树粉孢属真菌(Oidiodendronsp.)、毛壳菌属真菌(Chaetomiumsp.)、被孢霉属真菌(Mortierellasp.)和未知菌,0—10和10—20 cm土层共有的关键菌种为树粉孢属真菌,成熟林识别的关键菌种包括Pseudeurotiumsp.和未知菌,0—10和10—20 cm土层共有的关键菌种为Pseudeurotiumsp.。相比之下,未造林地土壤真菌连接节点OTU数量低于中龄林和近熟林。在未造林地中识别的关键菌种包括Alphamycessp.和未知菌,0—10和10—20 cm土层共有的关键菌种为Alphamycessp.。

图4 科尔沁沙地樟子松人工林土壤真菌网络模块间和模块内连接性变化
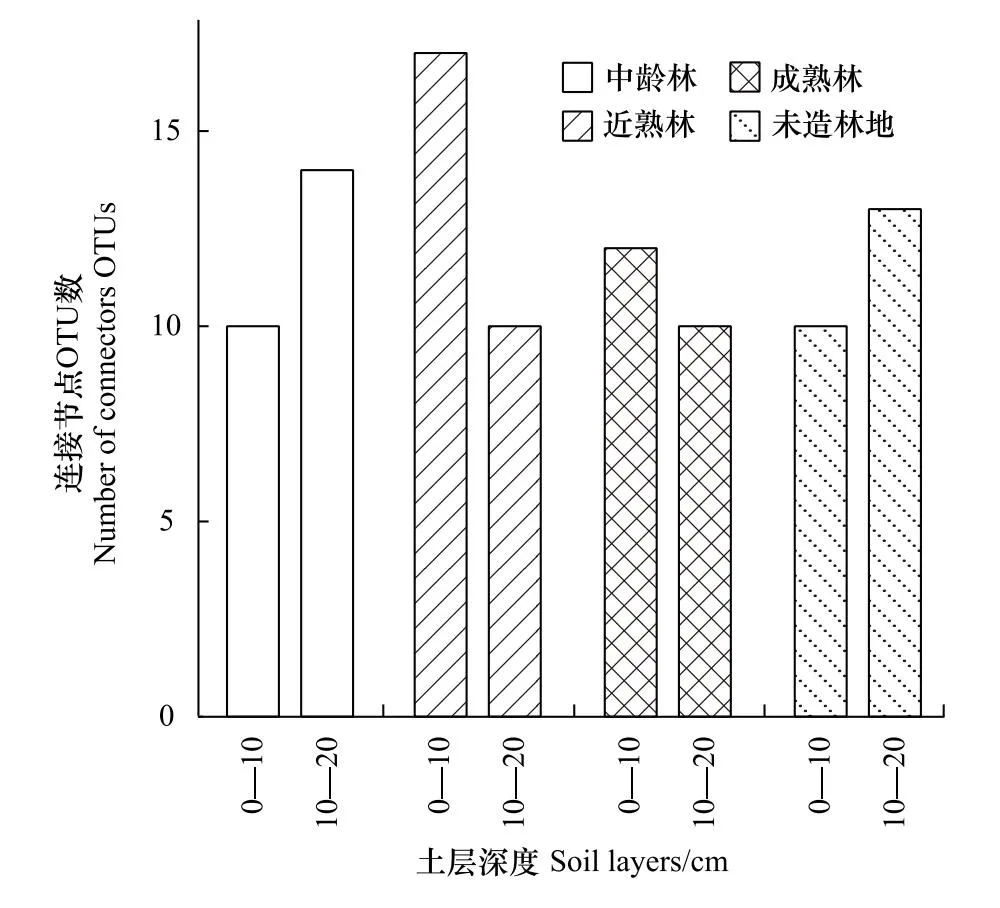
图5 连接节点OTU数
在樟子松人工林中,0—10 cm土层比10—20 cm土层连接节点OTU数量多(图4,图5)。其中,0—10 cm土层识别的关键菌种主要为格孢腔菌目(Pleosporales)的未鉴定真菌OTU470和OTU1084,10—20 cm土层识别的关键菌种主要是被孢霉属真菌(Mortierellasp.)。在未造林地中,与0—10 cm土层相比,10—20 cm土层连接节点OTU数量较多。0—10 cm土层中樟子松人工林和未造林地共有的关键菌种是红菇属(Russulasp.),10—20 cm土层中樟子松人工林和未造林地共有的关键菌种为Guehomycessp.。
2.3 樟子松人工林土壤真菌网络结构的土壤影响因素
在0—10 cm土层中,中龄林含水量显著高于成熟林(P<0.05);成熟林孔隙度和全氮含量显著低于其他林龄(P<0.05);近熟林脲酶活性显著高于其他林龄(P<0.05)。10—20 cm土层中,近熟林pH显著高于成熟林(P<0.05);成熟林全氮含量最低而硝态氮含量最高;成熟林有机质含量显著高于中龄林(P<0.05);近熟林过氧化氢酶含量显著高于中龄林(P<0.05);中龄林脲酶活性最低。未造林地土壤的速效磷含量显著高于人工林(P<0.05),过氧化氢酶含量显著低于人工林(P<0.05),且速效磷和过氧化氢酶含量与人工林存在显著差异(P<0.05)(表3)。
将土壤真菌与土壤因子进行Mantel检验发现(表4),土壤真菌网络与含水量呈显著相关(P<0.05)。土壤真菌网络中中介中心性前50的OTU与土壤理化性质关系表明(图6),土壤全氮较为关键,在网络中与更多的OTU呈显著负相关(P<0.05),包括被孢霉属真菌(Mortierellasp.)的OTU5、树粉孢属真菌(Oidiodendronsp.)OTU11和未鉴定真菌OTU130、OTU143、OTU21和OTU74呈显著负相关(P<0.05)。此外,土壤pH值和速效磷也影响真菌网络,与土壤真菌网络中部分OTU显著相关(P<0.05),土壤pH值与金孢霉属(Geomycessp.)的OTU12、Microdochiumsp.的OTU219、Phialocephalasp.的OTU431和未鉴定真菌OTU166呈显著正相关(P<0.05)。土壤速效磷与Dactylonectriasp.的OTU101、丝盖伞属(Inocybesp.)的OTU19、Trechisporasp.的OTU2和未鉴定真菌OTU835呈显著正相关(P<0.05)。

图6 科尔沁沙地樟子松人工林土壤真菌与土壤理化性质网络关系

表4 科尔沁沙地樟子松人工林土壤真菌网络与土壤因子Mantel检验
3 讨论
3.1 不同林龄和土层樟子松人工林土壤真菌的网络结构特征
不同林龄间,土壤真菌网络中的节点数波动变化不大,先前研究发现林龄对樟子松人工林土壤真菌多样性无显著影响[27],这证实了使用微生物网络分析在一定程度上具有可靠性。并且,网络分析还能通过多种拓扑网络特征进一步明确真菌群落结构,首先网络拓扑特征能描述群落中真菌间的互作关系,比如真菌的互利竞争关系。网络复杂性可以通过网络中相互作用的物种总数、节点度分布等进行分析。当拓扑特征无改变时,网络结构处于稳定状态,网络中相互作用的物种数多,物种更复杂的网络更容易保持群落稳定性[28—29]。随林龄增加,樟子松人工林土壤真菌网络平均连通度先增后减,中龄林到近熟林阶段真菌网络逐渐复杂,近熟林到成熟林阶段真菌网络愈加简单。研究表明,网络平均路径长度短,土壤真菌网络物种间信息传递的速率快[30],当环境变化时,真菌网络响应速度在中龄林到近熟林阶段逐渐加快,此时土壤真菌群落更易受到环境影响发生改变。这近熟林阶段,樟子松人工林林木生长量降低[31],土壤真菌网络通过频繁的能量流动和信息传递来减轻外界环境变化对其产生的影响。近熟林到成熟林阶段真菌网络不易受到环境变化影响,樟子松在近熟林到成熟林阶段,土壤微生物性质最佳,在近熟林到成熟林阶段根系分泌物及凋落物有所积累,为土壤真菌新陈代谢和自身合成提供了较多的能量来源[32]。
樟子松人工林土壤真菌网络平均路径长高于未造林地,近熟林平均连通度高于未造林地。近熟林土壤真菌网络中物种相互作用的复杂程度低高于未造林地。网络平均路径长更长,真菌间响应速度更慢,此时中龄林和成熟林真菌网络对外界环境变化反应更慢,不易受环境变化的干扰,群落稳定性更好[23]。中龄林和成熟林真菌群落较未造林地更简单且更不易受到环境变化的影响,这是因为樟子松是典型的外生菌根依赖型树种,可以通过多种方式招募对其生长有利的真菌,通过宿主效应对土壤真菌进行筛选和过滤,使樟子松人工林土壤真菌网络更简单[20]。
在樟子松人工林中,与0—10 cm土层相比,10—20 cm土层土壤真菌网络边数减少且其分布更为集中,真菌间接触产生联系的机会增多,这可能导致随土壤深度增加人工林真菌间联系更加紧密[33]。虽然随土壤深度增加,未造林地土壤真菌数量与人工林变化一致,但未造林地土壤真菌迁移速率低,真菌间接触并产生联系的机会变少,因此土层增加未造林地土壤真菌间联系减少[9]。在人工林和未造林地中,10—20 cm与0—10 cm土层相比,土壤孔隙度和土壤氧含量等减少,资源环境的限制导致真菌群落的相互作用由协作转变为竞争[34],因此土壤真菌网络负相关增多。
3.2 不同林龄和土层樟子松人工林土壤真菌网络关键菌种生态功能
先前研究基于真菌相对丰度数据划分优势菌种,广泛证实优势物种在群落中发挥一定的生态作用[4,7]。本研究利用OTU在网络中拓扑角色,识别对群落组成部分产生巨大影响的关键真菌[11],研究发现关键菌种能通过某种调节,对群落结构和功能产生影响,例如Pseudeurotiumsp.能通过产生抗真菌化合物,抑制病原微生物活性达到改变菌群的组成的效果[35—36]。不同林龄中土壤真菌网络关键菌种不同,因为在生长过程中,樟子松通过招募特定真菌,提高可利用养分的含量以满足快速生长的需求[12]。为保证分析变量的唯一性,仅取不同林龄樟子松人工林真菌0—10 cm和10—20 cm土层共有的OTU进行分析,其中中龄林0—10 cm和10—20 cm土层共有的关键菌种为Guehomycessp.,近熟林的关键菌种为树粉孢属真菌,成熟林的关键菌种为Pseudeurotiumsp.。中龄林关键菌种为Guehomycessp.,担子菌门的Guehomycessp.是一种促进植物生长的微生物,具有广泛的酶活性[37]。可能是因为中龄林处于快速生长阶段,Guehomycessp.真菌提高了土壤酶活性,在中龄林阶段脲酶和全氮含量都最高,且脲酶是促进氮转化的专一酶,土壤全氮含量升高对樟子松生长有一定促进作用[38]。近熟林关键菌种为树粉孢属真菌,子囊菌门的树粉孢属真菌为腐生营养型真菌,偏爱针叶林的酸性土壤,可以通过刺激木质素和纤维素降解并产生多种酶降解凋落物,增加碳和氮的有效性,从而提供植物必要的营养物质,有利于植物生长[39—40]。近熟林生长对土壤中可利用养分的需求量较大,树粉孢属真菌能为樟子松人工林的生长提供了良好的物质条件。此外,近熟林阶段,樟子松细根长度和面积最大,根系分泌有机物的能力最强,根系分泌物影响微生物的比例和群落结构[12,41]。成熟林关键菌种为子囊菌门的Pseudeurotiumsp.,它能产生抗真菌化合物并抑制病原微生物活性[35],从而促进植物健康生长,这是其作为关键菌种的原因。未造林地关键菌种为壶菌门(Chytridiomycota)的Alphamycessp.,其功能与产生纤维素酶并分解纤维素相关[42],从而导致养分归还能力增大,维持了未造林地肥力。研究发现,土壤微生物的定殖和群落建立受根系分泌物的数量和质量、土壤理化性质和气候条件等因素的影响[43]。与未造林地相比,樟子松人工林具有强大的根系[44],此外人工林土壤养分含量和土壤微生物量明显高于未造林地[45],这是导致樟子松人工林与未造林地土壤真菌具有差异的主要原因。
樟子松人工林0—10 cm土层土壤真菌关键菌种主要为格孢腔菌目的未鉴定真菌OTU470和OTU1084,10—20 cm土层主要是被孢霉属真菌。格孢腔菌目是根际土壤内真菌群落中的主要种群,能利用根系分泌的有机物实现快速生长[46],但其对樟子松的作用尚不明确。被孢霉菌是土壤有益微生物,能抑制致病菌,缓解土壤负面状态对土壤酶活性和植物生长的影响,能够提高土壤养分有效性[47—48]。一般情况下,10—20 cm土层土壤孔隙度和土壤氧含量等较0—10 cm土层土壤差,本研究中被孢霉菌的存在有效调节10—20 cm土层土壤状态对植物的影响,有利于樟子松生长。0—10 cm土层土壤中樟子松人工林和未造林地共有的关键菌种是红菇属真菌。研究发现,红菇属真菌是樟子松林内常见的外生菌根真菌[49],它能促进植物根系的生长和营养吸收,提高植物的抗逆性[50]。10—20 cm土层中樟子松人工林和未造林地共有的关键菌种是为Guehomycessp.。Guehomycessp.同时是中龄林关键菌种,其能提高土壤有效养分含量,有利于植物生长[51]。0—10 cm和10—20 cm土层中,人工林和未造林地关键菌种的差异可能是土层变化影响了土壤总孔隙度和氧含量,从而限制了微生物的生长,同时土壤理化性质在不同土层间存在差异,从而导致关键菌种的不同[9]。
3.3 土壤理化性质对土壤真菌网络的调控作用
土壤真菌网络与含水量存在显著相关性,植物在沙地中活动受水分条件的影响,土壤含水量的增加,利于植物生长。研究发现,土壤含水量较高的湿润环境对微生物的生理活动产生积极影响,并提高微生物同化的速率[52]。土壤水分条件的改善有利于土壤微生物活性增加,进而提高土壤微生物生物量[5]。采用生态网络分析可以明确点和点之间的关系,即某个真菌与某个土壤因子的关系,得到的结果具有代表性。网络分析更关注环境因子与各OTU之间的相关作用,这种方法只研究网络中处于重要地位的少数OTU,会忽略优势物种与环境因子的关系[53],但该不足并没有导致本研究结果与先前研究结果出现较大差异。科尔沁沙地樟子松人工林土壤真菌网络中介中心性前50的OTU受土壤全氮的显著影响,本研究结果与科尔沁沙地樟子松土壤环境因子对微生物群落的影响结果相似[54]。这是因为氮是表层土壤微生物互作的主要贡献因素,在氮含量低时,土壤真菌网络通过增强竞争作用满足自身的需求[29];氮含量增高时,土壤中氮对微生物的限制降低,微生物的相互作用更强烈,进而影响微生物网络结构的复杂程度[55]。土壤pH值与土壤真菌网络呈显著正相关。土壤pH是驱动微生物生长和群落结构的关键环境因子,pH降低会引起土壤微生物量的降低,同时能改变土壤微生物群落结构,使土壤微生物活性降低,网络复杂性降低[56—58]。土壤速效磷与土壤真菌网络呈显著正相关,这与旱地土壤微生物与环境因子网络的相互作用结果相似[59]。这是磷含量降低抑制了土壤真菌的生长,并减少了微生物种间相互作用或生态位共享[60];而增加磷含量真菌间的相互作用增多,网络复杂性和稳定性增强,对外界环境变化抵抗力增强[61]。
4 结论
(1)在科尔沁沙地樟子松人工林中,与中龄林和成熟林相比,近熟林土壤真菌群落更复杂,随土壤深度增加,樟子松人工林10—20 cm土层土壤真菌间联系比0—10 cm土层多,而未造林地则相反。与未造林地相比,中龄林和近熟林土壤真菌群落更稳定。
(2)科尔沁沙地不同林龄樟子松人工林土壤真菌网络关键菌种存在差异。其中,近熟林中关键菌种较多,未造林地关键菌种数低于人工林。在不同土层中,樟子松人工林和未造林地0—10 cm土层土壤真菌网络关键菌种比10—20 cm土层多;人工林关键菌种主要包括Guehomycessp.、Oidiodendronsp.、Pseudeurotiumsp.和被孢霉属真菌等,未造林地关键菌种为Alphamycessp.。
(3)科尔沁沙地樟子松人工林土壤真菌网络组成与土壤含水量显著相关。中介中心性前50的OTU受土壤理化性质影响,土壤全氮的影响最为显著,其次是土壤pH和速效磷。

