不同发育阶段日本落叶松人工林枯落物层微生物群落特征*
牛小云,孙晓梅,陈东升,张守攻
(1. 中国林业科学研究院林业研究所国家林业和草原局林木培育重点实验室,北京 100091;2. 河北农业大学园林与旅游学院,河北保定071000)
落叶松是我国北方重要的速生用材林树种,大面积种植落叶松人工纯林存在潜在的地力衰退[1-4],尤其是在中龄林与近熟林阶段[1,5]。落叶松凋落物积累与分解的不平衡是导致地力衰退以及土壤酸化的主要原因[1,3-4],落叶松人工林每年以凋落物形式归还的养分占其年吸收量的61.4%,而从凋落物转移至土壤中的养分仅占养分归还量的36.0%,占林地凋落物层元素积累量的4.9%。微生物在枯落物分解过程中发挥着重要作用[6],是土壤养分转化和循环的主要驱动力[7-8],微生物对三江平原湿地枯落物分解的贡献量可高达52%~78%[9]。微生物的种类和数量影响枯落物的分解速率[10-11],而枯落物的质量对微生物的生物量、多样性也有重要影响[12-13],尤其是真菌群落[12],这进一步影响了枯落物的分解速率。伴随日本落叶松林分发育以及抚育管理,林分郁闭度与林下植被发生变化[5],这将如何影响枯落物的质量以及微生物群落结构,此方面的相关研究还较少,阻碍了对日本落叶松在中龄林与近熟林阶段地力衰退机制的进一步探索。
本文以辽东山区日本落叶松人工林为研究对象,分析不同发育阶段林分未分解层、半分解层以及全分解层枯落物中微生物群落结构特征及其与枯落物理化性质的相互作用关系,揭示日本落叶松在中龄林或近熟林阶段地力衰退的微生物学作用机制,旨在为缓解日本落叶松地力衰退提出合理的经营措施。
1 材料与方法
1.1 研究区概况
研究区位于辽宁省抚顺市大孤家林场(125°48′41″E,52°45′21″N),该区属长白山系千山山脉龙岗支脉北坡,中温带季风气候,年均气温 6 ℃,最低气温-30℃,最高气温34 ℃,全年无霜期128 d,年均降水量 650 mm。林地土壤为暗棕色森林土,土层厚 50 cm,pH 6.2~6.8,枯枝落叶层厚3.5~6 cm,pH 4.8~5.6。
1.2 研究方法
2009年在全面踏查此地区的落叶松人工林的基础上,本着土壤类型、立地条件一致的原则,在幼龄林林分(Y,11 a)、中龄林林分(Z,20 a)、近熟林林分(J,34 a)与成熟林林分(C,47 a)分别选择9个样地,共计36个样地作为实验样地。36个样地的林分初值密度均为4 444株·hm-2,后经抚育间伐管理。2013年样地概况如表1、表2所示。
1.3 样品采集与分析
于2013年10月在4个不同发育阶段林分内分别随机选择3个样地,共计12块,样地面积均为0.08 hm2(28.3 m×28.3 m)。按梅花型取样方法选择5个样点,每个样点设置0.5 m ×0.5 m 小样方,分别对样方内未分解层(W)、半分解层(B)和全分解层枯落物(Q)取样。取样分层标准[14]:未分解层位于枯落物的表层,形成时间小于 1年,未分解、未压缩成块状;半分解层已开始分解,但叶片形状尚完整,未压缩成块状;全分解层叶片形状已不完整或已不能辨认,通常压缩成块状,紧挨表土层。每个小样方每层取3份样品,分别用作含水量、pH、养分含量以及微生物群落结构测定。用于群落结构测定的样品用冰盒保存带回实验室,置于-80℃冰箱中待用。
样品采集后立即测定其鲜质量,带回实验室80 ℃烘干至恒重,测定其干质量,计算含水量及枯落物层贮量。2 g风干材料在研钵中加入液氮研磨成粉末后加入到盛有40 mL超纯水三角瓶中,震荡30 min再静置30 min后,吸取上清液,用电子pH 计测定pH。研磨后的枯落物,过10目筛用于速效养分测定,过100目筛用于全量养分测定。枯落物有机碳(LOC)采用硫酸消煮—重铬酸钾外加热法;全氮(TN)采用硫酸消煮—凯氏定氮;碱解氮(AN)采用碱解扩散法;全磷(TP)采用硫酸消煮—钼锑抗比色法;有效磷(AP)采用NaHCO3浸提—钼锑抗比色法;全钾(TK)采用磷酸消煮—原子吸收分光光度计法;速效钾(AK)采用醋酸铵浸提—原子吸收分光光度计法;交换性钙离子(Ca2+)、交换性镁离子(Mg2+)采用醋酸铵交换法。具体测定方法参照《中华人民共和国林业行业标准方法》[15]。
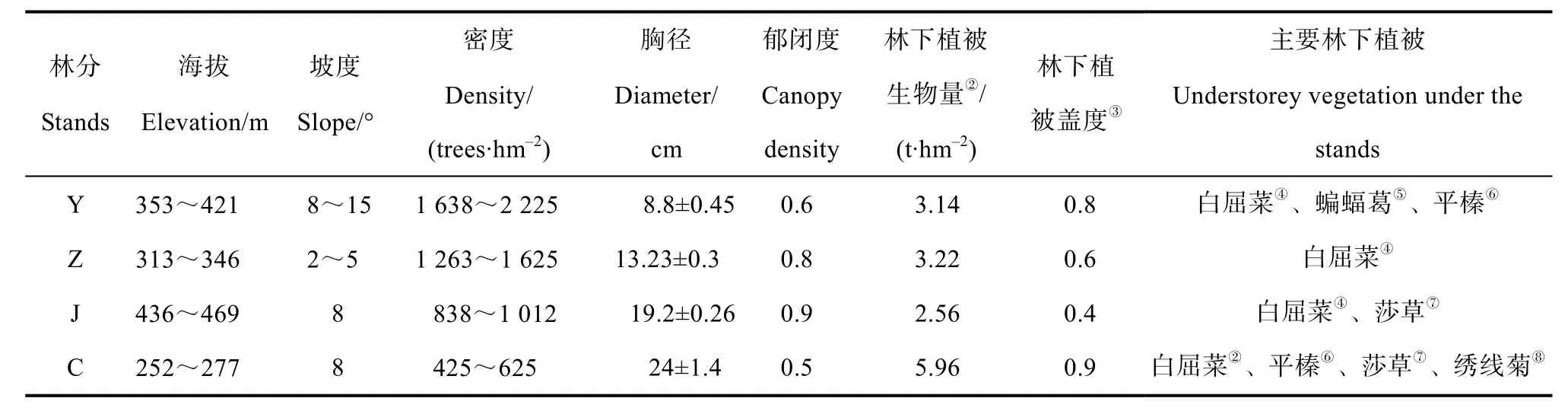
表1 研究样地概况①Table 1 General situation of the sample sites for the research
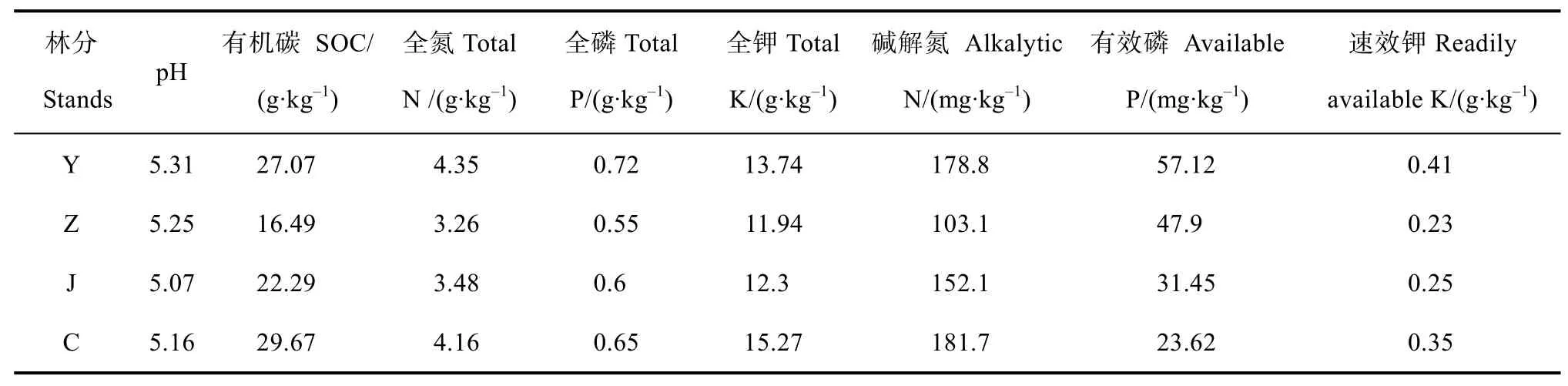
表2 不同发育阶段日本落叶松林分表层土壤化学性质Table 2 Chemical properties of topsoil relative to stand different development stagein the Larix kaempferi plantation
1.4 枯落物层微生物群落结构测定
DNA提取:采用MoBioPowersoil DNA 提取试剂盒(Mo Bio,CA,USA),按照说明书提取,通过琼脂糖电泳以及Nanodrop8000检测DNA质量与浓度。
微生物数量测定:采用实时荧光定量PCR技术(qPCR)分别扩增细菌16SrDNA,真菌18SrDNA的基因拷贝数[16-17]。分别用真菌特异性引物FF390/FR1、细菌特异性引物338f/518r[5],扩增样品DNA,PCR产物纯化后克隆到PMD19-T载体中,将阳性克隆子扩增培养后提取质粒 DNA,将已知拷贝数的质粒稀释10-1、10-2、10-3、10-4、10-5、10-6、10-7,作为标准曲线的DNA模板。荧光定量PCR采用20 μL反应体系:2 μL稀释模板(细菌稀释100倍,真菌稀释10倍)或者2 μL质粒DNA,10 μmol·L-1上下游引物各0.4 μL,BSA 0.5 μL(20 mg·mL-1),SYBRⅡ10.0 μL,RoxdyeⅡ0.4 μL,灭菌水补足至20 μL。qPCR运行程序分别为:细菌95 ℃,2 min;(95 ℃,5 s;60 ℃,35 s;) 28 cycles。真菌95 ℃,2 min;(95 ℃,40 s;55 ℃,40 s;72 ℃,40 s)30 cycles。每个样品做3个重复,每次试验同时做阴性对照(NC)、标准曲线与溶解曲线。溶解曲线呈单峰说明扩增引物特异性强,16S rDNA标准曲线为Ct=-3.287 lgCt+37.26(R2=0.997,EFF%=101.5);18S rDNA标准曲线为Ct=-3.236lgCt+36.92(R2=0.998,EFF%= 103.724)。真菌与细菌的标准曲线相关系数r与扩增效率EFF均符合要求。以上所用试剂均购自Takara公司。
微生物群落多样性测定:采用PCR扩增与末端限制性酶切片段长度多态性技术(T-RFLP)相结合的方法。分别用特异性引物27F/1492r、ITS1/ITS4对细菌 16S rDNA和真菌ITS rDNA进行PCR扩增,并在上游引物的正向标记荧光物质(FAM)[5,18-19]。25 μL反应体系:Extaq 0.2 μL (5 U·μL-1),10×Exbuffer 2.5 μL,dNTPmix 2.0 μL (各2.5 mmol·L-1),模版1 μL,10 μmol·L-1上下游引物各1 μL,BSA 0.5 μL (20 mg·mL-1),灭菌水补足至25 μL。PCR运行程序分别为:细菌:94 ℃,30 s;(94 ℃,30 s;54 ℃,30 s;72 ℃,90 s) 24 cycles;72 ℃,10 min。真菌:95 ℃,2 min;(95 ℃,30 s;55 ℃,30 s;72 ℃,45 s) 30 cycles。每个样品取300 ng纯化的PCR产物,分别用限制性内切酶MSPⅠ、HinfⅠ及HaeⅢ(Takara)按照说明书步骤对真菌ITS PCR产物、细菌16S rDNA PCR产物进行酶切。酶切产物脱盐后,经 1.2% 琼脂糖凝胶电泳检测,MSPⅠ对细菌、HinfⅠ对真菌PCR产物酶切效果较好,送北京睿博兴科生物技术有限公司进行基因扫描,真菌使用GS500内标,细菌使用GS1200Liz内标。扫描结果用GeneMarker V2.0进行统计分析,剔除小于50 bp和大于500 bp(细菌大于1 000 bp)的片段,以及荧光强度小于100 单位的峰。将1 bp以内的片段(T-RFs)进行合并,不同长度的T-RFs代表不同种微生物。以不同长度的T-RFs片段的峰面积占总峰面积的百分数来表征不同微生物类群的相对数量。
1.5 数据处理
微生物群落多样性指数按如下公式进行计算:

多样性指数采用 Shannon-Weinner指数(H'):

均匀度指数采用Pielou指数(E):

式中,Pi为第i个物种的个体数(Ni)占总数的(N)的比值。
本研究中数据均用均值±标准差表示,采用Spss V19.0软件进行双因素方差分析,经Shapiro-Wilk检验,数据符合正态分布的,采用LSD进行多重比较,否则采用Kruskal-Wallis进行非参数检验,P<0.05 差异显著。主成分分析(PCA)分析不同发育阶段段林分枯落物层微生物群落结构的差异性;冗余分析(RDA)分析不同发育阶段林分枯落物层微生物群落结构与环境变量的关系。冗余分析(RDA)与主成分分析(PCA)均在CanocoV4.5软件中运行。
2 结 果
2.1 枯落物理化性质及养分贮量
枯落物中碱解氮与全磷含量在中龄林与近熟林最低;有机碳、速效钾浓度以及pH不受林龄影响,在未分解层显著高于其他分解层。全氮、有效磷、全钾浓度以及C/N受林龄与分解层的共同影响,全氮与有效磷浓度在幼龄林与中林龄较高,在成熟林较低,在未、半分解层较高,在全分解层较低,而全钾浓度呈相反趋势;C/N在幼龄林最高,在半分解层最低(表3)。枯落物总储量以及养分总储量均在近熟林最高。幼龄林、中龄林及近熟林枯落物储量与养分贮量主要集中在半分解层,成熟林养分主要集中在全分解层(表4)。
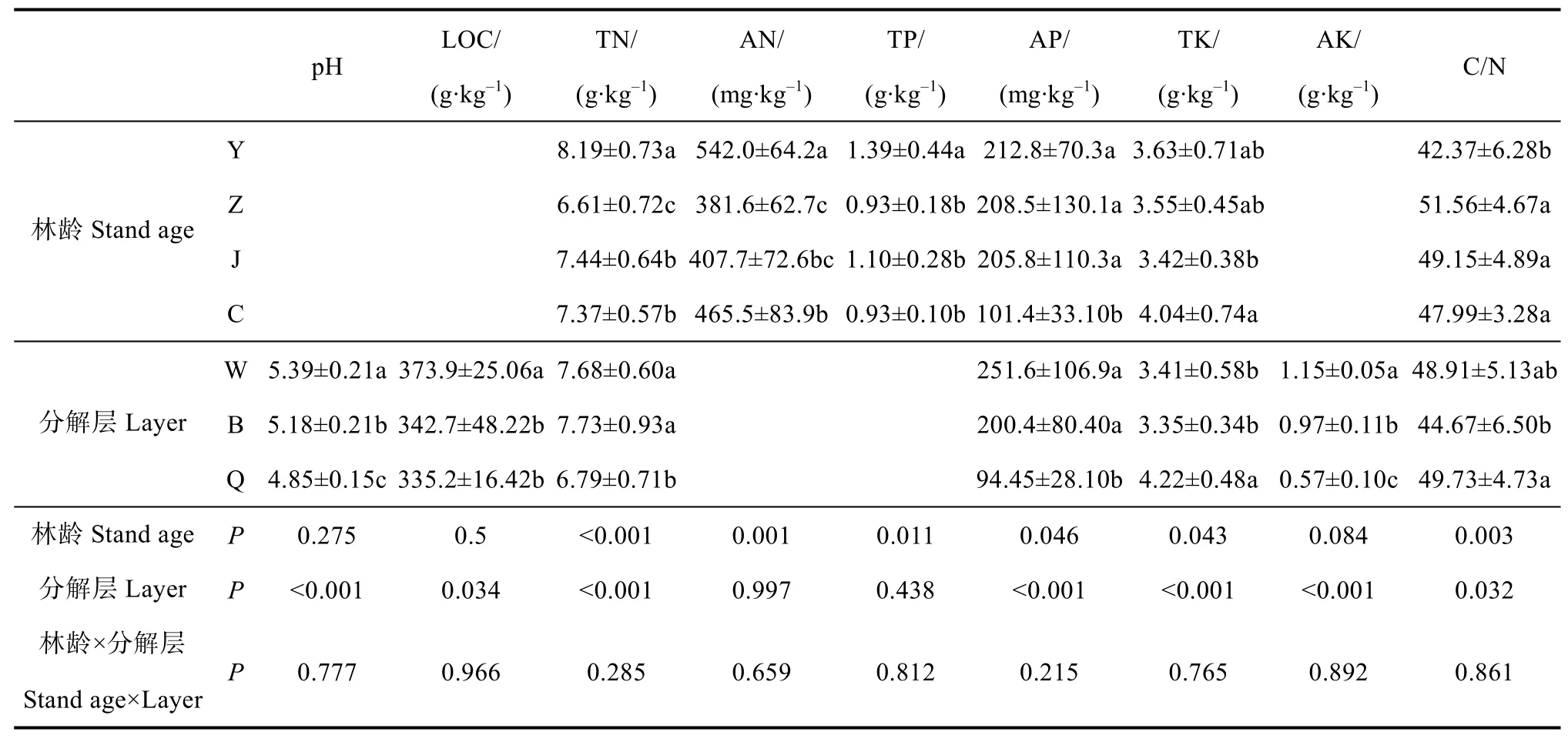
表3 不同发育阶段林分枯落物层理化性质Table 3 Physico-chemical properties of the litter relative to stand different in development stage
2.2 微生物群落结构
单位质量枯落物细菌与真菌基因拷贝数随林龄增大在不同枯落物层总体呈“V”形趋势。细菌在幼龄林最高,近熟林最低,成熟林阶段又有所上升,其中半分解层细菌基因拷贝数在不同发育阶段林分中均最高 (图1a)。真菌基因拷贝数在中龄林或近熟林较低,在成熟林与幼龄林较高,其中未分解层真菌基因拷贝数在不同发育阶段林分中均最高(图1b)。
基于T-RFLP测定数据分析不同发育阶段林分微生物群落结构多样性指数(表5)与微生物群落结构差异(图2)。总体而言,不同发育阶段林分细菌与真菌半、全分解层丰富度指数与多样性指数在近熟林或中龄林最高,在幼龄林最低,而均匀度指数在近熟林最低。丰富度指数与多样性指数在幼龄林与成熟林随枯落物分解程度增加而减小,在中龄林与近熟林呈相反趋势,而均匀度指数在幼龄林、中龄林与成熟林随枯落物分解程度增加而增加。微生物群落在PCA图中的分布可以看出,不同发育阶段林分全分解层细菌群落较相似,真菌群落差异较大。中龄林与成熟林未分解、半分解层细菌群落结构相似;幼龄林未分解、半分解层与近熟林未分解层细菌群落结构相似;幼龄林、中龄林未分解、半分解层以及近熟林未分解层真菌群落结构相似。近熟林半分解层的真菌与细菌与其他林龄分布距离较远,表明近熟林半分解层真菌与细菌群落结构存在特异性。
2.3 优势微生物种群

?
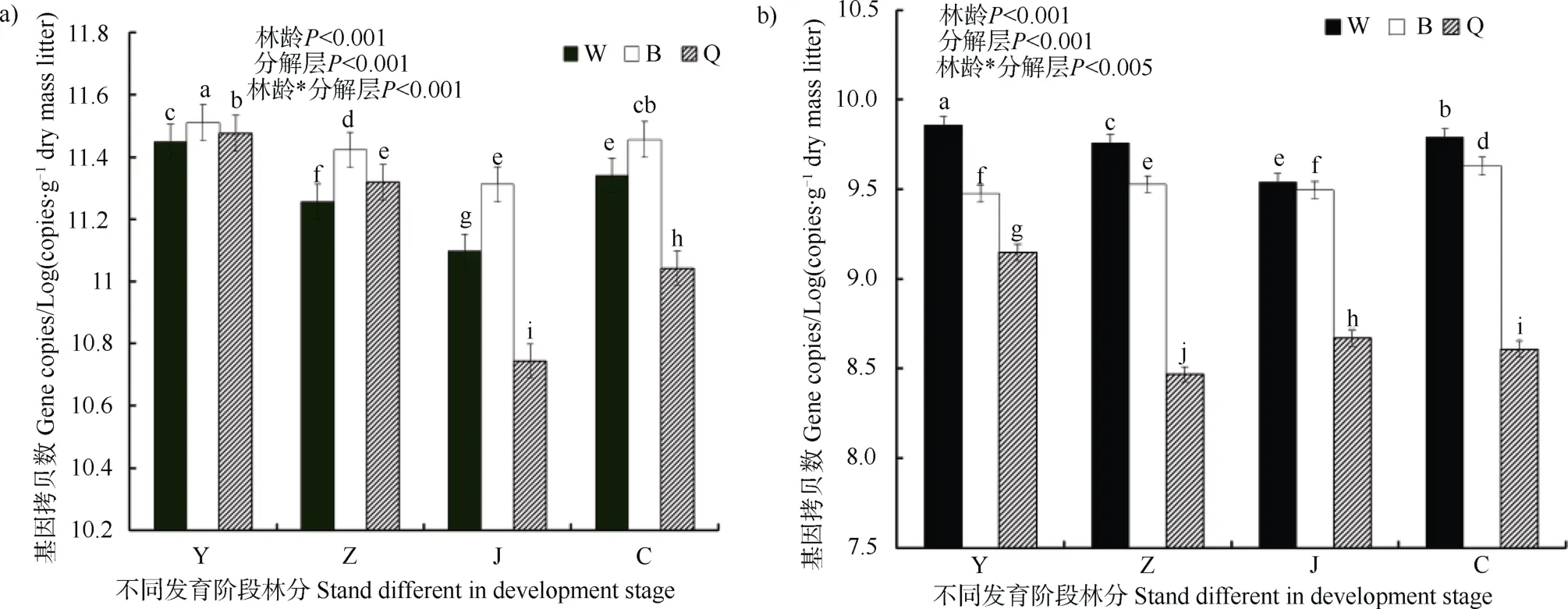
图1 不同发育阶段林分单位质量枯落物细菌(a)与真菌(b)基因拷贝数Fig. 1 Bacterial (a) and fungal (b) gene copies relative to stand different in development stage

表5 不同发育阶段林分微生物群落多样性指数Table 5 Microbial community diversity index relative to stand different in development stage
对相对含量大于3%的优势菌进行分析,不同处理中优势菌相对含量总值基本均大于60%,因此可以反映微生物群落结构信息。不同发育阶段林分枯落物层优势细菌种类基本相同(图3),相对含量不同,而优势真菌种类及相对含量明显不同(图4)。细菌T-RF145、147、435及533在不同发育阶段林分枯落物各分解层均为优势菌,相对含量受林龄以及分解层的共同影响。总体上T-RF 145、435及533在幼龄林随分解程度增加相对含量呈显著增加趋势;T-RF 145、147与533在近熟林与成熟林随分解程度增加相对含量呈显著降低趋势;T-RF147与435在中龄林半分解层相对含量最高。真菌T-RF 260在除幼龄林及近熟林的全分解层外的其他枯落物层均为优势菌株,但在近熟林未、半分解层相对含量显著低于其他3个林龄,随分解程度增加相对含量逐渐降低。T-RF 306主要分布在中龄林、近熟林与成熟林,并且在半分解层相对含量较高。T-RF 50、277及276分布在幼龄林、中龄林与成熟林的未分解或半分解层,在近熟林中没有分布。T-RF 201、346、349、359及459仅在近熟林未分解、半分解层为优势菌。T-RF 240在幼龄林全分解层占绝对优势,T-RF 239与245在中龄林与成熟林全分解层占绝对优势,T-RF 303与315在近熟林全分解层占绝对优势。大于3%的优势真菌种类在近熟林未分解层最多,在半分解、全分解层则最少。

图2 微生物群落结构PCA分析Fig. 2 PCA analysis of the soil microbial community

图3 不同发育阶段林分枯落物层优势细菌T-RFLP分析Fig. 3 T-RFLP analysis of the dominant bacteria in the litter relative to stand different in development stage
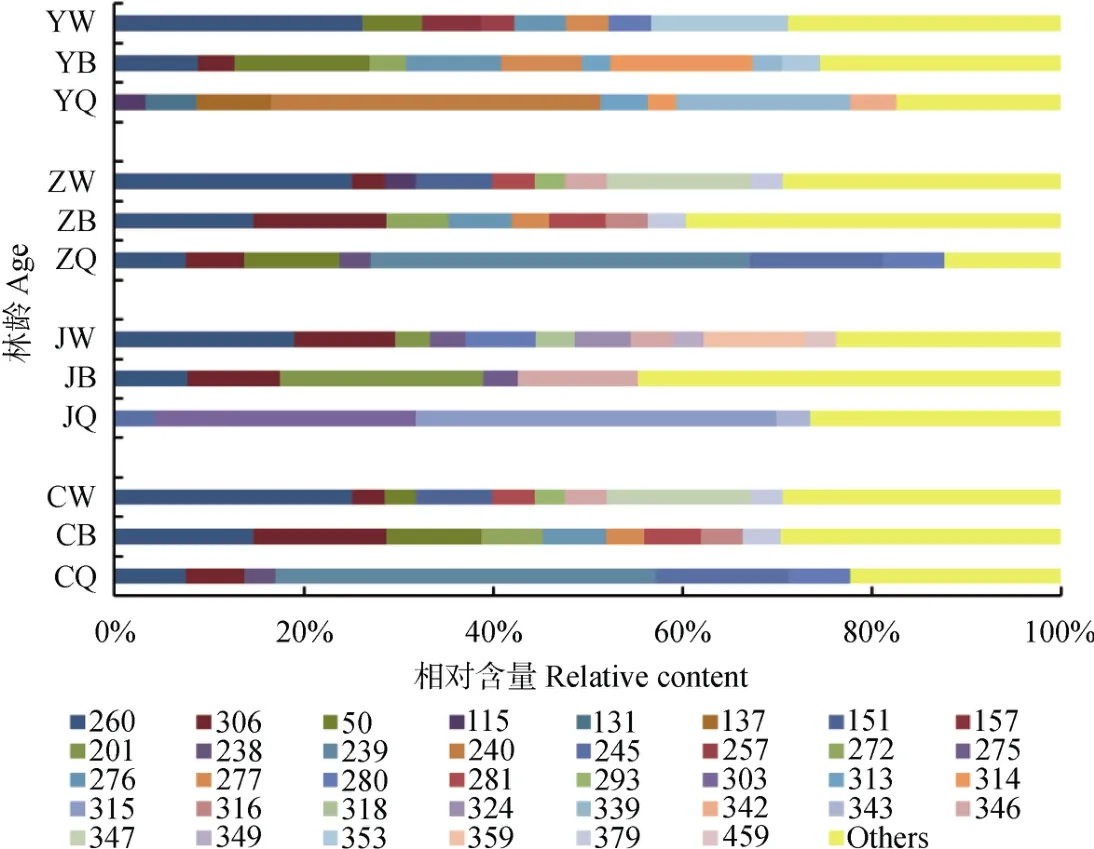
图4 不同发育阶段林分枯落物层优势真菌T-RFLP分析Fig. 4 T-RFLP analysis of the dominant fungi in the litter relative to stand different in development stage
2.4 微生物群落与环境因素的相关性
微生物群落在RDA图中的分布受林龄与分解层的共同影响(图5),未分解、半分解层分布在第二、三象限,其中幼龄林与成熟林分布在第二象限,微生物群落主要受全氮、全磷以及C/N影响;中龄林与近熟林分布在第三象限,微生物群落主要受pH、有效磷、林下植被生物量、碱解氮、速效钾、全钾以及C/N影响。全分解层分布在第一、四象限,幼龄林与中龄林分布在第一与第四象限相接处,微生物群落主要受全钾、C/N与枯落物含水率正影响;近熟林分布在第一象限,微生物群落主要受枯落物含水率影响;成熟林分布在第四象限,微生物群落主要受C/N与全钾影响。
环境因素对真菌与细菌群落结构多样性的影响存在较大差异,全磷、枯落物含水率以及全钾对细菌群落结构多样性影响较大;有效磷、林下植被生物量、pH、碱解氮、有机碳以及速效钾对真菌群落结构多样性影响较大。
3 讨 论
3.1 微生物群落结构对不同发育阶段林分枯落物分解差异的解释
微生物是枯落物重要的分解者,可以作为枯落物分解的指示特征[20-21],微生物数量与枯落物分解速率呈显著正相关[11]。在本研究中近熟林或中龄林单位质量枯落物细菌与真菌基因拷贝数最低,近熟林阶段枯落物层微生物群落结构也与其他发育阶段明显不同。这可能是近熟林阶段枯落物分解速率下降,枯落物储量以及养分储量在近熟林阶段最高的主要原因。近熟林阶段优势菌种类与其他发育阶段林分明显不同,尤其是优势真菌的种类,比如优势真菌T-RF 50、277以及276在幼龄林、中龄林以及成熟林中均为优势真菌,而在近熟林中不是。T-RF 201、346、349、359及459仅在近熟林未分解、半分解层为优势真菌。这可能是由于不同林龄林分环境的差异导致[22],与对长白山区不同林分类型以及不同发育阶段林分真菌与细菌群落结构研究的结论相同[23]。近熟林阶段复杂的林分环境为微生物提供了更多的生态位,微生物群落丰富度指数与多样性指数较高,但不利的环境条件如枯落物层较高的C/N,较贫瘠的表层土壤中以及高郁闭度的林分环境,导致一部分优势菌相对含量显著下降,甚至下降为非优势菌,因此均匀度指数降低。这与本研究优势真菌种类在近熟林半、全分解层最少的结果相一致,因此推测优势菌在不同发育阶段林分枯落物分解中发挥着重要作用。
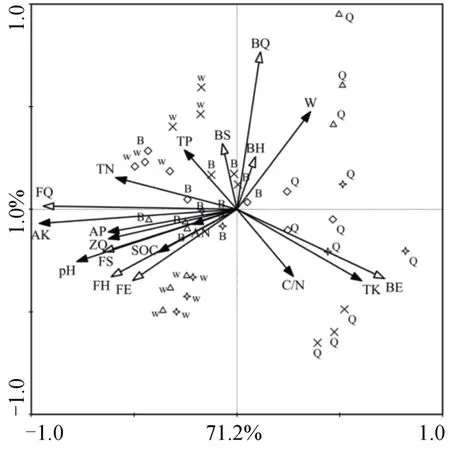
图5 微生物群落与环境的RDA分析Fig.5 RDA analysis of microbial and environment factors
3.2 微生物群落结构对不同分解层枯落物分解差异的解释
PCA分析表明未分解、半分解层微生物群落结构与全分解层明显不同,这主要是由于随分解进行微生物群落结构发生改变,在分解前期R-对策的微生物占优势,在分解后期K-对策的微生物占优势[24],这可能是导致不同分解层枯落物分解差异的主要原因。随分解进行易分解的物质越来越少,木质素等难分解的顽拗物质不断增加,能够分解这类物质的微生物越来越少[25],因此真菌基因拷贝数降低,这与以往的研究枯落物前期分解快、后期分解慢的结论一致[26-27]。在本研究中真菌群落结构受环境因素的影响大于细菌群落结构,真菌是降解凋落物的先锋物种,改变凋落物的结构及其化学组成,软化植物残体,为细菌定殖创造条件[28]。细菌基因拷贝数在半分解层最高,这也主要是由于半分解层凋落物经过前期真菌的分解,其自身的理化性质发生很大的变化,具有孔隙多、表面张力大、吸水面大、油脂含量减少等特点,使其更适宜细菌生存繁殖[29-30]。此外,以往的研究也表明枯落物层的分解酶主要来源于真菌[31],因此真菌群落结构在不同分解层枯落物分解中发挥着重要作用,调控真菌群落结构对枯落物分解至关重要。
3.3 林分环境对不同发育阶段林分枯落物分解差异的解释
中龄林与近熟林未、半分解层微生物群落结构受环境因素的影响一致,而幼龄林则与成熟林相同。这表明从中龄林阶段林分环境(枯落物层理化性质以及林下植被)已经开始朝不利于微生物生存的方向发展,到近熟林阶段达到顶峰,从成熟林阶段开始林分环境则有所改善,逐渐趋近于幼龄林。中龄林与近熟林枯落物中微生物较幼龄林与成熟林受更多的环境因素影响,养分含量、林下植被生物量以及pH基本在中龄林或近熟林最低,而C/N最高,这些都反映出近熟林与中龄林阶段枯落物质量低[32]。在中龄林和近熟林阶段林下植被生物量已成为影响微生物群落结构的关键因素。因此,改善林下植被对枯落物层的理化性质及微生物群落结构均有有利的影响[33]。本研究也证实当林分进入成熟林阶段后,由于林分密度、郁闭度降低,林下植被生物量增大,易分解的草本植物以及阔叶灌木枯落物大量归还到地表,枯落物层理化性质得到改善,微生物数量呈上升趋势,这与以前的研究认为成熟林阶段地力有一定改善的结论相一致[5,34]。盛炜彤等[33,35]对杉木研究表明当林分郁闭度在0.7以下时,林下植被才能很好地发育,且能促进土壤中微生物繁殖。因此有必要对中龄林以及近熟林阶段林分进行合理的经营管理(修枝和间伐),促进林下植被发育,改善枯落物层理化性质,从而提高枯落物分解,加速养分循环;或者适当延长日本落叶松的主伐年龄,通过林分的自然稀疏等措施对林分环境进行调节。
4 结 论
微生物群落结构的变化导致了中龄林与近熟林阶段枯落物分解慢,地力衰退。近熟林阶段林分半分解层枯落物真菌与细菌的群落结构、优势微生物种类与其他发育阶段林分明显不同,尤其是真菌;真菌与细菌数量也在中龄林或近熟林枯落物层最低。中龄林或近熟林枯落物层微生物受环境因素影响较大,林下植被生物量成为影响微生物群落结构特征的主要因子。因此,加强对日本落叶松人工纯林中龄林与近熟林阶段的密度管理,促进林下植被发育,改善枯落物性质,可以提高微生物活性,加速养分循环,缓解地力衰退。

