血清ZO-1、aβ2-GP水平与脑梗死患者梗死病灶范围及颈动脉粥样硬化程度的相关性*
李 盼,康丽娟,刘芳芳
1.保定市第一中心医院神经内科,河北保定 071000;2.保定市第一医院神经内科,河北保定 071000
脑梗死作为一种常见的脑血管疾病,其发病原因众多,主要是由于脑部血液循环供应障碍,而且无侧肢血管循环代偿造成脑部组织细胞出现缺血和缺氧死亡,致使机体神经功能缺损[1-2]。前期研究证实,脑梗死的发生与机体凝血功能和脑部血液微环境有着较为密切的关系[3-4]。抗β2糖蛋白1抗体(aβ2-GP1)作为一种与机体磷脂凝血相关的因子,其与血栓发生有关,闭锁小带蛋白1(ZO-1)是维持细胞组织连接性的相关蛋白,其与机体血脑屏障完整性有关,但是二者与脑梗死患者梗死病灶范围及颈动脉粥样硬化程度的相关性还未有明确研究[5-6]。本研究对脑梗死患者血清ZO-1和aβ2-GP1水平与脑梗死患者梗死病灶范围及颈动脉粥样硬化程度的相关性进行分析探讨。
1 资料与方法
1.1一般资料 选择2020年1月至2023年1月于保定市第一中心医院进行治疗的脑梗死患者103例作为研究组,其中男58例,女45例;年龄30~73岁,平均(61.28±4.92)岁;平均体重指数(BMI)为(23.01±1.54)kg/m2;合并高血压30例,合并糖尿病34例,有吸烟史(连续吸烟6个月,每日≥1支)38例,有饮酒史(1年内每周饮酒酒精量≥8 g)41例;文化程度中学及以上41例,小学62例。另选取同期于该院进行健康体检的体检健康者51例作为对照组,其中男28例,女23例;年龄(34~75)岁,平均(63.29±4.08)岁;平均BMI为(23.45±1.98)kg/m2;合并高血压16例,合并糖尿病19例,有吸烟史17例,有饮酒史19例;文化程度中学及以上23例,小学28例。两组性别、年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
纳入标准:(1)脑梗死患者经头颅MRI和CT证实确诊为脑梗死;(2)所有受试者及其家属均知晓并同意此项研究。排除标准:(1)临床资料不全;(2)1个月内服用过抗凝药物;(3)存在免疫、血液疾病或代谢紊乱;(4)存在严重肝肾功能不全;(5)存在严重并发症或恶性肿瘤。本研究经过医院伦理委员会审核批准(J20191221)。
1.2方法
1.2.1检测方法 收集所有受试者空腹静脉血5 mL,离心10 min收集血清置于-80 ℃冰箱中待用(离心速度3 000 r/min,离心半径10 cm)。应用酶联免疫吸附试验对血清中ZO-1和aβ2-GP1水平进行检测,其中ZO-1试剂盒购自卡迈舒生物科技有限公司,aβ2-GP1试剂盒购自德国欧蒙医学实验诊断股份公司。所有操作均按照试剂盒说明书进行。
1.2.2分组 依据梗死病灶范围大小对研究组患者进行分组[7],其中病灶>50 cm2归为大梗死组,病灶在10~50 cm2归为中梗死组,病灶<10 cm2归为小梗死组;依据颈动脉彩超结果将研究组患者分为斑块期组、增厚期组、管壁正常组。
1.2.3观察指标 (1)比较对照组和研究组血清ZO-1和aβ2-GP1水平;(2)比较不同梗死病灶范围脑梗死患者血清ZO-1和aβ2-GP1水平;(3)比较不同程度颈动脉粥样硬化脑梗死患者血清ZO-1和aβ2-GP1水平;(4)分析脑梗死患者血清ZO-1和aβ2-GP1水平与梗死病灶范围及颈动脉粥样硬化程度的相关性。
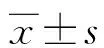
2 结 果
2.1研究组和对照组血清ZO-1和aβ2-GP1水平比较 研究组血清ZO-1水平低于对照组,血清aβ2-GP1水平高于对照组(P<0.05)。见表1。
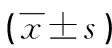
表1 研究组和对照组血清ZO-1和aβ2-GP1水平比较
2.2不同梗死病灶范围脑梗死患者ZO-1和aβ2-GP1水平比较 在103例脑梗死患者中,有32例患者为大梗死(大梗死组),34例患者为中梗死(中梗死组),37例患者为小梗死(小梗死组)。其中小梗死组ZO-1水平高于中梗死组和大梗死组,aβ2-GP1水平低于中梗死组和大梗死组;中梗死组ZO-1水平高于大梗死组(P<0.05),aβ2-GP1水平低于大梗死组(P<0.05)。见表2。
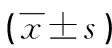
表2 不同梗死病灶范围脑梗死患者ZO-1和aβ2-GP1水平比较
2.3不同程度颈动脉粥样硬化脑梗死患者血清ZO-1和aβ2-GP1水平比较 在103例脑梗死患者中,29例患者颈动脉处于斑块期(斑块期组),38例患者颈动脉处于增厚期(增厚期组),36例患者颈动脉管壁正常(管壁正常组)。其中斑块期组血清ZO-1水平均低于增厚期组和管壁正常组,aβ2-GP1水平均高于增厚期组和管壁正常组;增厚期组血清ZO-1水平低于管壁正常组(P<0.05),aβ2-GP1水平高于管壁正常组(P<0.05)。见表3。
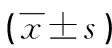
表3 不同程度颈动脉粥样硬化脑梗死患者血清ZO-1和aβ2-GP1水平比较
2.4脑梗死患者血清ZO-1和aβ2-GP1水平与梗死病灶范围及颈动脉粥样硬化程度的相关性分析 经Spearman相关分析,脑梗死患者血清ZO-1水平与颈动脉粥样硬化程度和梗死病灶范围呈负相关(P<0.05),aβ2-GP1水平与颈动脉粥样硬化程度和梗死病灶范围呈正相关(P<0.05),见表4。

表4 脑梗死患者血清ZO-1和aβ2-GP1水平与梗死病灶范围及颈动脉粥样硬化程度的相关性分析
3 讨 论
据统计,脑血管疾病为我国致残率和病死率较高的疾病之一,其中在脑血管疾病中脑梗死的发病率在60%~80%[7]。近年来随着人们生活压力的加大,脑梗死患病年龄趋于年轻化,对年轻人生命造成极大威胁。对于脑梗死的治疗和预防有待进一步研究,该疾病的具体发病机制尚未明确[8-9]。前期研究表明脑梗死的发生与血液凝血机制、代谢性疾病、动脉粥样硬化及动脉栓塞等多种因素有关[10-11]。越来越多的生物标志物被发现在脑梗死患者体内存在异常表达,其在脑梗死的诊断及预后评估中发挥着重要作用[12],逐渐成为近年来研究热点。
闭锁蛋白作为一个被克隆的紧密连接跨膜蛋白,其存在4个疏水跨膜螺旋,羧基端和氨基端位于细胞内,其中两个细胞外环伸向细胞间隙中,而ZO-1是第一个被确认的紧密连接相关蛋白,是膜相关鸟苷酸激酶蛋白家族成员,能够与闭锁蛋白羧基端结合[13-14]。ZO-1和闭锁蛋白是紧密连接的主要结构蛋白,也是紧密连接的功能蛋白,能够维持细胞极性,调控上皮细胞渗透性[15]。ZO-1作为一种细胞骨架蛋白,能够为内皮细胞提供结构性支持,其水平降低可能会造成血脑屏障异常,进而造成脑梗死的发生[16]。本研究发现脑梗死患者的ZO-1水平低于体检健康者,其会造成患者血脑屏障异常,进而造成脑部血液成分改变,导致脑梗死发生。
aβ2-GP1与血栓形成有着密切关系,可通过多种途径影响凝血系统,对血栓形成有促进作用,进而导致脑梗死发生[17]。前期研究证实,aβ2-GP1作为抗磷脂抗体家族的一员,能够与磷脂蛋白结合,对于磷脂相关的凝血过程进行干扰,进而导致凝血,造成血栓形成[18]。本研究结果显示,研究组血清ZO-1水平低于对照组,血清aβ2-GP1水平高于对照组(P<0.05),这会造成机体血液呈现高凝状态,进而加快动脉粥样硬化,造成斑块破裂导致急性脑梗死。
本研究对不同梗死病灶范围和不同程度颈动脉粥样硬化脑梗死患者血清ZO-1和aβ2-GP1水平进行比较,研究发现,随着梗死病灶范围及颈动脉粥样硬化程度的增加,患者ZO-1水平降低,aβ2-GP1水平升高(P<0.05)。ZO-1是血脑屏障被破坏的标志物,其水平降低表明血脑屏障受到破坏,导致多种大分子及炎症分子等进入血脑屏障引起脑梗死,因而随着梗死程度的增加,患者ZO-1水平降低。aβ2-GP1会促进血栓的形成,aβ2-GP1水平的升高会促进动脉粥样硬化加重。另外本研究相关性研究发现,脑梗死患者血清ZO-1水平与颈动脉粥样硬化程度和梗死病灶范围呈负相关,aβ2-GP1水平与颈动脉粥样硬化程度和梗死病灶范围呈正相关(P<0.05)。该结果为后期脑梗死患者临床诊断和治疗提供了参考,后期可参考患者血清ZO-1和aβ2-GP1水平对患者病情进行评估[19]。
本研究仍存在一定缺陷,例如纳入患者数量较少,结果可能存在一定的偏倚性,后期还有待进行大样本试验进行研究验证。
综上所述,脑梗死患者血清ZO-1和aβ2-GP1水平与患者颈动脉粥样硬化程度及梗死病灶范围有着良好的相关性,临床中可参考二者的水平指导脑梗死患者的诊断、治疗和预后。

