2型糖尿病患者血清FABP1、FABP2水平与糖尿病肾病的关系分析*
吕梅月,王 玲,武 煜,孙浩远,张 林
徐州医科大学附属徐州市立医院肾内科,江苏徐州 221002
2型糖尿病(T2DM)为常见的代谢性疾病,全球患病数约4.2亿[1]。糖尿病肾病(DKD)是高血糖引起的慢性肾损伤,表现为持续性蛋白尿和进行性肾功能降低,并最终导致终末期肾病的发生[2]。临床上常将尿蛋白排泄率及估计肾小球滤过率(eGFR)用于DKD诊断和病情程度的评估。但部分T2DM患者即使在无蛋白尿情况下仍然存在进行性肾脏损伤,因此在临床应用中有一定的局限性[3]。脂肪酸结合蛋白(FABP)1属于FABP家族,能与长链脂肪酸及其他疏水性配体结合,参与脂肪酸的摄取、传输和代谢[4]。研究表明,免疫球蛋白(Ig)A肾病中FABP1的表达失调能够损伤线粒体结构,增加活性氧和丙二醛的产生,促进肾小球肾炎的发生[5]。FABP2不仅参与长链脂肪酸的摄取、细胞内代谢和运输,还参与细胞生长和增殖的调节[6]。研究表明,终末期肾病患者血清FABP2水平与患者肾功能障碍程度有关,是潜在的肾功能损伤血清标志物[7]。目前DKD患者血清FABP1、FABP2水平及临床意义尚不清楚。本研究通过检测DKD患者血清FABP1、FABP2水平,探讨二者在DKD评估中的临床价值。
1 资料与方法
1.1一般资料 选取2020年1月至2022年12月本院诊治的T2DM患者170例为研究对象。纳入标准:(1)T2DM诊断符合《中国2型糖尿病防治指南(2020年版)(上)》中的相关标准[8];(2)DKD的诊断符合《中国糖尿病肾脏疾病防治临床指南》中的相关标准[3];(3)临床资料完整,患者及家属对本研究知情同意并签字。排除标准:(1)1型糖尿病;(2)并发糖尿病急性并发症如酮症酸中毒;(3)机体处于感染、创伤等应激状态;(4)合并原发性肾小球肾炎、肾病综合征及狼疮性肾炎等原发性或继发性肾脏疾病;(5)伴有严重心脑血管疾病或恶性肿瘤;(6)妊娠或哺乳期女性。依据尿白蛋白与肌酐比值(UACR),将患者分为DKD组(UACR≥30 mg/g,98例)和非DKD组(UACR<30 mg/g,72例)。DKD组中,男58例,女40例;平均年龄(60.95±9.31)岁;平均体重指数(24.65±3.20)kg/m2。非DKD组中,男42例,女30例;平均年龄(59.43±8.25)岁;平均体重指数(24.53±3.12)kg/m2。以同期于本院行健康体检的60例体检健康者为对照组,其中男33例,女27例;平均年龄(59.81±7.90)岁;平均体重指数(24.51±3.13)kg/m2。3组年龄、性别比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核批准通过[伦理号:sjtky11-1x-2019(26)]。
1.2方法
1.2.1观察指标 收集患者年龄、性别、体重指数、糖尿病病程、收缩压及舒张压等一般资料。采用美国贝克曼库尔特生化分析仪检测空腹血糖(酶法)、总胆固醇(酶法)、甘油三酯(甘油磷酸氧化酶-过氧化物酶法)、低密度脂蛋白胆固醇(LDL-C、直接法-过氧化氢清除法)、高密度脂蛋白胆固醇(HDL-C、直接法),血尿素氮(尿酸酶-过氧化物酶法)、血肌酐(苦味酸法)、血尿酸(尿酸酶-过氧化物酶法)。采用HLC-72 G7糖化血红蛋白分析仪检测糖化血红蛋白(HbA1c)。采用瑞士罗氏cobas e801全自动生化分析仪检测尿蛋白排泄率(电化学发光法)。根据尿蛋白排泄率和血肌酐计算UACR。应用改良MDRD公式计算eGFR。
1.2.2血清FABP1、FABP2水平检测 留取T2DM患者及体检健康者清晨空腹静脉血5 mL,静置2 h后离心,3 000 r/min离心15 min,分离上层血清待测。采用酶联免疫吸附试验(ELISA,双抗体夹心法)检测血清FABP1、FABP2水平。人FABP1 ELISA试剂盒购自重庆智选生物科技公司,货号ZX19344。人FABP2 ELISA试剂盒购自上海臻科生物科技公司,货号ZK-0961。简要步骤:将酶标板室温平衡30 min,加入标本和梯度稀释的标准品,37 ℃孵育1 h,洗涤液洗涤5遍,加入酶标抗体,37 ℃孵育30 min,洗涤1遍,加入底物液37 ℃显色15 min,终止液终止反应后酶标仪读取450 nm处的吸光度值,计算各标本水平。
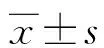
2 结 果
2.1各组血清FABP1、FABP2水平比较 3组血清FABP1、FABP2水平比较,差异有统计学意义(P<0.05);DKD组血清FABP1、FABP2水平高于非DKD组及对照组,非DKD组血清FABP1、FABP2水平高于对照组,差异有统计学意义(P<0.05)。见表1。
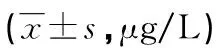
表1 各组血清FABP1、FABP2水平比较
2.2DKD组与非DKD组血清FABP1、FABP2水平及临床相关指标比较 与非DKD组比较,DKD组eGFR较低,而UACR、血肌酐、血尿素氮、血尿酸水平明显较高(P<0.05)。见表2。
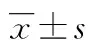
表2 DKD组与非DKD组血清FABP1、FABP2水平及临床相关指标比较[n/n或或M(P25,P75)]
2.3血清FABP1、FABP2水平与DKD患者肾功能相关指标的相关性 Pearson相关分析结果显示,血清FABP1、FABP2水平与UACR、血肌酐、血尿素氮呈正相关,与eGFR呈负相关(P<0.05)。见表3。
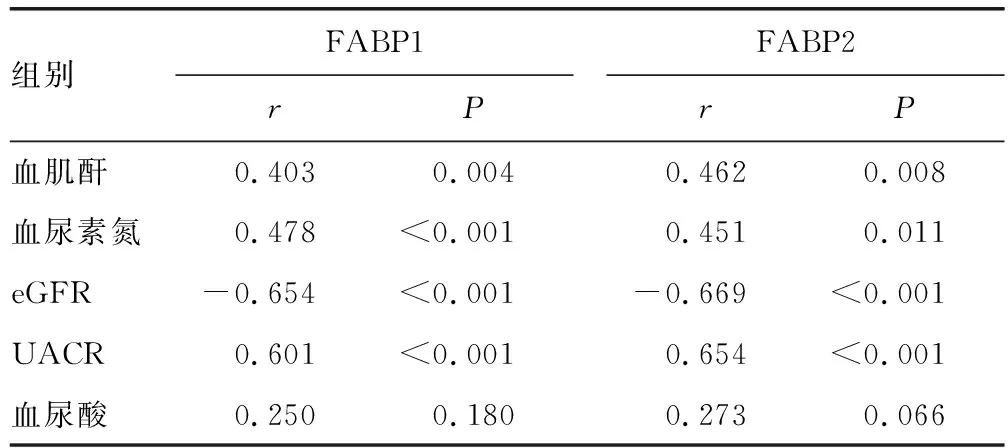
表3 血清FABP1、FABP2水平与DKD患者肾功能相关指标的相关性
2.4多因素Logistic回归分析 以是否发生DKD为因变量(赋值:1=是,0=否),以血清FABP1、FABP2为自变量,以UACR、血肌酐、血尿素氮及eGFR为协变量,进行多因素Logistic回归分析。结果显示,血清FABP1、FABP2水平升高是影响DKD发生的独立危险因素。把UACR、血肌酐、血尿素氮、eGFR纳入模型校正后,血清FABP1、FABP2水平升高仍是影响DKD发生的独立危险因素。见表4。
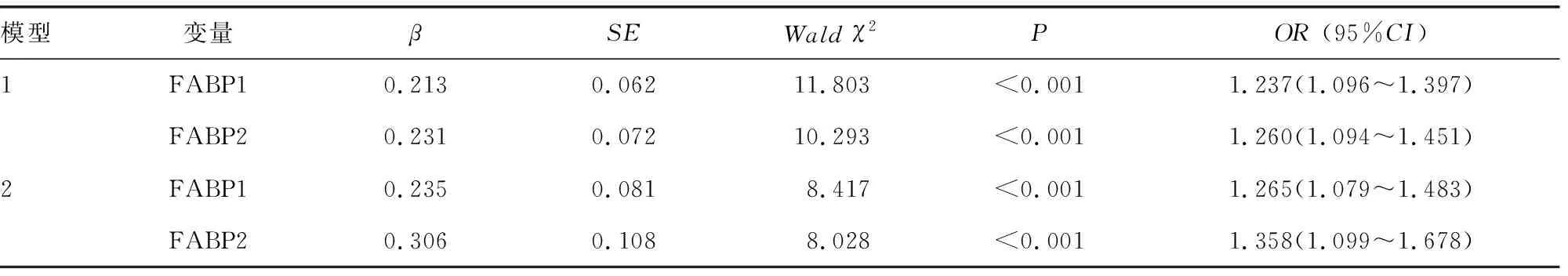
表4 多因素Logistic回归分析影响DKD发生的因素
2.5血清FABP1、FABP2对DKD的评估价值 绘制血清FABP1、FABP2及联合检测对DKD评估的ROC曲线,结果血清FABP1、FABP2联合检测的诊断效能优于血清FABP1、FABP2单独检测的诊断效能(Z=4.712、4.363,P=0.001、0.002)。见表5、图1。

图1 血清FABP1、FABP2及联合检测对DKD的诊断价值的ROC曲线

表5 血清FABP1、FABP2及联合检测对DKD的诊断价值
3 讨 论
DKD是T2DM最为常见的微血管并发症,可发展为终末期肾病,增加T2DM患者心血管疾病和死亡的风险[9]。目前DKD的治疗包括使用血管紧张素转化酶抑制剂、钠-葡萄糖协同转运蛋白2抑制剂等,尚无有效措施延缓DKD疾病进展。因此,早期诊断DKD并予以积极治疗,有助于延缓DKD的疾病进展。肾穿刺活检是诊断DKD的金标准,但具有创伤性,难以在临床上广泛开展。虽然尿蛋白排泄率、eGFR是临床上常用的DKD诊断及病情严重程度评估的指标,但蛋白尿浓度与肾损伤的程度不平行。研究表明,T2DM合并肾损伤患者中,56%的患者为正常蛋白尿[10]。因此,寻找T2DM患者DKD发生的新型血清标志物,具有重要临床意义。
FABP1也称为肝型脂肪酸结合蛋白,主要表达于人类肾脏的近端肾小管中,参与脂肪酸代谢的调节过程。循环中的FABP1能够在近端肾小管中被重新吸收,当近端肾小管上皮细胞发生损伤时,FABP1在尿液中的水平升高,是潜在的肾功能损伤的生物标志物[11]。本研究中,DKD患者血清FABP1水平升高,与既往学者研究报道的结果一致[12]。高血糖能够损伤肾小管周围毛细血管内皮细胞,引起肾小管上皮细胞缺血、缺氧,而缺氧诱导因子1在转录水平上促进FABP1基因的表达[13]。但对于T2DM患者,除血糖升高以外,机体往往同时存在高血压、高血脂等其他异常的代谢改变,这些因素均能够直接损伤肾脏远曲肾小管上皮细胞,导致机体脂肪酸代谢失调,从而致使血清FABP1水平升高。因此,血清FABP1水平升高参与T2DM患者DKD疾病的发生。本研究中,DKD患者血清FABP1水平与UACR、血肌酐、血尿素氮呈正相关,与eGFR呈负相关,表明血清FABP1水平升高能够评估肾功能损伤严重程度。分析其原因,DKD患者近端小管存在蛋白和脂肪酸过载的现象,而FABP1作为脂肪酸结合蛋白,在DKD发生时水平相应升高,在DKD早期的肾脏损伤和修复过程中发挥重要作用[14]。但随着DKD疾病进展,花生四烯酸和亚油酸等非氧化脂肪酸大量蓄积,而脂质过氧化后具有细胞毒性,可损伤肾小管上皮细胞,导致肾功能损伤和肾功能障碍的发生。此外,肾小管上皮细胞中FABP1的水平升高能够诱导单核细胞趋化蛋白1的表达,促进肾间质组织中巨噬细胞浸润,大量白细胞介素1β,白细胞介素6等促炎症细胞因子的产生,加速肾小管间质的损伤,促进Ⅰ型和Ⅲ型胶原蛋白的沉积,致使糖尿病肾病的疾病进展[15]。本研究中,血清FABP1是影响DKD发生的独立危险因素,表明FABP1是新的评估T2DM患者DKD发生的血清标志物。既往在动物实验中证实,糖尿病小鼠血清和尿液中FABP1水平升高,通过敲除FABP1的表达能够明显抑制肾小管上皮细胞损伤,减轻血管内皮粥样硬化,抑制DKD的发生[16]。因此,检测T2DM患者血清FABP1水平有助于评估DKD的发生,辅助临床医生对DKD疾病严重程度进行评价,值得临床关注。
FABP2也称为肠型脂肪酸结合蛋白,是水溶性蛋白,主要表达于十二指肠到回肠的肠黏膜上皮细胞,在坏死性小肠结肠炎、非闭塞性肠系膜缺血等急性肠缺血疾病中水平升高[17]。正常生理条件下,血清FABP2能够被肾脏迅速清除(半衰期约为11 min),但肾功能不全患者的FABP2水平通常会升高,是潜在的肾功能不全患者早期诊断的生物标志物[7]。本研究中,DKD患者血清FABP2水平升高,提示血清FABP2水平升高参与T2DM患者DKD的疾病发生。DKD患者血清FABP2水平升高的原因与FABP2基因多态性有关。研究发现,FABP2的Ala54Thr(密码子54处的丙氨酸被苏氨酸取代)多态性导致血清FABP2水平升高,肠黏膜上皮细胞长链脂肪酸吸收增多,导致高脂血症及胰岛素抵抗的发生,进而损伤肾微血管内皮细胞,导致肾功能损伤[18]。本研究DKD患者血清FABP2水平与UACR、血肌酐、血尿素氮呈正相关,与eGFR呈负相关,表明血清FABP2水平升高能够反映肾功能损伤程度。这与既往在终末期肾病患者血清FABP2水平升高的报道一致[7]。其原因可能是FABP2水平的升高能够加速机体糖脂代谢紊乱,导致肾小球毛细血管凝血及肾小球内皮功能损伤,致使肾功能障碍[19]。此外,FABP2能够促进胰岛素抵抗的发生,导致肾小球滤过率升高、基底膜增厚,引起肾小球硬化,增加患者蛋白尿和肾功能障碍[20]。本研究中,血清FABP2是影响DKD发生的独立危险因素,表明FABP2是新的评估T2DM患者DKD发生的血清标志物。研究表明,血清FABP2水平升高能够促进微小血管动脉粥样硬化的发生,增加血管内膜厚度,血管内皮细胞缺氧引起线粒体功能障碍,促进大量活性氧生成,导致DKD的发生[20]。本研究显示,血清FABP1、FABP2联合对T2DM患者DKD的发生具有较高的评估价值,诊断灵敏度(0.952)和特异度(0.733)较高。因此,血清FABP1、FABP2联合检测有助于辅助临床医生对T2DM并发DKD进行有效评估,对DKD发生风险较高的T2DM患者予以积极诊治,以延缓终末期肾病的发生,改善患者预后。
综上所述,DKD患者血清FABP1、FABP2水平升高,二者能够反映糖尿病患者肾功能损伤情况。血清FABP1、FABP2水平升高是影响DKD发生的独立危险因素,二者联合检测对T2DM患者DKD的发生具有较高的诊断效能,为DKD的临床早期诊治提供新思路。但本研究存在一定的不足,本研究为横断面研究,样本量有限,尚不能分析血清FABP1、FABP2水平升高与T2DM患者DKD发生的因果关系,需今后设计前瞻性、大样本的长期随访研究,进一步阐明FABP1、FABP2在DKD发病中的作用。此外,本研究未能评估血清FABP1、FABP2水平对未出现微量蛋白尿的DKD患者的预测价值,有待今后进行前瞻性临床试验进一步研究。

