低锂盐湖原卤吸附提锂试验研究*
赖先熔,孙 豪,陈周秦,阳 超
(四川泛宇锂能新材料科技有限公司,四川 德阳 618000)
0 引言
锂盐作为动力电池和储能电池的核心原料,近年来市场需求量急剧增加[1],2022年碳酸锂价格一度超过50万元/t,且供不应求。我国锂资源丰富,占全球总储量的7%[2],其中盐湖卤水型锂资源占我国总锂资源的80%,主要集中在青藏高原[3]。我国每年从国外购买大量锂矿,锂资源对外依存度超过60%[4],这主要是因为我国多数盐湖卤水存在锂含量低、镁含量高、锂镁分离困难、其他杂质离子含量高等特点[5],导致卤水锂开发利用难度很大。根据董涛等[6]对西藏地区盐湖的统计,在57个主要含锂盐湖中锂质量浓度低于70 mg/L的盐湖有34个,占比60%。青海省盐湖也存在类似情况,在已探明氯化锂储量(2 447万t)中达到工业品位的锂资源为892万t[7],仅占青海省盐湖锂资源总量的36.4%。因此,低锂盐湖锂资源在我国盐湖锂资源中占据主导地位。
随着高品位盐湖锂资源的不断开采,在锂盐需求量持续增加的市场形势下,开发低锂盐湖资源势在必行。目前我国盐湖提锂的工业化方法主要有蒸发-沉淀法[8]、铝盐吸附法[9]、煅烧法[10]、萃取法[11]和膜分离法[12-13]等,这些工艺都是从经过盐田蒸发浓缩结晶后的老卤中提锂的,由于结晶过程中锂盐的夹带损失,锂综合收率通常在30%左右[14],存在巨大的资源浪费。目前关于将锰系吸附剂直接应用于低锂盐湖原卤(锂离子质量浓度在50~70 mg/L)提锂的实例尚未见报道。本文采用自制的新型锰系吸附剂,以我国青海某典型低锂盐湖卤水为研究对象,其锂质量浓度在50 mg/L左右,且Na、K、Mg、B等元素含量高,考查本吸附剂对低锂盐湖卤水的适用性及其吸附容量和循环性能等,以期为我国低锂盐湖原卤直接提锂提供借鉴。
1 试验部分
1.1 试剂与仪器
1.1.1 原料及试剂
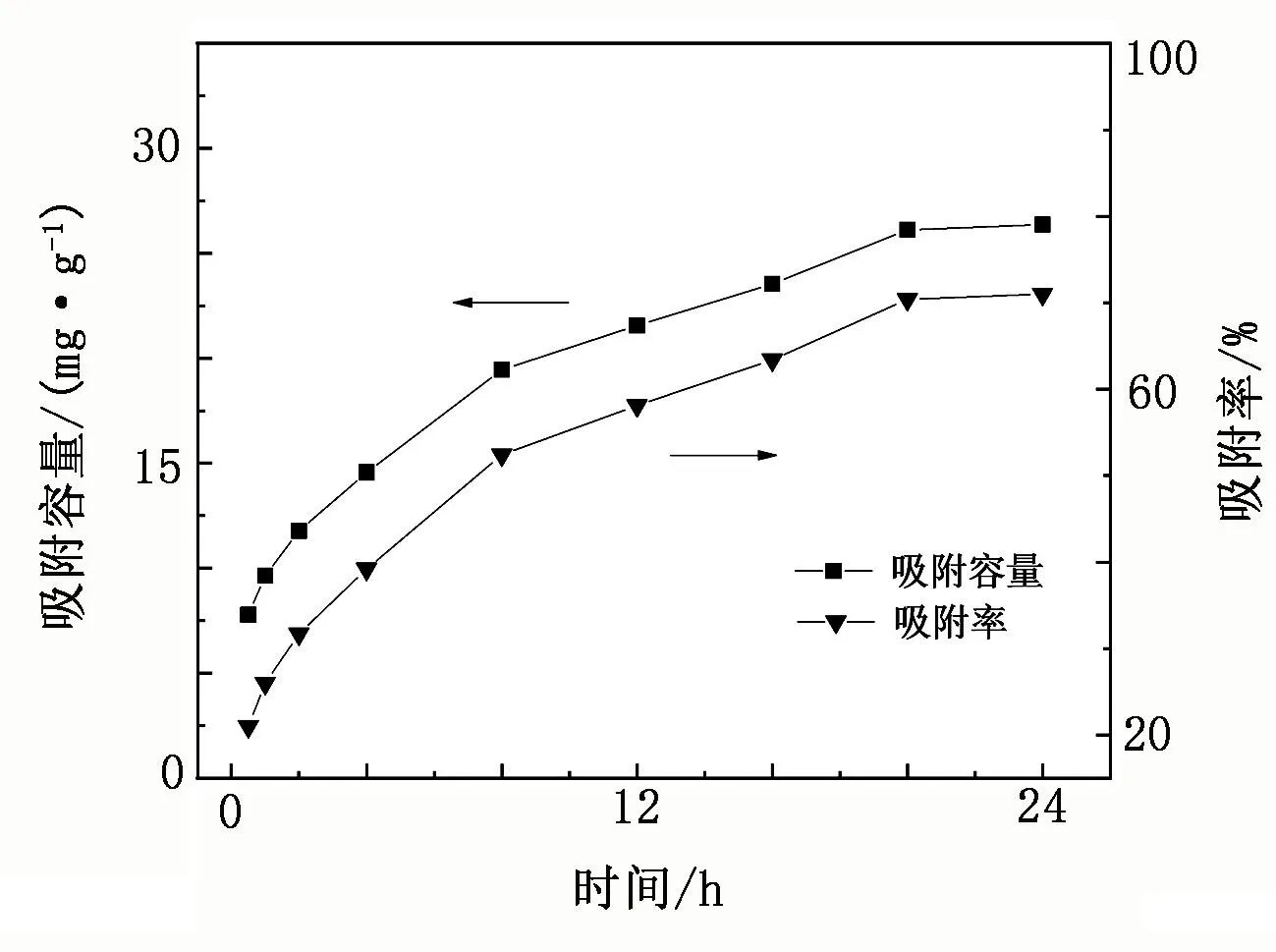
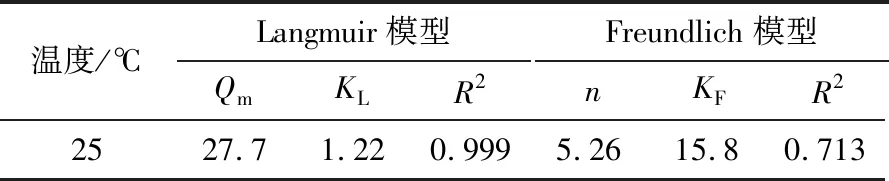
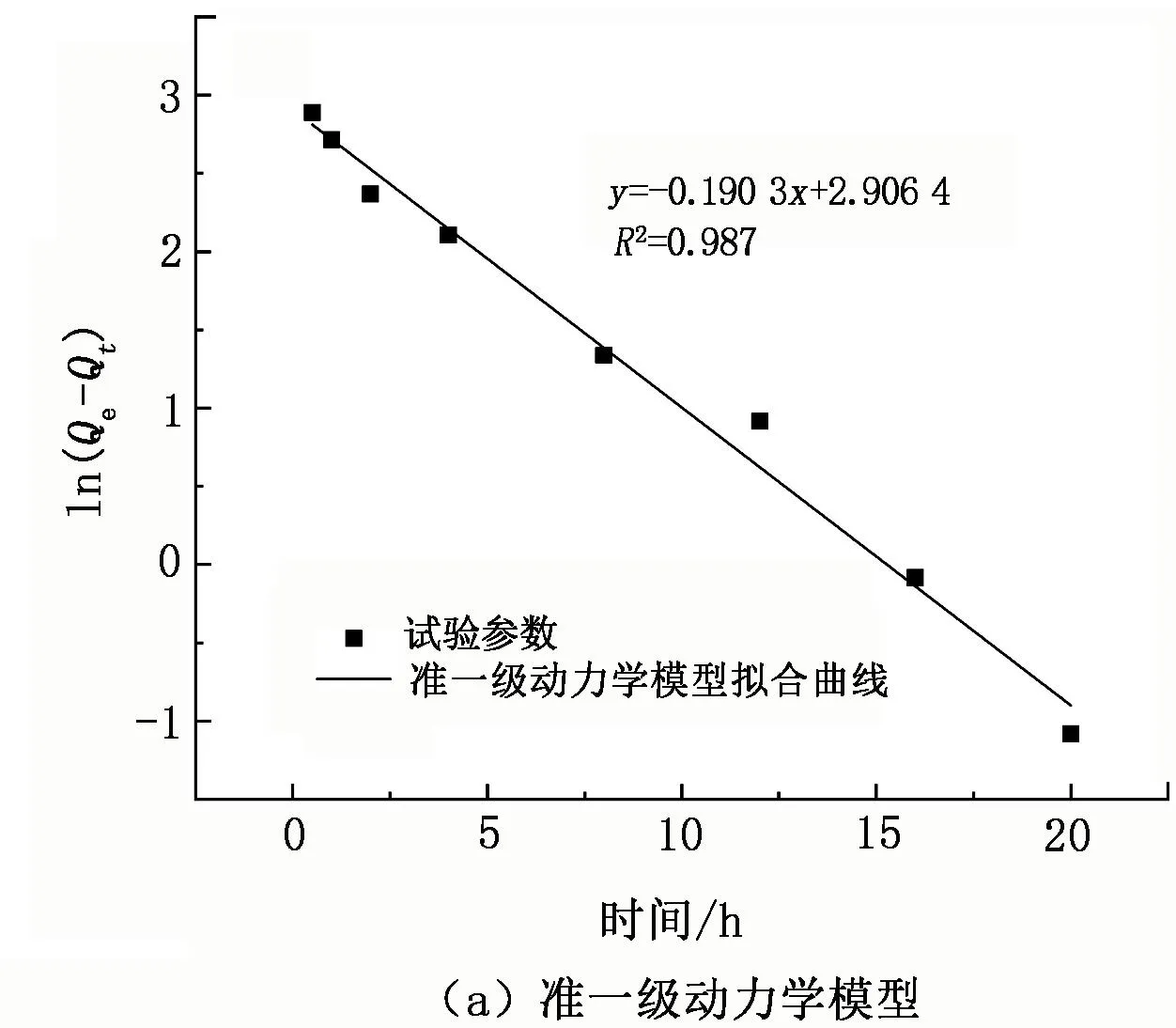
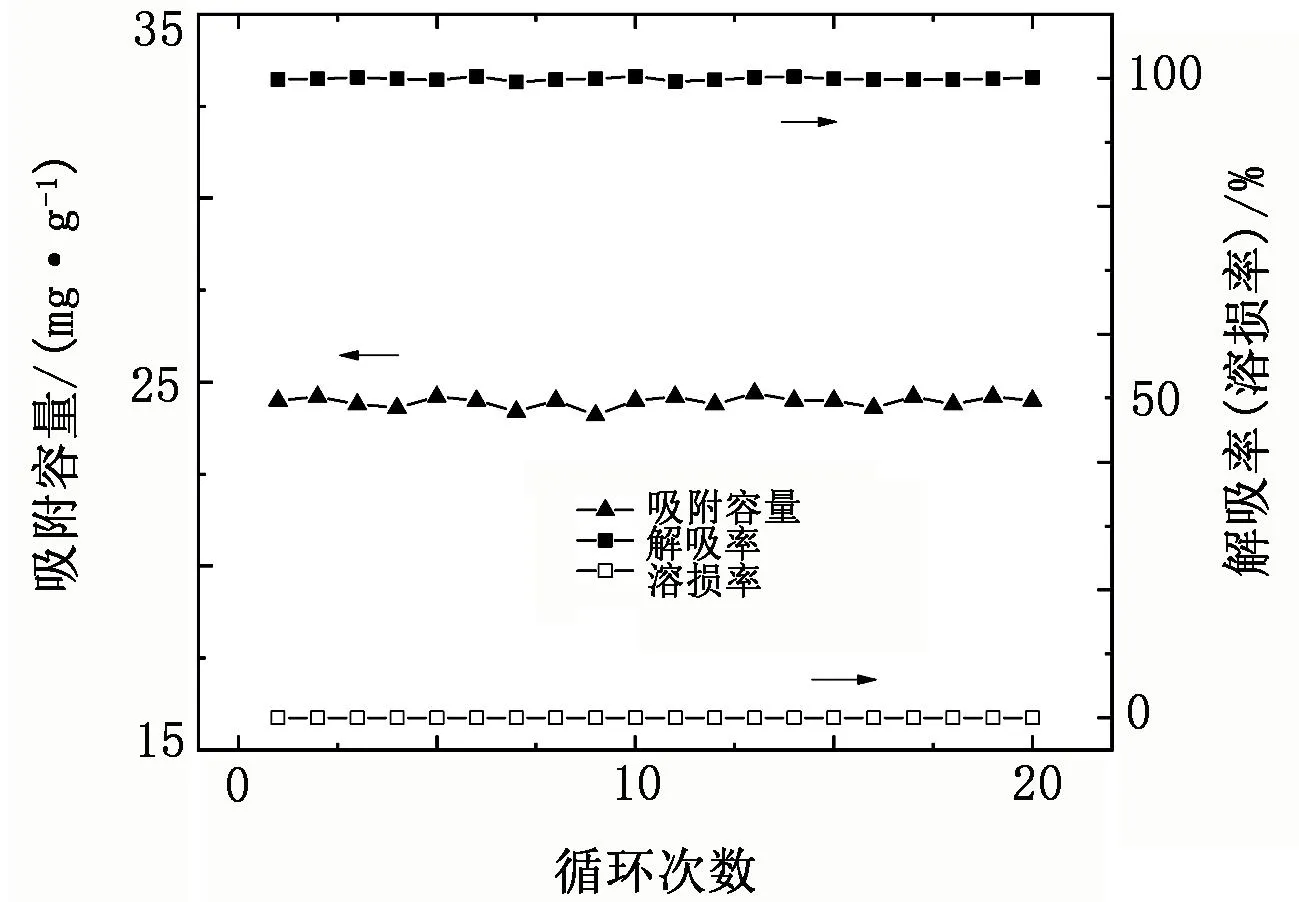
本试验采用的锂吸附剂为自主研发的新型锰系吸附剂(简称“FY型吸附剂”),制备方法见文献[15],其前驱体分子式为Li4[LiyMn5-y/4]-O12-zSz(0 表1 颗粒吸附剂性能参数 表2 青海省某盐湖原卤主要组成 单位:g/L 图1 FY型吸附剂表征 1.1.2 仪器与测试方法 吸附/解吸试验使用水浴恒温振荡器(SHZ-82A,江苏东鹏仪器制造有限公司);过滤操作使用循环水真空泵(SHZ-DⅢ,上海道京仪器有限公司)。样品中的Li+、Mg2+、Ca2+、Mn2+浓度采用原子吸收光谱仪(WFX-220B,北京北分瑞利分析仪器有限责任公司)测定;Na+、K+浓度采用火焰光度计(FP640,上海仪电分析仪器有限公司)测定,Cl-浓度采用硝酸银化学滴定法测试,硫酸根含量采用硫酸钡重量法测定。 用量筒量取一定体积原卤加入2 L烧杯中,然后加入一定比例的可溶性pH调节剂(碳酸氢钠),搅匀,将烧杯放入已设定好温度的恒温振荡器中,待水温达到设定温度时,按固液比加入一定质量的吸附剂,开启振荡按钮开始吸附试验。当达到振荡时间后,关闭振荡按钮,取出烧杯,用循环水真空泵抽滤料液,分离吸附剂与卤水,记录滤液(吸附母液)体积;吸附剂滤饼用一定量纯水洗涤,记录吸附洗水体积。用原子吸收光谱法测定吸附母液和吸附洗水样品中的锂浓度。本试验分别考查吸附温度、吸附时间、pH调节剂用量、吸附剂质量(g)与卤水体积(mL)比(简称“固液比”)对吸附容量的影响,以获得较适宜的吸附条件。吸附容量和吸附率的计算式分别为 (1) (2) 式中:Q为每克锂吸附剂的吸附容量,mg/g;α为Li+的吸附率,%;C0为Li+的初始质量浓度,mg/L;V0为溶液的初始体积,L;C1为吸附母液中Li+的质量浓度,mg/L,V1为吸附母液的体积,L;C2为吸附洗水中Li+的质量浓度,mg/L;V2为吸附洗水的体积,L;m为锂吸附剂的质量,g。 用量筒量取一定体积的稀酸溶液,加入1 L烧杯中,然后放入已设定好温度的恒温振荡器内,待水温达到设定温度后,按固液比加入一定质量负载锂离子的吸附剂,开启振荡按钮开始解吸试验。当达到振荡时间后,关闭振荡按钮,取出烧杯,用循环水真空泵抽滤料液,分离吸附剂和解吸液,记录解吸液体积;吸附剂滤饼用一定量纯水洗涤,记录解吸洗水体积。用原子吸收光谱法测定解吸液样品中的锂、锰等离子浓度及解吸洗水样品中的锂浓度。本试验分别考查酸浓度、酸体积和解吸时间对解吸率和溶损率的影响。根据式(3)、式(4)计算锂离子解吸率和锰离子溶损率。 (3) (4) 式中:D为Li+解吸率,%;CLi为解吸液中Li+质量浓度,mg/L;V3为解吸液体积,L;S为Mn2+的溶损率,%;CMn为溶液中Mn2+质量浓度,mg/L;δ为吸附剂中Mn2+质量分数,%;其他参数同前。 2.1.1 温度对吸附效果的影响 按固液比1∶700量取1 400 mL配制卤水,加入0.9 g pH调节剂,搅匀,然后加入2 g FY型吸附剂,振荡吸附24 h,考查不同温度下的吸附效果(见图2)。 图2 不同温度下的吸附容量 由图2可知,不同温度下吸附剂的吸附容量约为26 mg/g,变化幅度小,仅当温度为45 ℃时,吸附容量稍有降低,卤水中Li+的吸附率保持在71%。这表明在5~45 ℃范围内,温度对吸附剂的吸附效果影响不大。 2.1.2 时间对吸附效果的影响 按固液比1∶700量取1 400 mL配制卤水,加入0.9 g pH调节剂,搅匀,然后加入2 g吸附剂,在25 ℃水浴中振荡吸附,考查不同吸附时间下的吸附效果(见图3)。 图3 不同吸附时间下的吸附容量 由图3可知:随着吸附时间的延长,吸附容量迅速上升,0~8 h时吸附曲线斜率较大,吸附容量增量为2.43 mg/(g·h);8~20 h,吸附容量增量为0.55 mg/(g·h);20~24 h,吸附曲线趋于平缓,吸附容量增量为0.15 mg/(g·h),吸附容量达到该条件下的最大值。卤水中Li+的吸附率随着吸附时间的增加而升高,至20 h时吸附率趋于平缓,最终达到71%。因此,将吸附时间控制在20 h。 2.1.3 pH调节剂比例对吸附效果的影响 按固液比1∶700量取1 400 mL配制卤水,加入一定量的调节剂,搅匀,然后加入2 g吸附剂,在25 ℃水浴中振荡吸附20 h后过滤,考查不同调节剂比例(调节剂质量与卤水体积之比)下的吸附效果(见图4)。 图4 不同pH调节剂比例下的吸附容量 由图4可知,吸附容量随着pH调节剂用量的增加而增大,当调节剂比例在0.8∶1~1∶1时,吸附容量增幅明显;当调节剂比例高于1∶1后,吸附容量增速变缓。这表明pH调节剂可有效中和吸附剂中置换出的H+,但由于吸附容量有限,当pH调节剂比例超过1∶1后,吸附容量不再增加,说明调节剂用量达到上限。卤水中Li+吸附率随着pH调节剂用量的增加先升高后趋于平缓,当pH调节剂比例达到1∶1后,吸附率基本保持在71%。因此,选择调节剂比例为1∶1。 2.1.4 固液比对吸附效果的影响 取一定量配制卤水,按1∶1的比例将调节剂加入卤水中,搅匀,然后加入2 g吸附剂,在25 ℃水浴中振荡吸附20 h后过滤,考查固液比对吸附效果的影响(见图5)。 图5 不同固液比下的吸附容量 由图5可知,吸附容量随着固液比的增大而上升,当固液比达到1∶600后,吸附容量增幅很小;而吸附率随着固液比的增大而降低,当固液比为1∶500时,其吸附容量为24.6 mg/g,吸附率为92.8%,吸附母液中残余锂质量浓度为3.5 mg/L。因此,将固液比设置为1∶500,既可保证较高的吸附容量和吸附率,又可使卤水中Li+的吸附限度降至5 mg/L以下,以最大程度地回收原卤中的Li+。 由于吸附剂在5~45 ℃范围内对温度不敏感,因此选取其中一个温度(25 ℃)考查吸附剂的吸附热力学性质。取不同体积卤水,按1∶1的比例加入pH调节剂,然后加入2 g吸附剂,在25 ℃恒温下振荡吸附24 h,测定溶液中的锂浓度,计算吸附容量。为研究吸附机理,采用Langmuir模型和Freundlich模型对试验数据进行拟合,表达式分别为 (5) (6) 式中:Qe、Qm分别为平衡吸附容量和最大吸附容量,mg/g;Ce为Li+的平衡质量浓度,mg/L;KL为Langmuir模型常数,L/mg;KF为Freundlich模型常数,mg/g;n为Freundlich常数。 Langmuir模型和Freundlich模型的拟合曲线见图6,其对应的拟合参数见表3。 表3 Langmuir和Freundlich模型拟合参数 图6 Li+等温吸附数据的Langmuir和Freundlich 模型拟合曲线 由图6可知,Langmuir模型对试验数据的拟合效果较好,相关系数R2为0.999。因此,锂吸附剂的等温吸附行为符合Langmuir模型,表明Li+在吸附剂上的吸附为单分子层化学吸附,这与文献[17]得到的结论一致。 取1.0 L原卤,按1∶1的比例加入pH调节剂,再加入2.0 g吸附剂,在25 ℃下振荡吸附,设置不同的吸附时间,振荡结束后过滤、洗涤,测定滤液和洗水中的Li+质量浓度,计算吸附容量。为研究该温度下的吸附速率和吸附机理,采用准一级动力学模型与准二级动力学模型拟合试验数据,表达式分别为 ln(Qe-Qt)=lnQe-K1t, (7) (8) 式中:Qt为t时刻吸附剂对Li+的吸附量,mg/g;K1为准一级动力学模型的吸附速率常数,h-1;K2为准二级动力学模型的吸附速率常数,g/(mg·h);t为吸附时间,h。 准一级和准二级动力学模型拟合曲线见图7,其拟合参数见表4。由图7可知,采用准二级动力学模型拟合得到的相关系数比用准一级动力学模型拟合得到的相关系数更接近于1,因此可以认为吸附剂在该卤水中的吸附动力学符合准二级动力学模型,该模型属于平方推动力模型,表明离子交换过程受颗粒扩散控制。 表4 准一级和准二级动力学模型拟合参数 图7 Li+吸附数据的准一级和准二级动力学模型拟合曲线 2.4.1 酸浓度对解吸效果的影响 将2 g处于吸附平衡状态的吸附剂加入100 mL不同浓度的硫酸溶液(0.030、0.035、0.040、0.045、0.050 mol/L)中,在25 ℃下振荡24 h,将悬浊液过滤,用去离子水清洗滤饼,收集滤液和洗水分析Li+、Mn2+浓度,考查不同硫酸浓度下的解吸效果以及吸附剂的溶损情况,试验结果见表5。由表5可知:在相同解吸酸体积下,随着酸浓度的升高,解吸液中Li+质量浓度也升高;当酸浓度达到0.045 mol/L后,Li+解吸率为100%,表明酸中H+和吸附剂中Li+充分交换;与此同时,随着解吸酸浓度的升高,H+和Li+置换后残余在溶液中的H+增多,这部分H+对吸附剂有一定的溶解作用,解吸液中Mn2+质量浓度也随之升高。为得到较高的解吸率和极低的溶损率,选择解吸液酸浓度为0.045 mol/L。 表5 不同酸浓度下的解吸率及溶损率 2.4.2 酸用量对解吸效果的影响 以0.045 mol/L为解吸酸浓度,考查硫酸用量对解吸效果的影响,试验步骤为:取2 g吸附饱和的锂吸附剂,加入不同体积的硫酸,在25 ℃下振荡解吸24 h,考查解吸率与硫酸体积的关系,试验结果见图8。由图8可知:随着解吸液体积的增大,Li+质量浓度先升高后降低,当体积为80 mL时达到最大值,随后持续下降;而解吸率随着解吸液体积的增大,在70~90 mL时,迅速上升,超过90 mL后达到100%,表明Li+解吸完全。因此,选择解吸液体积为90 mL较合适,吸附剂质量与酸体积之比为1 g∶45 mL。 图8 不同酸用量下的解吸效果 2.4.3 时间对解吸效果的影响 取20 g吸附饱和的锂吸附剂,加入900 mL浓度为0.045 mol/L的稀硫酸,在25 ℃下振荡解吸,在不同的解吸时间取样分析Li+质量浓度,考查解吸率与时间的关系,试验结果见图9。 图9 不同解吸时间下的解吸效果 由图9可知:随着解吸时间的增加,解吸曲线呈先陡峭后平缓的趋势;前4 h解吸液中Li+质量浓度增幅较大,解吸率已达93%,之后Li+质量浓度增幅减小,到12 h时解吸率接近100%。从解吸曲线可以发现,吸附剂上负载的Li+的解吸难易程度不同,约占吸附容量10%的Li+较难从吸附剂上脱出,需要花费相当长的置换时间,可能是因为这部分Li+处于吸附剂颗粒较内部的位置,传质阻力大。因此,要使吸附剂上负载的Li+全部解吸下来,解吸时间需在12 h以上。 在最佳试验条件下,以青海某盐湖原卤为原料,开展循环吸附提锂试验研究。吸附试验条件为:吸附温度25 ℃,吸附时间20 h,调节剂加入比例1∶1,吸附剂与卤水的固液比1∶500。解吸试验条件为:解吸酸浓度0.045 mol/L,吸附剂质量与酸体积之比为1 g∶45 mL,解吸时间12 h。在该条件下开展20次循环试验,试验结果见图10。20次循环的解吸液综合样组成见表6。 表6 20次循环解吸液综合样组成 单位:mg/L 图10 循环试验数据 由图10可知,20次循环的吸附容量稳定在24 mg/g,解吸率接近或等于100%,溶损率≤0.01%,表明吸附剂的吸附性能稳定。由表6可知,20次循环试验的解析液混合样中,Li+质量浓度为543.0 mg/L,镁锂质量比由原卤的679降为0.5,其他杂质离子含量低,可作为生产碳酸锂的优质富锂原料。 本文采用自制的锂吸附剂,以青海某盐湖低锂原卤为原料,对吸附/解吸过程的操作条件进行了研究,得到如下主要结论: a.在吸附过程中,吸附剂吸附容量受吸附时间、调节剂添加量、卤水与吸附剂的固液比影响较大,而受温度(5~45 ℃)影响较小。在吸附温度25 ℃、吸附时间20 h、调节剂比例1∶1、吸附剂与卤水的固液比1∶500时,吸附剂的饱和吸附容量为24.6 mg/g,Li+吸附率为92.8%。 b.在解吸温度为25 ℃、解吸酸浓度为0.045 mol/L、吸附剂质量与酸体积之比为1 g∶45 mL、解吸时间为12 h的条件下,解析率达到100%。 c.在最佳试验条件下,开展20次循环试验,吸附容量稳定在24 mg/g,解析率近100%,单次溶损率≤0.01%。 以上试验结果表明,该锂吸附剂可用于Li+质量浓度低于70 mg/L的低锂盐湖卤水直接提锂,具有吸附率高、吸附容量大、单次溶损率低等优点。
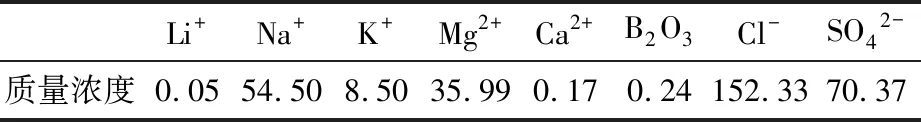

1.2 吸附试验
1.3 解吸试验
2 试验分析
2.1 吸附试验分析



2.2 吸附热力学研究

2.3 吸附动力学研究

2.4 静态解吸试验分析



2.5 循环吸附试验

3 结论

