紫杉醇还原敏感型聚合物胶束的制备及其逆转肿瘤多药耐药的研究
张梦欣,于英杰,董 优,宋 煜
福建中医药大学药学院,福建 福州 350122
目前,化疗仍是临床治疗乳腺癌的主要方式之一[1-4]。临床研究表明,多药耐药(multidrug resistance,MDR)的存在是造成化疗失败和肿瘤复发的主要原因[5-10]。MDR[11]是指癌细胞因接触一种化疗药物产生耐药性的同时,对其他多种不同结构、不同作用机制的化疗药物同样存在耐药性。研究表明,乳腺癌MDR 是多种细胞机制共同作用的结果,主要作用机制包括跨膜蛋白过度表达[12]、谷胱甘肽及其酶系统[13]、凋亡基因表达异常[14]、药物作用靶点改变[15]等,致使癌细胞对化疗药摄取量减少、外排量增加以及增加了对化疗药凋亡作用的抗性等。基于乳腺癌MDR 的病理特征,只考虑一种因素无法解决化疗过程中出现的耐药性问题,因此只有从多途径、多因素、多靶点、多角度上进行逆转才可以更好地寻求合理的解决方案。
本研究所合成聚合物胶束载体还原敏感型透明质酸-熊果酸聚合物(hyaluronic acid-cystamineursolic acid,HSU)中的熊果酸除自身具有明显的抗肿瘤活性外,还具有多靶点逆转MDR 的功能[16];透明质酸作为CD44 配体,可通过乳腺癌细胞表面过度表达CD44 受体进而介导促进药物细胞内吞[17];与正常生理环境相比,肿瘤环境下的谷胱甘肽(glutathione,GSH)浓度高至100~1000 倍,而二硫键连接臂所构建的还原敏感型胶束能够在肿瘤微环境高还原响应下快速释放化疗药物进而减少药泵外排[18]。因此,本研究联合以上3 种策略所构建的还原敏感型载体用于递送化疗药紫杉醇,考察PTXHSU 的体外释放行为,并对该载药胶束的细胞毒性、细胞摄取和胞内GSH 进行研究,以期实现逆转乳腺癌多药耐药性的目标。
1 仪器与材料
1.1 仪器
JY92-2D 型超声波细胞破碎仪,宁波新芝生物科技公司;Alpha1-2 LD plus 型冷冻干燥机,德国Christ 公司;Nicolet iS5 型傅里叶变换红外光谱仪,赛默飞世尔科技公司;NicompTM380ZLS 型激光粒径测定仪(DLS),美国Santa Barbara 公司;Avance III 500 型核磁共振波谱仪,瑞士Bruker 公司;H7650型透射电子显微镜(TEM),日本日立公司;DKZ 型系列电热恒温振荡水槽,上海一恒科技公司;Infinite M200 PRO 型酶标仪,瑞士Tecan 公司;LC 2030 型高效液相色谱仪,岛津公司;DMIi8-M 型倒置荧光显微镜,德国Christ 公司。
1.2 材料
熊果酸(批号F1928106,质量分数≥98%)、N-羟基琥珀酰亚胺(NHS,质量分数≥98%)、碳二亚胺盐酸盐(EDC,质量分数≥98%)、己二酸二酰肼(ADH,质量分数≥98%)、甲酰胺(分析纯)、二甲基亚砜(DMSO,分析纯)、二甲基甲酰胺(DMF,分析纯),阿拉丁生化科技公司;紫杉醇,批号902-1812401,质量分数≥98%,福建南方制药股份有限公司;胱胺二盐酸盐(CYS),质量分数≥97%,梯希爱化成工业发展公司;透明质酸,相对分子质量9850,江苏海华生物科技有限公司;透析袋,截留相对分子质量(MWCO)3500,上海源叶生物科技有限公司;RMPI 1640 基础培养基、胎牛血清,Gibco公司;MTT、香豆素-6(coumarin-6,C6,质量分数98%),Sigma 公司。
1.3 细胞
人乳腺癌紫杉醇敏感细胞株MCF-7 细胞、人乳腺癌紫杉醇耐药细胞株MCF-7/ADR 细胞,上海艾研生物科技有限公司。
2 方法与结果
2.1 HSU 与HU 的合成
合成路径如图1 所示。本实验将熊果酸和透明质酸中的-COOH 通过酰胺化反应分别连接在CYS或ADH 两端的-NH2上,得到具有还原敏感型的HSU 和非还原敏感型的HU。

图1 HSU/HU 的合成路径图Fig. 1 Synthesis path diagram of HSU/HU
2.1.1 HSU 的合成 称取透明质酸(0.8 mmoL)置烧瓶中,甲酰胺溶解,加入EDC(1.6 mmoL)和NHS(1.6 mmoL),冰浴0.5 h,加入CYS(8 mmoL),搅拌反应24 h 后,冰丙酮沉淀、抽滤,适量水复溶,0.8 μm 微孔滤膜滤过,超纯水透析(MWCO3500)48 h 后,冷冻干燥,即得HA-CYS 纯品。
称取熊果酸(0.1 mmoL),置烧瓶中,30 mL DMF-甲酰胺(1∶1)混合溶剂溶解,加入EDC(0.7 mmoL)和NHS(0.7 mmoL),冰浴4 h,加入HACYS(0.2 mmoL),室温反应24 h 后,冰丙酮沉淀,抽滤,适量水复溶后,离心,上清液0.8 μm 膜滤过,超纯水透析(MWCO3500)48 h 后,冷冻干燥,即得HSU 纯品。
2.1.2 HU 的合成 称取透明质酸(0.8 mmoL)置烧瓶中,超纯水溶解,加入EDC(1.6 mmoL)和ADH(7.5 mmoL),冰浴1 h,室温下保持pH 4.75 反应2 h,调节反应溶液至pH 7.0,0.8 μm 微孔滤膜滤过,超纯水透析(MWCO3500)48 h 后,冷冻干燥,即得HA-ADH 纯品。
称取熊果酸(0.5 mmoL),置烧瓶中,40 mL DMF-甲酰胺混合溶剂溶解,加入EDC(4.6 mmoL)和NHS(4.6 mmoL),冰浴4 h,加入0.1 g HA-ADH,室温反应24 h 后,冰丙酮沉淀,抽滤,适量水复溶后,离心,上清液0.8 μm 膜滤过,超纯水透析(MWCO3500)48 h 后,冷冻干燥,即得HU 纯品。
2.2 结构表征
2.2.1 FT-IR 分析 分别称取透明质酸、HA-CYS、HA-ADH、HU 和HSU 适量,KBr 压片法,FT-IR 表征结构。HSU、HU 及反应原料的FT-IR 图谱如图2所示。1618 cm−1和1715 cm−1两处吸收峰分别是透明质酸和熊果酸结构中-COOH 的对称伸缩振动峰(νC=O);而在HSU 与HU 图谱中,并未出现熊果酸的特征峰,推测其已被掩盖,熊果酸经反应已生成新键;HA-CYS 图谱中1653、1558 cm−1处吸收峰和HA-ADH 图谱中1644、1559 cm−1处吸收峰分别对应酰胺键对称伸缩振动峰(νC=O,酰胺I 带)和面内弯曲振动峰(βC=O,酰胺II 带),证明HA-CYS 和HA-ADH 的成功合成;根据HSU 图谱中1653 cm−1(νC=O,酰胺I 带)、1558 cm−1(βC=O,酰胺II 带)和HU 图谱中1646 cm−1(νC=O,酰胺I 带)、1541 cm−1(βC=O,酰胺II 带)处出现酰胺键特征峰,推测HSU 图谱和HU 图谱中出现的酰胺键可能为熊果酸与2 中间体反应生成的新酰胺键吸收峰,但与原来中间体酰胺键吸收峰重叠。为证实HSU 和HU合成成功,HSU 和HU 的结构需要通过H1-NMR 进一步表征。

图2 合成原料及聚合物FT-IR 图Fig. 2 FT-IR diagram of synthetic materials and polymers
2.2.2 H1-NMR 分别将适量透明质酸、HA-CYS、HA-ADH、HSU 和HU 溶于D2O,熊果酸溶于DMSO-d6,H1-NMR 表征结构,并计算CYS、ADH以及熊果酸的取代度(degree of substitution,DS,定义为每100 个透明质酸单体上CYS 和ADH 的嫁接个数)。HSU(D2O)、HU(D2O)及反应原料透明质酸(D2O)、HA-CYS(D2O)、HA-ADH(D2O)、熊果酸(DMSO-d6)的H1-NMR 图如图3 所示。透明质酸特征峰出现在δ2.03(3H,-NH-CO-CH3)处和δ3.25~4.78(2H-CH2-、H、-OH);与透明质酸相比,合成中间体HA-CYS 和HA-ADH 分别在δ2.84(2H,-CH2CH2NH2-,CYS 特征峰)和δ1.69(2H,-NHNHCOCH2CH2-CH2-,ADH 特征峰)、δ2.18~2.33(2H,-NHNHCOCH2CH2-,ADH 特征峰)处出现的吸收峰,证明中间体合成成功,与FT-IR结果一致。按照透明质酸(δ2.0)、CYS(δ2.9)和ADH(δ2.6)的特征峰面积,计算出中间体CYS 和ADH 的DS,分别为(31.13±1.13)%和(50.75±2.63)%;在此基础上,HSU H1-NMR 图在δ0.97~1.10、1.28~1.29 和HU H1-NMR 图在δ1.28~1.29(HU H1-NMR 图中δ0.97~1.10 处吸收峰由于磁各向异性的缘故,向低场移动,被HA-ADH 中δ1.14覆盖,因此消失)处出现的吸收峰归属于熊果酸角甲基的特征吸收峰,结合FT-IR 推测的结果,判断熊果酸已成功接枝,HSU 和HU 合成成功。通过熊果酸角甲基氢(δ1.28)与透明质酸中N-乙酰基中甲基氢(δ2.0)的吸收峰面积比值,计算出HSU 和HU 中熊果酸的取代度分别为(3.12±0.17)%和(3.33±0.47)%,除了中间化学连接臂结构不同,二者取代度相差不大,因此,HU 可以做HSU 的对比参照。

图3 合成原料及聚合物的H1-NMR 图Fig. 3 H1-NMR diagram of synthetic materials and polymers
2.3 PTX-HSU 的制备
固定HSU 载体投料量为18 mg,紫杉醇与HSU质量比为 1 ∶1.8,以粒径、 多分散指数(polydispersity index,PDI)、包封率、载药量为考察指标。精密称取HSU 载体18 mg,加水3 mL,室温溶解30 min,逐滴滴加25 mg/mL 的紫杉醇乙醇溶液400 μL 于载体水溶液中,剧烈搅拌15 min,冰浴探头超声30 min,重蒸水透析过夜,0.8 μm 滤膜滤过,即得载药胶束溶液。PTX-HU 同法可制得。
取500 μL 胶束溶液稀释至5 mL,通过激光粒度测定仪分别测定PTX-HSU 及PTX-HU 的平均粒径、PDI 和ζ 电位。结果见表1。PTX-HSU 和PTXHU 胶束ζ 电位稳定在−18~−20 mV,这是因为透明质酸结构中的-COOH 在水中解离为带负电荷COO−,较大的ζ 电位表明粒子间存在较大的斥力,说明该胶束制剂物理稳定性良好。
表1 粒径及分布、ζ 电位 (±s, n = 3)Table 1 Particle size and distribution, ζ potential (±s, n = 3)

表1 粒径及分布、ζ 电位 (±s, n = 3)Table 1 Particle size and distribution, ζ potential (±s, n = 3)
样品 粒径/nm PDI ζ 电位/mV 载药量% 包封率%PTX-HSU 152.8±8.5 0.105±0.010 −20.98±3.44 33.11±2.36 89.27±9.52 PTX-HU 183.4±3.7 0.176±0.009 −18.69±2.79 30.40±1.90 85.00±10.10
2.4 载药量与包封率的测定
精密量取100 μL PTX-HSU 和PTX-HU 胶束溶液,甲醇稀释定容至10 mL,参照本研究前期所建立的方法学,采用HPLC 法进行测定[19]。
紫杉醇含量测定色谱条件:色谱柱为Agilent 5 TC-C18(250 mm×4.6 mm,5 μm);流动相为甲醇-水(75∶25);体积流量为1 mL/min;进样量为20 μL;柱温为30 ℃;检测波长为227 nm。分别按照以下公式计算紫杉醇的载药量和包封率。
所制备的PTX-HSU 和PTX-HU 均具有较高的紫杉醇包封率(表1),分别为(89.27±9.52)%和(85.00±10.10)%;同时具有良好的负载效果,其载药量分别为(33.11±2.36)%和(30.40±1.90)%。
2.5 PTX-HSU 的物相鉴定
称取紫杉醇、HSU、紫杉醇与HSU 的物理混合物(含量比与PTX-HSU 相同)及PTX-HSU 适量,分别进行DSC 分析和XRD 测试。
2.5.1 DSC 紫杉醇、HSU、紫杉醇与HSU 物理混合物、PTX-HSU 冻干粉针的DSC 图谱如图4 所示。219.9 ℃(吸热峰)和240.8 ℃(放热峰)分别为紫杉醇的熔融峰和降解峰,说明紫杉醇是以结晶态存在;241.3 ℃放热峰为HSU 中修饰的熊果酸降解峰;紫杉醇的2 个特征峰(222.75、242.5 ℃)出现在紫杉醇和HSU 的物理混合物中,而未在PTXHSU 载药胶束图谱中出现;PTX-HSU 载药胶束图谱中仅出现了HSU 中熊果酸的降解峰(241.4 ℃);说明紫杉醇可能以分子状态或无定形形式存在于HSU 胶束骨架中。

图4 DSC 图谱Fig. 4 DSC patterns
2.5.2 XRD 紫杉醇、HSU、紫杉醇与HSU 物理混合物、PTX-HSU 载药胶束的XRD 图谱如图5 所示。XRD 图谱中5°、9°和12°处3 个强吸收峰以及15°~30°若干弱杂峰为紫杉醇特征峰;HSU 的XRD图谱在5°~30°无任何吸收峰;紫杉醇与HSU 物理混合物则在XRD 图谱中出现了紫杉醇的特征峰,而PTX-HSU 载药胶束图谱与HSU 图谱相似,在5°~30°无任何吸收峰。综合以上图谱数据,说明紫杉醇以分子状态或无定形存在于纳米胶束骨架中。

图5 XRD 图谱Fig. 5 XRD patterns
2.6 PTX-HSU 体外释药动力学考察
配制紫杉醇质量浓度为0.5 mg/mL的PTX-HSU和PTX-HU 溶液,分别取1 mL 置于透析袋(MWCO14 000)内,放入50 mL 含有不同GSH 浓度(0、10 mmol/L)的水杨酸钠(1 mol/L)的PBS(pH 7.4)缓冲液中,100 r/min 恒定振速和37 ℃温度下,考察紫杉醇制剂的体外释放特性。分别在0、1、3、6、8、10、12 h 用相同体积的新鲜释放介质更新释放介质,HPLC 测定释放介质中的紫杉醇质量浓度,计算各取样时间点紫杉醇的累积释放量。
体外释药结果如图6 所示。当GSH 浓度为0 mmol/L 时,PTX-HSU 和PTX-HU 在12 h 时累积释药量分别为76.31%和67.24%,二者释药趋势一致,均无快速释药的趋势;而在GSH 浓度为10 mmol/L时,PTX-HU 累积释放量仅为61.17%,而PTX-HSU累积释放量则已经达到89.18%;PTX-HU 载药胶束无论是0 μmol/L 或是10 mmol/L 的GSH 释放介质中,累积释放量相差不大;相对来说,PTX-HSU 在0 μmol/L 的GSH 释放介质中的12 h 累积释放量与PTX-HU 释放趋势一致,但是在10 mmol/L 的GSH释放介质中在3 h 内释放量急剧增加,呈现出快速释放现象,推测原因可能是因为HSU 分子结构中的二硫键被释放介质中的GSH 切断,促使处于PTXHSU 载药胶束核心的紫杉醇快速释放,证明HSU具有还原响应快速释药的能力。
2.7 体外逆转耐药
MCF-7 和MCF-7/ADR 细胞分别以1×104个/孔接种于96 孔板,细胞贴壁24 h 后,弃去培养基,不同紫杉醇质量浓度(0.001、0.01、0.1、1、10、100 μg/mL)的不同组(对照、紫杉醇、PTX-HSU、PTXHU)含药培养基培养48 h 后,弃去含药培养基,100 μL/孔加入MTT 溶液(1 mg/mL),37 ℃培养4 h 后,弃去培养液,加入150 μL DMSO,570 nm 波长测定吸光度。计算紫杉醇各制剂的半抑制浓度(50% inhibiting concentration,IC50),按照公式和分别计算耐药倍数和逆转倍数[20]。结果表明(表2),紫杉醇各制剂组对2 种乳腺癌细胞均呈现出浓度相关性的细胞毒性,且PTX-HSU 制剂组的IC50明显低于PTX-HU 和紫杉醇组,说明HSU 胶束作为载体可增强紫杉醇对肿瘤细胞的杀伤作用。
表2 体外逆转MDR 细胞毒性结果 (±s, n = 3)Table 2 Results of in vitro reversal of MDR cytotoxicity (±s, n = 3)

表2 体外逆转MDR 细胞毒性结果 (±s, n = 3)Table 2 Results of in vitro reversal of MDR cytotoxicity (±s, n = 3)
与紫杉醇组比较:*P<0.05**P<0.01***P<0.001;与PTX-HU 组比较:#P<0.05##P<0.01###P<0.001*P<0.05**P<0.01***P<0.001 vs paclitaxel group;#P<0.05##P<0.01###P<0.001 vs PTX-HU group
质量浓度/(μg∙mL−1)MCF-7 细胞存活率/% MCF-7/ADR 细胞存活率/%紫杉醇 PTX-HU PTX-HSU 紫杉醇 PTX-HU PTX-HSU 0.001 85.59±1.46 80.34±1.36 76.34±0.63* 99.11±1.68 97.63±1.49 96.37±3.20 0.01 72.81±3.59 52.94±0.97* 41.11±1.20**# 98.16±1.22 97.55±3.64 94.62±1.11 0.1 30.20±1.90 25.46±0.29 24.23±1.04* 94.00±1.00 93.15±2.18 93.33±0.78 1 24.39±0.17 21.41±0.15* 20.62±0.96* 87.03±2.19 84.74±0.39 66.32±3.63**##10 19.72±0.14 13.48±0.41*** 11.93±0.07***# 72.93±3.01 70.97±1.09 41.88±4.50***##100 12.98±0.20 9.64±0.36* 9.30±0.18** 42.18±0.27 41.46±0.95 30.14±0.94***###
在MCF-7 的细胞毒性结果中,紫杉醇、PTXHU 以及PTX-HSU 组的IC50分别为0.028、0.013、0.006 μg/mL,其中PTX-HU 制剂组IC50是紫杉醇组的2.15 倍,推测这可能是MCF-7 细胞表面过度表达CD44 受体(透明质酸靶向受体),MCF-7 细胞通过受体介导的内吞作用增加对PTX-HU 的摄取,使得更多的紫杉醇进入细胞内;而PTX-HSU 组IC50分别是PTX-HU 组和紫杉醇组的2.17 倍和4.67 倍,推测一方面可能是由于在受体介导的主动靶向摄取载药胶束后肿瘤细胞内强还原敏感环境切断了HSU 胶束中还原感二硫键,使得PTX-HSU 中紫杉醇相对紫杉醇组更多进入细胞的基础上,快速从胶束内释放出来,显著提高了抗肿瘤活性;另一方面,熊果酸自身就具有杀伤肿瘤细胞的能力,可能是HSU 胶束断裂后的疏水端熊果酸起到了杀伤MCF-7 细胞的作用。
在MCF-7/ADR 的细胞毒性结果中,紫杉醇、PTX-HU 以及PTX-HSU 组的IC50分别为15.01、13.09、1.39 μg/mL。为考察MCF-7/ADR 细胞对紫杉醇的耐药强度以及是否可以作为体外逆转MDR的细胞模型,通过计算得到MCF-7/ADR 细胞对紫杉醇的耐药倍数为533,表明此细胞对紫杉醇呈现出较强的耐药性,可以作为逆转MDR 的细胞模型。MTT 结果表明,紫杉醇各制剂组均显示出浓度依赖性的细胞毒性,通过各组制剂的IC50值计算MDR逆转倍数发现,PTX-HSU 组和PTX-HU 组相对紫杉醇组逆转倍数分别为10.79 倍和1.15 倍,且PTXHSU 组是PTX-HU 组的9.41 倍,表明HSU 载药系统在逆转乳腺癌MDR 方面呈现出明显的优势。原因推测一方面可能是由于HSU 通过透明质酸受体介导的内吞和连接臂CYS 还原敏感快速释药增效紫杉醇;另一方面可能与HSU 中疏水端熊果酸具有多靶点杀伤肿瘤耐药细胞的活性有关。
2.8 体外逆转耐药的细胞机制研究
2.8.1 HSU/HU 对细胞定性摄取的影响 MCF-7/ADR 细胞以1×105个/孔接种于24 孔板,按照0.5 mL/孔接种于24 孔板,37 ℃培养24 h 后,弃去培养基,分别加入含有C6-HSU 和C6-HU(胶束质量浓度为80 μg/mL)的培养基,37 ℃孵育0.5 h 后,弃去培养基,PBS 洗5 次,于倒置荧光显微镜下成像。结果如图7 所示,在相同条件下,给以C6-HSU干预的细胞内荧光强度显著强于给以C6-HU 干预的细胞。据文献报道[17],透明质酸的结构中羧基是透明质酸靶向受体(CD44 受体)的识别位点,其羧基的修饰程度与其靶向性有关;因此,推测可能是由于HU 结构中透明质酸骨架上的羧基修饰程度大于HSU,影响了其靶向效率,导致用C6-HU 干预的细胞内绿色荧光强度较弱;进一步推测,HSU 很可能可以通过增加乳腺癌耐药细胞对其的摄取量,以增加进入细胞内化疗药物的量,相对于单纯的化疗药,在耐药细胞同步外排的作用下,HSU 干预的细胞内化疗药有望具有更多的有效积累药量,来发挥部分逆转MDR 的作用。

图7 定性考察细胞对HSU 与HU 的摄取情况 (×400)Fig. 7 Qualitative examination of cellular uptake of HSU and HU (× 400)
2.8.2 HSU/HU 对细胞定量摄取的影响 细胞以5×105个/孔的细胞量接种于6 孔板中,按照2 mL/孔接种于6 孔板,37 ℃培养24 h 后,弃去培养基,分别加入含有C6-HSU 和C6-HU(胶束质量浓度为100 µg/mL)的培养基,37 ℃孵化4 h 后,移去上层供试液,加入预冷PBS 洗3 遍终止摄取。往6 孔板中加入消化液,收集细胞,2000 r/min 离心3 min,弃去上清液,用预冷PBS 洗3 遍后加入0.7 mL PBS重悬,在流式细胞仪的FL2 通道(Ex488 nm)检测C6 含量,分析结果。在竞争性抑制实验中,预先用质量浓度为10 mg/mL 的透明质酸溶液孵育2 h,再重复上述实验步骤。结果如表3 所示,在相同质量浓度下,HSU-C6 和HU-C6 组的荧光强度均大于游离C6(P<0.001),说明C6 探针经胶束包载后,在透明质酸的主动靶向作用下促进了细胞对C6 的摄取。HSU-C6 和HU-C6 相比,还原敏感型HSU 胶束组的荧光强度更强,推测是因为HSU 含有二硫键,可以使C6 快速释放从而促进C6 在细胞内的累积。同时,实验结果也表明,随着胶束浓度的增加,荧光强度也随之增加,说明细胞对胶束摄取呈现一定的质量浓度相关性。
表3 定量考察细胞对HSU 与HU 的摄取情况 (±s, n = 3)Table 3 Quantitative examination of cellular uptake of HSU and HU (±s, n = 3)
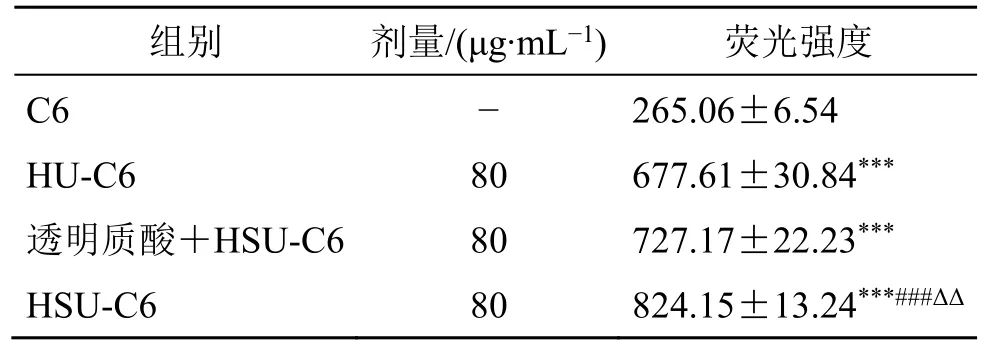
表3 定量考察细胞对HSU 与HU 的摄取情况 (±s, n = 3)Table 3 Quantitative examination of cellular uptake of HSU and HU (±s, n = 3)
与C6 组比较:***P<0.001;与HU-C6 组比较:###P<0.001;与透明质酸+HSU-C6 组比较:ΔΔP<0.01***P<0.001 vs C6 group;###P<0.001 vs HU-C6;ΔΔP<0.01 vs HA +HSU-C6 group
组别 剂量/(μg∙mL−1) 荧光强度C6 − 265.06±6.54 HU-C6 80 677.61±30.84***透明质酸+HSU-C6 80 727.17±22.23***HSU-C6 80 824.15±13.24***###ΔΔ
为进一步阐明胶束摄取机制,采用10 mg/mL 的透明质酸溶液先与细胞孵育,再加入HSU 胶束孵育。结果发现,HSU 胶束的摄取被显著抑制,荧光强度均显著低于不加透明质酸孵育的HSU 组(P<0.01),此结果表明HSU 胶束是通过透明质酸受体介导的内吞而被摄取的。
2.8.3 HSU 对胞内GSH 浓度的影响 MCF-7/ADR细胞以1×106个/孔接种于6 孔板,37 ℃培养24 h后,弃去培养基,用含有HA-CYS、HSU、HU 的培养基干预48 h 后,还原型谷胱甘肽测定试剂盒检测细胞内GSH 水平。结果表明(表4),相对于对照组,HA-CYS 均可显著(P<0.05)降低细胞内的GSH表达水平,推测可能是由于HA-CYS 中的二硫键与细胞内GSH 相互作用,胞内GSH 在此过程中得到消耗;HSU 在HA-CYS 的基础上,进一步降低了细胞内的GSH 表达水平(P<0.001),也可能与HSU释放的熊果酸有关,此结果与文献中报道熊果酸可以在一定程度上抑制细胞内GSH 表达结果一致[21]。
表4 胞内GSH 的测定结果 (±s, n = 3)Table 4 Determination results of intracellular GSH (±s,n = 3)

表4 胞内GSH 的测定结果 (±s, n = 3)Table 4 Determination results of intracellular GSH (±s,n = 3)
与对照组比较:*P<0.05**P<0.01***P<0.001;与HA-CYS 组比较:###P<0.001;与HU 组比较:ΔP<0.05*P < 0.05**P < 0.01***P < 0.001 vs control group;###P < 0.001 vs HA-CYS group;ΔP < 0.05 vs HU group
组别 GSH/(mmol∙L−1) 组别 GSH/(mmol∙L−1)对照 43.3±4.7 HU 19.2±1.7**HA-CYS 30.0±8.2* HSU 7.5±0.7***###Δ
HU 干预细胞48 h 后,相对对照组也显著性降低了细胞内GSH 表达水平(P<0.01),推测也可能是HU 释放了熊果酸有关;但是经HU 干预后的胞内GSH 表达水平显著性地高于HSU(P<0.05),可能是由于HU 结构中没有二硫键,既不能像HACYS 一样消耗细胞内GSH,也不能像HSU 一样快速释放熊果酸所致;文献报道[22],与GSH 相关的耐药机制主要包括:(1)GST-π 可以催化GSH 与化疗药物结合,使化疗药物易于从尿液中排出或代谢为无毒性的醇类物质;(2)GSH 的结构可以作为细胞外排MRP 泵的底物,GST-π 可以通过调节GSH 而控制MRP 的耐药程度。以上机制均表明胞内GSH浓度下降后均能减少化疗药外排。因此,推测HSU中的还原敏感二硫键与熊果酸共同作用,通过降低癌细胞内GSH 的水平,进一步降低了肿瘤细胞对紫杉醇的外排和代谢,来发挥逆转乳腺癌MDR 的作用。
3 讨论
本研究成功合成了还原敏感型和非还原敏感型透明质酸-熊果酸聚合物HSU 和HU。其中熊果酸以药载两用的形式,成功改善了其肿瘤靶向特异性低、水溶性差的缺点,提高了其生物利用度和临床应用。以HSU/HU 为载体成功制备了可高效负载紫杉醇的载药胶束PTX-HSU 和PTX-HU,在体外还原性环境中,PTX-HSU 制剂显示出还原响应快速释放药物的能力。PTX-HSU 和PTX-HU 均呈现出浓度依赖性的细胞毒性,其中HSU 不仅可以增强紫杉醇对MCF-7 细胞的抗肿瘤活性,而且可以增强紫杉醇对MCF-7/ADR 细胞的杀伤作用,在逆转乳腺癌MDR 方面呈现出一定的优势,实现了HSU 对乳腺癌MDR 的逆转目标。
通过对体外逆转耐药的细胞研究推测出,HSU是通过:(1)受体介导的胞吞作用进入MCF-7/ADR细胞内,增加MCF-7/ADR 细胞对HSU 的摄取量,以增加细胞内药物的有效积累来逆转MDR;(2)显著性地降低MCF-7/ADR 细胞中的GSH 表达水平,从而减少GSH 相关的药物外排以逆转MDR。
利益冲突所有作者均声明不存在利益冲突

