灵芝孢子多糖作为流感疫苗佐剂的免疫作用研究
陈秀红,赵丹萍,李欣昱,何 晶,吕瑞琳,张建军,赵忠鹏,王林元*
(1.北京中医药大学中药学院,北京 100029;2.安徽医科大学基础医学院,合肥 230032;3.北京中医药大学中医学院,北京 100029)
流感是一种危害人类健康的常见传染性疾病,目前接种疫苗是预防流感的最有效方式,但目前已批准的人用流感疫苗,如裂解疫苗等,保护效果并不是十分理想[1]。佐剂的应用将有助于增强流感疫苗的免疫效果。已批准上市流感疫苗佐剂主要有铝盐佐剂、MF59、AS03 及类病毒颗粒等[2],但存在免疫效果不理想、不良反应大、种类少、产率低、造价高等问题[3],因此开发出安全、有效、经济易得的佐剂是流感疫苗的重要研究方向。
中药多糖可通过增强体液免疫、细胞免疫和黏膜免疫应答,发挥免疫促进作用,且在动物疫苗佐剂中已有应用,具有免疫调节、生物相容性、可生物降解、低毒、安全等特点[4-6]。前期课题组研究发现灵芝孢子作为流感疫苗的口服免疫佐剂可显著提高小鼠的抗体水平,增强了机体的细胞和体液免疫水平。灵芝孢子多糖(ganoderma lucidum spore polysaccharide,GLSP)是灵芝孢子中的主要活性成分,具有较强的免疫作用[7]。因此,灵芝孢子多糖开发人用流感免疫佐剂具有较大潜力。本研究以灵芝孢子多糖联合流感疫苗共同免疫小鼠,并以氢氧化铝佐剂作为阳性对照,通过检测血清特异性抗体水平、脾脏T、B 淋巴细胞增殖分化、骨髓树突细胞共刺激分子表达、血清细胞因子含量等指标,研究灵芝孢子多糖对流感疫苗免疫小鼠的免疫效果及作用机制,为灵芝孢子多糖作为疫苗佐剂的研究和应用提供了研究基础。
1 材料与方法
1.1 材料
1.1.1 动物 SPF 级BALB/c 小鼠,雌性,6 ~8 周龄,体质量16 ~18 g,购自斯贝福(北京)生物技术有限公司,所有动物实验均经北京中医药大学动物福利与伦理委员会批准(伦理号:BUCM-4-2021072302-3034),饲养条件:温度22 ~26℃,相对湿度60%~70%。
1.1.2 免疫原及药物 甲型H1N1 流感病毒裂解疫苗原液(HA:291 μg/mL;Pr:421 μg/mL)由长春海基亚生物技术股份有限公司提供。灵芝孢子多糖由本课题组制备,其提取原料去壁的灵芝孢子粉由浙江寿仙谷公司提供,提取工艺采用水提醇沉法,按照2020 版中国药典“灵芝”项下多糖含量测定方法检测的灵芝孢子多糖含量为91%。
1.1.3 试剂 H1N1(A/PR/8/1934)流感病毒毒株由中国军事医学科学院提供,凝血滴度均为1:256。注射用氢氧化铝/明矾佐剂(40 mg/mL),购自Bioss 生物技术有限公司。RDE(受体破坏酶)购自Denka Seiken(日本)。1%鸡红细胞(广州宏泉生物科技有限公司)
PBS(sigma);RPMI 1640(Invitrogen);FBS(Beijing Aoqing Biotechnology Co.,LTD);MTT(Solarbio);ConA (Apexbio);LPS(sigma);DPBS(sigma)。小鼠TNF-α、IL-4 ELISA 试剂盒均购自上海酶联生物技术有限公司;流式抗体:Brilliant Violet 605™ Anti-Mouse CD45(BioLegend)、BV421 Rat anti-mouse CD25(BD)、BV510 Hamster anti-mouse CD3e(BD)、mCD8-R208-APC(sinobiological)、mCD4-R711-FITC(sinobiological)、FITC Anti-Mouse MHC-Ⅱ(I-A/I -E)(eBioscience)、BV421 Hamster Anti-Mouse CD80 (BD)、PE Rat Anti-Mouse CD86(BD)、BV786 Hamster Antimouse CD11c(BD)。
1.1.4 仪器 流式细胞仪(Nonocyte、 ACEA)、离心机(5810R、Eppendorf)、漩涡混合仪(88880018、Thermo)、酶标仪(Epoch 2、BioTeK)。
1.2 方法
1.2.1 动物分组及免疫 BALB/c 雌性小鼠随机分为4组,每组6 只,分别为空白对照组(Control)、疫苗组(VA)、疫苗+铝佐剂组[Al(OH)3]、疫苗+灵芝孢子多糖组(GLSP)。各组小鼠分别于实验第0 天、第14 天进行初次免疫和加强免疫,空白组小鼠肌肉注射PBS 溶液,VA 组、Al(OH)3组和GLSP 组小鼠分别肌肉注射流感疫苗原液(15 μg 血凝素/只小鼠)、流感疫苗原液与氢氧化铝(100 μg/只小鼠)[8]、流感疫苗原液与灵芝孢子多糖(800 μg/只小鼠)的混合溶液,免疫体积为0.2 mL/只小鼠[9]。免疫后不同时间点称量小鼠体质量并观察小鼠的生长状态,并于加强免疫后第14天、第30天眼眶取血,检测特异性抗体水平,加强免疫后第49 天取血清,分离胸腺、脾脏、骨髓细胞等,检测各项指标。
1.2.2 一般状况及体质量 每次免疫后观察小鼠是否有过敏反应,蜷缩、竖毛、喷嚏、抽搐及休克等;进一步观察小鼠的精神状态,进食、活动、注射部位有无硬结、出血或者溃烂情况,并记录实验第0、14、28、42 及63 天等不同时间各组小鼠体质量。
1.2.3 血凝抑制(HI)法检测小鼠血清中特异性抗体滴度 各组小鼠于加强免疫后14 d、28 d 眼眶采血,分离血清,采用血凝抑制法测定小鼠血清中H1N1 特异性抗体滴度[10]。抗体滴度表示为最高抗体滴度稀释倍数的倒数。
1.2.4 小鼠胸腺、脾脏指数 小鼠取血后,分离胸腺、脾脏,滤纸吸干残血后,称重,按下列方法计算胸腺指数:胸腺指数=(胸腺质量/体质量)×10,脾脏指数:脾脏指数=脾脏质量/体质量×10。
1.2.5 酶联免疫吸附(ELISA)法检测小鼠血清中细胞因子水平 各组小鼠加强免疫后49 d 取血并分离血清,采用ELISA 法检测小鼠血清中IL-4、TNF-α 含量,检测步骤按照试剂盒说明书进行,于450 nm 波长检测吸光度(OD)值并计算细胞因子浓度。
1.2.6 MTT 法检测脾脏淋巴细胞增殖 各组小鼠加强免疫后49 d,无菌条件下取脾,制备脾细胞悬液,按照每毫升1×106个脾细胞悬液加入96 孔板,分别加入5 μg/mL 的ConA 和5 μg/mL 的LPS,每组设置3个复孔,于37 ℃培养箱中孵育48 h,采用MTT 法检测T、B 淋巴细胞的增殖活性。细胞增殖率用刺激指数SI 表示:SI =(实验组OD -空白组OD)/(阴性对照OD -空白组OD)。
1.2.7 流式细胞术检测脾脏CD4+、CD8+、CD25+T 细胞亚型 各组小鼠脾细胞悬液分装至96 孔板中,每孔50 µL,37℃培养4 h,离心弃上清,加入Brilliant Violet605™ Anti-Mouse CD45(BioLegend)、BV421 Rat antimouse CD25(BD)、BV510 Hamster anti-mouse CD3e(BD)、mCD8-R208-APC(sinobiological)、mCD4-R711-FITC(sinobiological)抗体混合液,4℃避光孵育30 min,离心洗细胞2 次,重悬,采用流式细胞仪进行上机检测。
1.2.8 流式细胞术检测小鼠骨髓树突细胞(DC)中MHC II+、CD80+、CD86+水平 各组小鼠无菌条件下取小鼠股骨和胫骨,并进行无菌处理制备骨髓细胞悬液,骨髓细胞分装至U 底96 孔板中,每管75 µL,加入FITC Anti-Mouse MHC-Ⅱ(I-A/I -E)(eBioscience)、BV421 Hamster Anti-Mouse CD80 (BD)、PE Rat Anti-Mouse CD86(BD)、BV786 Hamster Anti-mouse CD11c(BD)抗体混合液,4℃避光孵育20 min,洗液为含BSA 的PBS 溶液,重悬,采用流式细胞仪进行上机检测。
2 结果
2.1 各组小鼠体质量变化情况比较 分别于实验第0、14、28、42 及63 天不同时间点称量小鼠体质量并观察小鼠的生长状态,结果见表1。免疫期间小鼠无过敏反应,进食活动正常,状态良好,各组小鼠体质量随时间推移呈增长趋势,各组间无差异,符合小鼠正常生长特性,表明灵芝孢子多糖对小鼠无不良反应。
表1 各组小鼠体质量变化情况比较(± s,n = 6) g

表1 各组小鼠体质量变化情况比较(± s,n = 6) g
组别 第0 天 第14 天 第28 天 第42 天 第63 天空白对照组 17.46±1.63 20.11±1.99 20.99±2.13 21.66±2.78 22.60±2.76疫苗组 17.44±1.45 20.49±1.40 21.32±1.49 23.01±1.47 24.21±2.13疫苗+铝佐剂组 17.44±1.45 20.18±0.99 20.28±1.73 22.66±1.09 23.23±1.03疫苗+灵芝孢子多糖组 17.44±1.45 20.18±0.99 21.36±1.48 22.87±1.60 23.68±1.69
2.2 各组小鼠血清中HI 抗体滴度比较 见表2。
表2 各组小鼠血清中HI 抗体滴度比较(± s,n = 5) log2

表2 各组小鼠血清中HI 抗体滴度比较(± s,n = 5) log2
注:与疫苗组比较,# P <0.05
组别 二免后14 d 二免后30 d疫苗组 6.67±0.82 6.50±0.55疫苗+铝佐剂组 8.6±2.30 6.8±1.10疫苗+灵芝孢子多糖组 10.17±1.17# 7.67±1.75
2.3 各组小鼠脏器指数变化比较 见表3。
表3 各组小鼠脏器指数变化比较(± s,n = 6)

表3 各组小鼠脏器指数变化比较(± s,n = 6)
组别 脾脏指数 胸腺指数空白对照组 45.75±3.33 16.93±3.43疫苗组 45.63±3.30 15.22±3.20疫苗+铝佐剂组 42.65±4.48 16.57±1.95疫苗+灵芝孢子多糖组 41.72±2.66 16.07±1.78
2.4 各组小鼠血清中细胞因子的水平比较 见表4。
表4 各组小鼠血清中细胞因子的水平比较(± s,n = 6)pg/mL

表4 各组小鼠血清中细胞因子的水平比较(± s,n = 6)pg/mL
注:与空白对照组比较,# P <0.05,## P <0.01;与疫苗+铝佐剂组比较,△P <0.05
组别 IL-4 TNF空白对照组 62.56±12.97 352.01±17.36疫苗组 63.99±8.19 517.61±70.43#疫苗+铝佐剂组 71.45±9.41 416.24±49.36疫苗+灵芝孢子多糖组 84.54±14.81##△ 493.70±48.30##
2.5 ConA 和LPS 刺激的脾淋巴细胞增殖变化比较 见表5。
表5 ConA 和LPS 刺激的脾淋巴细胞增殖变化比较(± s,n = 3)

表5 ConA 和LPS 刺激的脾淋巴细胞增殖变化比较(± s,n = 3)
注:与空白对照组比较,# P <0.05,## P <0.01,### P <0.001;与疫苗组比较,△△P <0.01;与疫苗+铝佐剂组比较,▲P <0.05
组别 ConA LPS空白对照组 0.81±0.53 2.28±0.85疫苗组 1.43±0.87 2.72±2.01疫苗+铝佐剂组 2.68±0.42## 2.47±0.90疫苗+灵芝孢子多糖组 3.36±1.51###△△ 5.17±1.53#▲
2.6 流式细胞术检测各组脾T 淋巴细胞免疫表型的表达比较 采用流式细胞术检测脾脏T 淋巴细胞亚群中CD3+,CD3+CD4+,CD3+CD8+和CD3+CD4+CD25+的表达水平,结果见表6,如图1。灵芝孢子多糖组中CD4+细胞含量升高,CD8+细胞含量下降,但无差异,CD25+含量显著升高(P<0.01)。结果表明在免疫过程中,灵芝孢子多糖可能诱导产生了较强的免疫反应,为维持机体自身稳定,诱导Treg 细胞增殖活化,从而抑制了CTL 细胞的活化和增殖,提示GLSP 具有较强的免疫调节作用。

图1 流式细胞术检测各组脾T 淋巴细胞免疫表型表达的变化
表6 流式细胞术检测各组脾T 淋巴细胞免疫表型的表达比较(± s,n = 3)
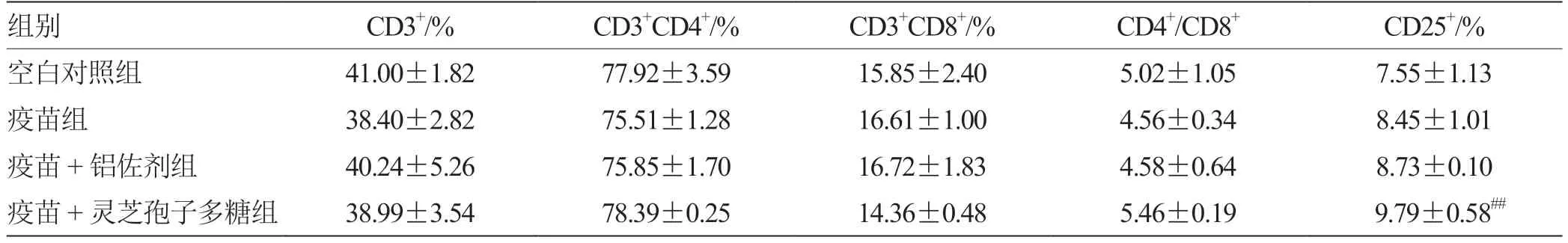
表6 流式细胞术检测各组脾T 淋巴细胞免疫表型的表达比较(± s,n = 3)
注:与空白对照组比较,## P <0.01
组别 CD3+/% CD3+CD4+/% CD3+CD8+/% CD4+/CD8+ CD25+/%空白对照组 41.00±1.82 77.92±3.59 15.85±2.40 5.02±1.05 7.55±1.13疫苗组 38.40±2.82 75.51±1.28 16.61±1.00 4.56±0.34 8.45±1.01疫苗+铝佐剂组 40.24±5.26 75.85±1.70 16.72±1.83 4.58±0.64 8.73±0.10疫苗+灵芝孢子多糖组 38.99±3.54 78.39±0.25 14.36±0.48 5.46±0.19 9.79±0.58##
2.7 各组小鼠骨髓树突细胞表面刺激分子含量比较 采用流式细胞术检测小鼠骨髓树突细胞中MHC II类分子以及共刺激分子CD80、CD86,结果见表7,如图2。与空白对照组比较,灵芝孢子多糖能显著增强MHC II分子表达(P<0.001),且显著优于疫苗组(P<0.001)及铝佐剂组(P<0.05);灵芝孢子多糖组共刺激分子CD86+表达显著增强,优于疫苗组及铝佐剂组(P<0.05);CD80+分子水平有升高,但无显著差异,表明灵芝孢子多糖可促进DC 细胞成熟并提高了DC的抗原提呈能力,进而加强了激活初始T 细胞的能力,在免疫应答中发挥了重要作用。

图2 各组小鼠骨髓树突细胞表面刺激分子含量变化
表7 各组小鼠骨髓树突细胞表面刺激分子含量比较(± s,n = 3)

表7 各组小鼠骨髓树突细胞表面刺激分子含量比较(± s,n = 3)
注:与空白对照组比较,### P <0.001;与疫苗组比较,△P <0.05,△△△P <0.001;与疫苗+铝佐剂组比较,▲P <0.05
组别 CD11C+MHCII+/% MHCII+CD86+/% MHCII+CD80+/% CD80+/CD86+空白对照组 0.59±0.13 19.06±1.51 44.51±1.23 2.34±0.16疫苗组 0.53±0.02 15.98±2.30 44.80±7.58 2.80±0.13疫苗+铝佐剂组 0.76±0.14△ 11.54±1.23### 36.33±1.07## 3.16±0.24疫苗+灵芝孢子多糖组 1.04±0.12###△△△▲ 21.88±1.35△▲ 50.16±6.56 2.29±0.18
3 讨论
中药多糖类成分是当前作为流感疫苗佐剂研究的重点,其种类繁多,且每种多糖均具有独特的免疫作用,可以通过激活T、B 淋巴细胞等免疫细胞,激活补体,促进干扰素生成,诱生细胞因子等方式产生强大的免疫调节作用,影响机体的免疫功能,很有希望开发成为新型疫苗佐剂[8,11-12]。灵芝孢子多糖是灵芝孢子中的重要活性成分,具有较强的免疫调节作用[7]。本实验将灵芝孢子多糖和流感疫苗共同免疫小鼠,通过检测特异性抗体滴度、细胞因子水平、脾脏T、B 淋巴细胞增殖、脾脏T 淋巴细胞亚群及骨髓树突细胞共刺激分子等指标评价灵芝孢子多糖对小鼠体液免疫和细胞免疫的应答能力,并深入探讨其作为疫苗佐剂的免疫效果及作用机制。
本实验结果发现,灵芝孢子多糖可明显提高小鼠的抗体效价,一般来说免疫原性HI 抗体效价≥1: 40被认为是流感疫苗注册时评价有效性的重要指标[13],本研究结果灵芝孢子多糖组二免后抗体14 d 效价大于1 024,二免后30 d 效价大于128,且强于铝佐剂组,具有较好的体液免疫应答,表明灵芝孢子多糖可增强机体的体液免疫应答,诱导和促进抗体的产生。
细胞因子对机体的免疫应答具有重要调节作用[14]。按功能划分为Th1 型细胞因子、Th2 型细胞因子[15],Th1 细胞主要促进细胞介导的免疫,而Th2 细胞以促进抗体产生为主[16]。本实验对小鼠血清中细胞因子水平进行检测,研究结果表明灵芝孢子多糖佐剂可刺激Th2 型细胞因子IL-4、Th1 型细胞因子TNF-α 分泌,而常用的铝佐剂只能诱导Th2 型免疫应答[17],因此,灵芝孢子可平衡Th1/Th2 型免疫应答,诱导机体同时产生细胞免疫和体液免疫。
T 淋巴细胞和B 淋巴细胞分别执行不同的免疫功能,T 淋巴细胞主要参与人体的细胞免疫功能,病原微生物侵入人体后,可以直接发挥免疫作用;B 淋巴细胞会增殖变成浆细胞,然后产生抗体,通过抗体结合抗原而发挥免疫作用[18]。本实验研究结果表明灵芝孢子多糖可显著提高LPS 诱导的B 细胞及ConA 诱导的T 细胞的增殖活性。因此,灵芝孢子多糖可在机体接触抗原后刺激T 淋巴细胞直接发挥细胞免疫作用,刺激B 淋巴细胞增殖分化,促进产生抗体。
T 淋巴细胞对机体免疫性能的稳定具有重要的调节作用,CD4+T 细胞具有辅助细胞免疫和体液免疫的功能;CD8+T 细胞主要是杀死感染了病原体的宿主细胞和破坏肿瘤细胞;在细胞免疫中,T 淋巴细胞中CD4+和CD8+淋巴细胞数量及比值的变化直接反映机体的免疫应答水平。当CD4+和CD8+比值增大时,表明机体具有较强的免疫功能[19]。Treg 细胞具有负向免疫调节能力,CD25+是其标志性表面分子[20]。本实验发现,灵芝孢子多糖作为流感疫苗佐剂免疫小鼠,增加了CD4+细胞表达,降低了CD8+细胞的表达,CD4+/CD8+比值升高,在免疫过程中灵芝孢子多糖诱导产生了较强的免疫反应。同时为维持机体自身稳定,灵芝孢子多糖组小鼠调节T 细胞标志性表面分子CD25+表达水平显著升高,诱导Treg 细胞增殖活化,从而抑制了CTL 细胞的活化和增殖,因此CD8+细胞水平降低,抑制性细胞因子IL-4 含量升高,提示灵芝孢子多糖不仅有免疫增强作用,同时也可表现出免疫抑制,具有较强的免疫调节作用。
树突状细胞是机体功能最强的专职抗原递呈细胞,树突状细胞的成熟和分化是获得性免疫应答重要的一步[21]。MHC Ⅱ作为其表面的抗原提呈分子,与外源性抗原结合成复合物形式提呈给CD4+T 细胞,是T 细胞活化的第一启动信号[22],进而可激活细胞免疫应答。DC 在成熟过程中细胞表面表达的共刺激分子CD80 和CD86 与T 细胞表面表达的CD28 分子相互作用,共同促进T 细胞向Th2 分化[23],从而诱导体液免疫。本实验结果表明,灵芝孢子多糖能显著增强小鼠骨髓树突细胞表面MHC II 分子水平、共刺激分子CD86 和CD80 分子水平,表明GLSP 可促进DC 细胞成熟并提高了DC 的抗原提呈能力,进而加强了激活初始T 细胞的能力,且促进T 细胞向Th2 分化,从而诱导体液免疫。
综上所述,灵芝孢子多糖作为流感疫苗新型佐剂,可提升机体的免疫应答水平,促进Th1/Th2型免疫应答,促进T、B 淋巴细胞增殖分化诱导机体同时产生细胞免疫和体液免疫;调节T 淋巴细胞亚群水平产生免疫调节;通过促进DC 细胞成熟并提高DC 的抗原提呈能力提高机体对抗原的免疫应答。本研究结果提示灵芝孢子多糖可作为一种新型免疫佐剂值得进行深入研究。

