应用肿瘤相关抗原P53、IMPDH、LAMR1和ENO1的肽抗原检测非小细胞肺癌患者的自身抗体
陈世豪,金 鹏,李诗扬,李 扬,刘倩倩,陈玉丙*
(1.吉林大学药学院,吉林 长春130021;2.吉林大学第二医院 肿瘤放疗科,吉林 长春130041)
肿瘤相关抗原(TAAs)在不同类型肿瘤和不同肿瘤个体之间存在差异,但是在一些肿瘤患者中,可检测到针对TAAs免疫应答产生的自身抗体[1]。在TAAs被检测到之前,自身抗体就已出现,甚至在CT检测或发病率筛查能够识别肿瘤之前数年就能被检测到[2-3]。因此自身抗体也被认为是肿瘤早期诊断和预后监测的生物标志物[2,4]。2011年有团队首次研发出用TAAs检测自身抗体的肺癌诊断试剂EarlyCDT○R-Lung,包括p53、NY-ESO-1、DDX53、GBU4-5、ANXA1和SOX2等6个TAAs,其敏感性为40%,特异性为82%[5]。后来又对其优化升级,包括P53、NY-ESO-1、DDX53、GBU4-5、HuD、MAGE A4和SOX2-B等7种TAAs,使其敏感性达到47%,特异性达到90%[6]。
机体针对TAAs分泌自身抗体的机制尚不清楚,但有研究认为,针对TAAs的免疫应答可能源于TAAs免疫原性的增加,包括抗原突变、抗原折叠改变、异常降解、过表达、异位表达及异常糖基化等[7]。由于蛋白质抗原分子较大,用多种蛋白质联合检测来提高敏感性比较困难。因此本课题组开发了一种应用线性肽抗原的酶联免疫吸附试验(ELISA)检测自身抗体,使TAAs自身抗体的检测成为诊断或筛查肿瘤及监测抗肿瘤治疗后复发的一种方法。本课题组已选择了多种TAAs进行了相关研究。
已有报道证实肿瘤相关抗原P53和ENO1的自身抗体在多种肿瘤中被检测到[8-11],而IMPDH、LAMR1在多种肿瘤中高表达[12-15]。本研究选择肿瘤相关抗原P53、IMPDH、LAMR1和ENO1,应用其肽抗原检测非小细胞肺癌中的相应自身抗体,为肺癌筛查及预后监测手段的建立提供更多有价值的实验室依据。
1 材料与方法
1.1 研究设计和样本信息
本研究收集了从2013年1月至2018年1月吉林大学第二医院确诊的221名NSCLC患者血标本,纳入标准是首次确诊为NSCLC且未经任何抗肿瘤治疗的患者。NSCLC患者均通过组织病理学确诊,并根据美国癌症联合委员会(AJCC)癌症分期手册的第八版确定肿瘤分期。排除复发、转移癌或合并其他肿瘤病史及多肿瘤患者,排除合并自身免疫性疾病及其它严重并发症如糖尿病、肝病患者。同时取243名于吉林大学第二医院体检中心体检的年龄、性别匹配的健康体检者血标本作为健康对照组。参与者的基本信息见表1,NSCLC组和健康对照组性别、年龄无明显差异。
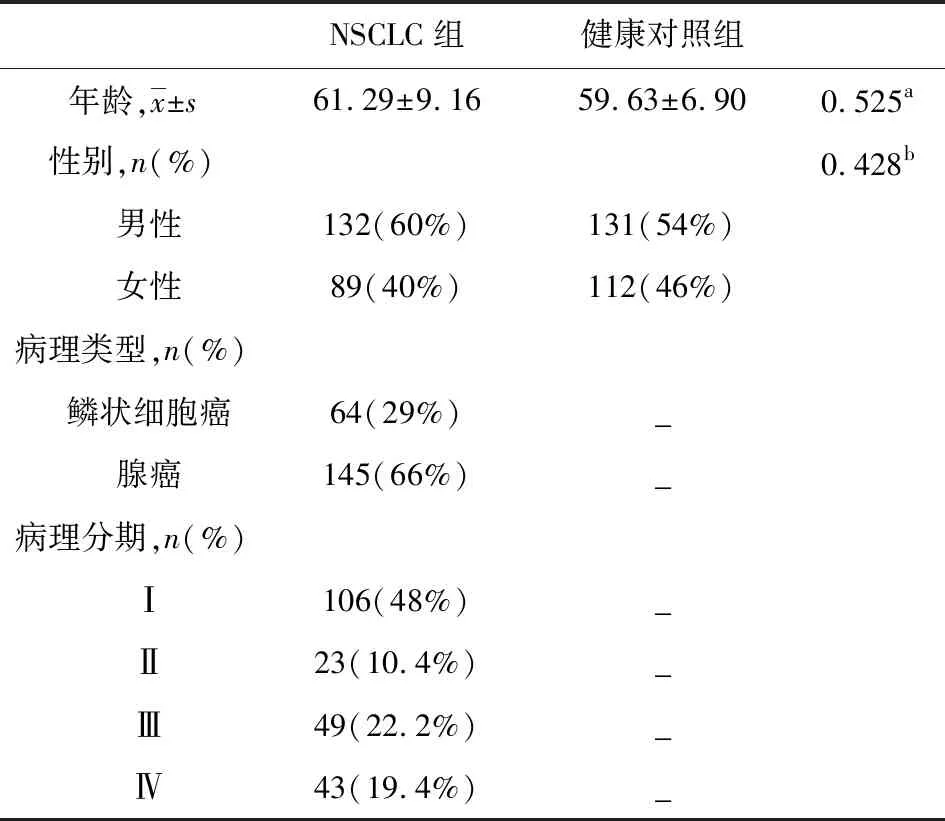
表1 参与者信息和临床病理学特征
1.2 应用ELISA方法检测自身抗体
应用免疫学软件和免疫信息学数据库(IMGT 数据库、IMGT/HLA 数据库、T 细胞表位查询和预测数据库)及HLA 表位结合预测工具设计并用固相合成法合成肽抗原(hAgs),每个hAg携带超过10个重叠的HLA-Ⅱ限制性表位,纯度>95%。并根据山羊α-乳清蛋白蛋白质序列(Gene Bank登录号NP_002280.1)设计对照肽抗原(cAg),该蛋白质序列不含任何类似于源自人的配对物序列的HLA-Ⅱ表位。
将肽抗原溶解并调整浓度至10 μg/ml,取100 μl加至酶标板,4℃孵育过夜。弃去孔中液体,每孔加PBS洗液200 μl,洗涤3次。将血清样品、阴性对照品(BSA分析液)和质控品(200名健康者的混合血清样品)用BSA分析液按1∶100倍稀释,分别取100 μl加入酶标板,室温(18~22℃) 孵育1.5 h。洗涤3次后加1∶20 000倍稀释的过氧化物酶标记的羊抗人IgG抗体100 μl,室温孵育1 h。洗涤3次后,每孔加TMB显色液100 μl,避光孵育20 min,每孔再加50 μl终止液,终止反应。液体由蓝色变为黄色,5 min内应用酶标仪测定450 nm处的吸光度。所有检测样本均设置双复孔,取平均OD值作为检测结果。用特异结合指数(SBI)表示血清中的抗体水平:
SBI=(ODhAg-ODNC)/(ODcAg-ODNC)
ODNC为阴性对照的OD值。
1.3 统计学分析

2 结果
2.1 NSCLC组和健康对照组血清中肿瘤相关抗原的自身抗体的水平
应用肿瘤相关抗原P53、IMPDH、LAMR1和ENO1的肽抗原检测自身抗体,结果显示NSCLC组P53、IMPDH、LAMR1和ENO1的自身抗体明显高于健康对照组(P<0.001)(图1,表2)。
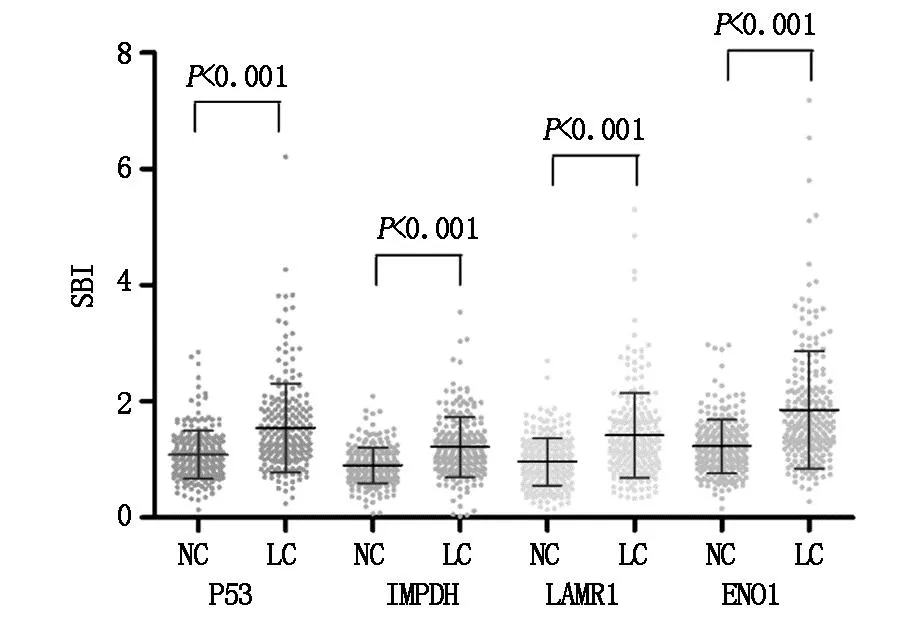
图1 NSCLC组(LC)和健康对照组(NC)血清中TAAs自身抗体的水平

表2 NSCLC患者P53、IMPDH、LAMR1和ENO1自身抗体的水平
2.2 不同病理类型的NSCLC肿瘤相关抗原的自身抗体的水平
对NSCLC的腺癌和鳞癌患者的P53、IMPDH、LAMR1和ENO1的自身抗体水平分别分析,结果表明腺癌和鳞癌患者的P53、IMPDH、LAMR1和ENO1的自身抗体水平均显著高于健康对照组,差异有统计学意义(P<0.05),且腺癌患者自身抗体水平显著高于鳞癌(P<0.05)(表2)。
2.3 不同病理分期的NSCLC患者的肿瘤相关抗原的自身抗体的水平
按照NSCLC的病理分期,对NSCLC患者的P53、IMPDH、LAMR1和ENO1的自身抗体分别分析,结果显示Ⅰ~Ⅳ期自身抗体水平均显著高于健康对照组,差异有统计学意义,P<0.05(表3),各期之间没有明显差异。

表3 不同病理分期的NSCLC患者P53、IMPDH、LAMR1和ENO1的自身抗体水平
3 讨论
肿瘤相关抗原的自身抗体因其独特的优点,在第一临床症状出现之前即已稳定、持续地存在于外周血中,且比较容易被检测到,已成为受关注的肿瘤标志物[7,16]。BABEL等[17]应用含有8 000 种人蛋白质的蛋白微阵列,检测结直肠癌患者TAAs的自身抗体,发现 PIM1、MAPKAPK3、STK4、SRC和FGFR4的水平最高,经ROC进一步分析表明MAPKAPK3和ACVR2B蛋白的组合可使特异性达73.9%,敏感性达83.3%,AUC值达0.85。本研究中NSCLC患者P53、IMPDH、LAMR1和ENO1自身抗体水平明显高于健康对照组(P<0.001)。表明P53、IMPDH、LAMR1和ENO1自身抗体对NSCLC的诊断具有潜在价值。Rom 应用ROC分析c-myc、Cyclin A、Cyclin B1、Cyclin D1、CDK2 和 survivin组合评估吸烟和不吸烟的健康人患肺癌的风险,AUC达0.907,特异性97%时灵敏度达81%[18]。所以多种TAAs组合检测自身抗体,可使其灵敏性和特异性达到最优。但是检测自身抗体的肺癌诊断试剂EarlyCDT○R-Lung[5-6]的敏感性比较低,可能与其使用基因工程完整抗原有关,而本研究应用的是携带超过10个重叠的HLA-Ⅱ限制性表位的肽抗原检测对应的自身抗体,容易获得高敏感性。
有研究也证实了TAAs的自身抗体在肺癌早期的诊断性能,Yao等检测了93名NSCLC患者DKK1自身抗体的水平,ROC分析结果显示其敏感性为62%,对Ⅰ期NSCLC患者检测的敏感性达到64.3%[19]。本研究中Ⅰ期NSCLC患者的P53、IMPDH、LAMR1和ENO1的自身抗体水平即显著高于健康对照组(P<0.001),可以把NSCLC患者与健康人区分开。甚至能把不同病理类型腺癌和鳞癌区分开(P<0.05),LEIDINGER的研究可以把鳞状细胞肺癌和非肿瘤肺部疾病区分开[20]。
可见检测TAAs的自身抗体对癌症诊断、筛查和预后监测有潜在价值,但使检测的灵敏性和特异性达到最优,仍需进一步筛选TAAs及其组合,以及大规模的临床研究。

